24.11.2010 |
Mateusz Kaniewski Marcin Górski |
Gr.V
|
Ćwiczenie 17 |
WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAY'A |
|
Celem ćwiczenia jest przeprowadzenie procesu elektrolizy wodnego roztworu siarczanu miedzi, wyznaczenie równoważnika elektrochemicznego i stałej Faraday'a.
Wykonanie ćwiczenia:
1. Elektrody (katodę i anodę) zanurzyliśmy na chwilę w roztworze kwasu azotowego (1:1), następnie wypłukaliśmy wodą destylowaną i wysuszyliśmy. Tak przygotowaną elektrodę siatkową zważyliśmy na wadze analitycznej, z dokładnością do 0,1 mg .
2. Przełącznikiem ,,POWER” uruchomiliśmy elektrolizer.
3. W uchwytach z zaciskami umieściliśmy elektrody (tak jak na rys.1.). Zważoną elektrodę siatkową i spiralną zamocowaliśmy tak, aby elektroda siatkowa była katodą, a spiralna - anodą.
4. Na podstawie umieściliśmy zlewkę o poj. 150 cm3 napełnioną roztworem siarczanu miedzi.
5. Opuściliśmy elektrody, przy użyciu przełącznika ,,elektrody” (rys.2.), w taki sposób, aby były w całości zanurzone w badanym roztworze, włożyliśmy mieszadełko i odpowiednim przełącznikiem (15) uruchomiliśmy mieszanie.
6. Proces rozpoczeliśmy, ustawiając niewielkie napięcie prądu na panelu oznaczonym ,,V” pokrętłem ,,nastawa” (6), a następnie na panelu ,,A” ustawiliśmy natężenie prądu (2): 0,6 A. Do dokładnego ustawienia wartości natężenia prądu użyliśmy pokrętła ,,precyzer” (3).
7. Przełącznikiem ,,grzanie” (11) ustawiliśmy max. temperaturę. Elektrolizę prowadziliśmy przez 15 minut.
8. Po zakończeniu elektrolizy, elektrodę opłukaliśmy wodą zakwaszoną H2SO4, przemyliśmy wodą destylowaną i wysuszyliśmy.
9. Tak przygotowaną elektrodę zważyliśmy.
10. Pomiar wykonaliśmy trzykrotnie (powtarzaliśmy punkty od 1 do 9).
11. Elektrodę oczyściliśmy z miedzi jak w punkcie 1.
Rys.1. Widok elektrod zamocowanych w głowicy elektrolizera.
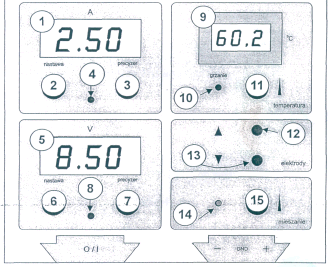
1 - miernik prądu
2 - nastawa prądu
3 - precyzer nastawy prądu
4 - LED informujący o stabilizacji prądu
5 - miernik napięcia
6 - nastawa napięcia
7 - precyzer nastawy napięcia
8 - LED informujący o stabilizacji napięcia
9 - miernik temperatury
10 - dwukolorowy LED (grzanie/chłodzenie)
11 - regulacja temperatury stolika
12, 13 - ruch głowicy w górę/dół
14 - LED mieszanie złączone
Rys.2. Widok płyty czołowej elektrolizera. 15 - pokrętło regulacji prędkości mieszania
II. Wyniki pomiarów:
Lp. |
Masa katody przed elektrolizą [g] |
Masa katody po elektrolizie [g] |
Masa wydzielonej miedzi [g] |
Czas elektrolizy [s] |
Natężenie [A] |
1 |
14,6041 |
14,7867 |
0,1826 |
900 |
0,6 |
2 |
14,6037 |
14,7734 |
0,1697 |
900 |
0,6 |
3 |
14,6079 |
14,7186 |
0,1107 |
900 |
0,6 |
Tabela 1.
III. Opracowanie wyników:
1. Obliczanie równoważnika elektrochemicznego miedzi.
Musimy pierw obliczyć ładunek jaki przepłynął przez elektrolizer, a robimy to na podstawie wzoru:
Q= I * t
Gdzie:
q - ładunek [C]
I - natężenie [A] (lub [C/s]
t - czas elektrolizy [s]
q dla wszystkich pomiarów wychodzi 540 [C]
Aby obliczyć równoważnik elektrochemiczny miedzi(nCu) należy obliczyć iloraz masy miedzi która osadziła na katodzie (mCu), od ładunku który ten efekt wywołał.
nCu = mCu/q
Wszystkie wyniki zamieszczone są w Tabeli drugiej, która znajduje się w punkcie sprawozdania dotyczącym wyników (IV).
2. Obliczanie stałej Faraday'a:
Dokonujemy tego na podstawie równania:
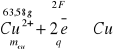
Gdzie:
F- stała Faraday'a,
63,58g - masa jednego mola miedzi.
Na podstawie tego równania otrzymujemy wzór:
![]()
3. Błędy względne i bezwzględne otrzymanych wyników obliczeń:
Błędy bezwzględne obliczamy na podstawie wzorów:
![]()
gdzie Ftablicowe wynosi 96485 [C]
![]()
gdzie nCu tablicowe wynosi 0,0003294 [g/C]
Względne zaś:
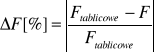
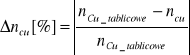
IV. Wyniki:
F [C] |
nCu [g/C] |
|
|
|
|
94012 |
0,0029452 |
2,56 |
2473 |
794,10 |
-0,0026158 |
101159 |
0,0027371 |
4,84 |
-4674 |
730,93 |
-0,0024077 |
155073 |
0,0017855 |
60,72 |
-58588 |
442,04 |
-0,0014561 |
Tabela. 2.
V. Wnioski:
Wyliczyliśmy odpowiednio stałe Faraday'a i równoważniki elektrochemiczne miedzi, jednak z bardzo dużym błędem. Jest on spowodowany głownie tym, że elektrolizer nie działał poprawnie.
Wyszukiwarka
Podobne podstrony:
2015 08 20 08 17 13 01
17 (13)
17 13
2015 08 20 08 17 13 01
SiP 17 13 [ www potrzebujegotowki pl ]
17 13
2015 08 20 08 17 13 01
17 (13)
13 ZACHOWANIA ZDROWOTNE gr wtorek 17;00
17 rzs 2012 13 net wersja pods Nieznany (2)
13 17
13 17 do wyslania
13 17
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
13 17
13 (17)
więcej podobnych podstron