FIZYKA H1 - LABOLATORIUM - dr Krystyna Żukowska |
||
Imię i Nazwisko: Krzysztof GĄSIOREK Nr albumu: 117479 |
Ćwiczenie nr 25 |
Wrocław 19 kwietnia 2002 r. |
GRUPA 2/1705 piątek/: Łukasz Szpak Krzysztof Gąsiorek |
Temat: WYZNACZANIE CIEPLA TOPNIENIA LODU |
Ocena: |
Cel ćwiczenia:
Zapoznanie ćwiczących z techniką pomiarów kalorymetrycznych oraz ocena ich dokładności.
Wiadomości wstępne:
Ciepłem topnienia danej substancji nazywamy ilość ciepła potrzebną do zamiany 1 kg tej substancji w postaci ciała stałego o temperaturze topnienia w ciecz o tej samej temperaturze.
Przy temperaturze topnienia danego ciała, ilość ciepła Q potrzebną do zmiany stanu skupienia ciała ze stałego na ciepły wyrażamy wzorem:
Q=ctm; gdzie: ct - cieplo topnienia
m - masa ciała zmieniajacego stan skupienia
Przebieg pomiarów:
Zgodny z instrukcjami.
POMIAR PIERWSZY
Zważone zostało puste naczynie kalorymetryczne:
mk=163,7 ± 0,1 [g]=0,1637 ± 0,0001 [kg]
Zważone zostało naczynie wypełnione wodą (do ok. 2/3) o temperaturze 307°K
mk+w=265,5 ± 0,1 [g]=0,2655 ± 0,0001 [kg]
mw= mk+w- mk
mw=265,5 ± 0,1 [g] - 163,7 ± 0,1 [g]=0,1018± 0,0002 [kg]
Przez 6 minut, co minutę odczytywana była temperatura stygnącej wody
Temperatura przygotowanej, stygnącej wody destylowanej. |
|
temperatura w minucie |
wartość temperatury [°K] |
1 |
306,5 |
2 |
306,3 |
3 |
306,1 |
4 |
305,9 |
5 |
305,9 |
6 |
305,8 |
Podobnie po wsypaniu do kalorymetru lodu (ok. ¼ objętości naczynia) odczytywana była temperatura stygnącej wody
Pomiar temperatury wody destylowanej po wsypaniu lodu. |
|||
mierzony w 10 sekundowych odstępach czasu (LP) |
wartość temperatury [°K] |
mierzony w 10 sekundowych odstępach czasu (LP) |
wartość temperatury [°K] |
1 |
301 |
14 |
287 |
2 |
297,4 |
15 |
286,7 |
3 |
295,7 |
16 |
286,5 |
4 |
294,1 |
17 |
286,5 |
5 |
293,5 |
18 |
286,4 |
6 |
292 |
19 |
286,3 |
7 |
290,8 |
20 |
286,2 |
8 |
290 |
21 |
286,1 |
9 |
288,7 |
22 |
286,1 |
10 |
288,1 |
23 |
286,1 |
11 |
287,5 |
24 |
286 |
12 |
287,1 |
25 |
286 |
13 |
286,7 |
26 |
286 |
Po ustabilizowaniu się temperatury wewnątrz kalorymetru mierzymy ją jeszcze w minutowych odstępach
Temperatura wewnątrz kalorymetru. |
|
minuta po wymianie ciepła miedzy wodą a lodem |
wartość temperatury [°K] |
1 |
286 |
2 |
286,1 |
3 |
286,3 |
4 |
286,4 |
5 |
286,4 |
6 |
286,5 |
Wyznaczona zostaje masa lodu po uprzednim zważeniu naczynia kalorymetrycznego wraz z zawartością.
mzważona=293,7 ± 0,1 [g] ml= mzważona- mk+w
ml=293,7g - 265,5g=0,0282 ± 0,0002 [kg]
POMIAR DRUGI
1. Zważone zostało puste naczynie kalorymetryczne:
mk=163,7 ± 0,1 [g]=0,1637 ± 0,0001 [kg]
Zważone zostało naczynie wypełnione wodą (do ok. 2/3) o temperaturze 307°K
mk+w=276,5 ± 0,1 [g]=0,2765 ± 0,0001 [kg]
mw= mk+w- mk
mw=276,5 ± 0,1 [g] - 163,7 ± 0,1 [g]=0,1128± 0,0002 [kg]
Przez 6 minut, co minutę odczytywana była temperatura stygnącej wody
Temperatura przygotowanej, stygnącej wody destylowanej. |
|
temperatura w minucie |
wartość temperatury [°K] |
1 |
306,9 |
2 |
306,7 |
3 |
306,6 |
4 |
306,5 |
5 |
306,3 |
6 |
306,2 |
Podobnie po wsypaniu do kalorymetru lodu (ok. ¼ objętości naczynia) odczytywana była temperatura stygnącej wody
Pomiar temperatury wody destylowanej po wsypaniu lodu. |
|||
mierzony w 10 sekundowych odstępach czasu (LP) |
wartość temperatury [°K] |
mierzony w 10 sekundowych odstępach czasu (LP) |
wartość temperatury [°K] |
1 |
297 |
13 |
289,6 |
2 |
296 |
14 |
289,5 |
3 |
294,6 |
15 |
289,5 |
4 |
293,5 |
16 |
289,4 |
5 |
292,7 |
17 |
289,3 |
6 |
291,8 |
18 |
289,3 |
7 |
291 |
19 |
289,4 |
8 |
290,6 |
20 |
289,3 |
9 |
290,2 |
21 |
289,4 |
10 |
290 |
22 |
289,4 |
11 |
289,9 |
23 |
289,4 |
12 |
289,8 |
24 |
289,4 |
Po ustabilizowaniu się temperatury wewnątrz kalorymetru mierzymy ją jeszcze w minutowych odstępach
Temperatura wewnątrz kalorymetru. |
|
minuta po wymianie ciepła miedzy wodą a lodem |
wartość temperatury [°K] |
1 |
289,5 |
2 |
289,5 |
3 |
289,6 |
4 |
289,8 |
5 |
289,9 |
Wyznaczona zostaje masa lodu po uprzednim zważeniu naczynia kalorymetrycznego wraz z zawartością.
mzważona=301,5 ± 0,1 [g]
ml= mzważona- mk+w
ml=301,5g - 276,5g=0,0250 ± 0,0002 [kg]
Niektóre stałe:
cw - 4185 ± 8 [J/(K*kg)] - ciepło właściwe wody
ck - 390 ± 1 [J/(K*kg)] - ciepło właściwe kalorymetru (mosiądz)
ct - 79,71 cal/g - ciepło topnienia wody
Musimy zamienić ct z jednostki cal/g na jednostkę kJ/kg, ponieważ 1J=4,1868cal, tak więc ct = 333,729 kJ/kg;
tt = 0K
Opracowanie wyników
|
mw |
ml |
tp |
tk |
cw |
ck |
mk |
mk+w |
Pomiar1 |
0,1018±0,0002kg |
0,0282±0,0002kg |
305,6250±0,1K |
285,8±0,1K |
4185±8 J/kg*K |
390±1 J/kg*K |
0,1637 ±0,0001kg |
0,2655±0,0001kg |
Pomiar2 |
0,1128±0,0002kg |
0,025±0,0002kg |
306,2±0,1K |
288,9±0,1K |
|
|
|
0,2765±0,0001kg |
Metoda liczenia błędu niepewności granicznej (maksymalnej) na przykładzie wyznaczania masy wody, punkt 2 POMIARU:
mk+w=276,5 ± 0,1 [g]=0,2765 ± 0,0001 [kg],
mk=163,7 ± 0,1 [g]=0,1637 ± 0,0001 [kg],
gdzie ±0,0001kg błąd wagi elektronicznej
mwmax= mk+wmax- mkmin ; mwmin= mk+wmin- mkmax
mwmax=(276,5 + 0,1)g - (163,7 - 0,1)g=113g
mwmin=(276,5 - 0,1)g - (163,7 + 0,1)g=112,6g
mw=(mwmax + mwmin)/2 ± Δ mw [g] ,gdzie Δ mw=± |( mwmax - mwmin)|/2 [g]
mw=112,8 ± 0,2 [g]=0,1128± 0,0002 [kg]
Wniosek przy sumowaniu wartości obarczonych błędami, by znać błąd powstałej wartości sumujemy również błędy graniczne składowych wartości.
Podobnie postępujemy w punkcie 6 POMIARU.
Z zależności możemy wyznaczyć ciepło topnienia
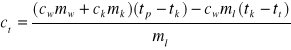
,
gdzie
ct - ciepło topnienia lodu
cw - ciepło właściwe wody
ck - ciepło właściwe naczynia kalorymetrycznego
ml - masa lodu
mw - masa wody w naczyniu kalorymetrycznym
mk - masa naczynia kalorymetrycznego wraz z mieszadłem
tp - temperatura początkowa układu
tk - temperatura końcowa układu
tt - temperatura zera bezwzględnego 273 K
Wyliczone zostało ciepło topnienia lodu (wody) dla pierwszego doświadczenia
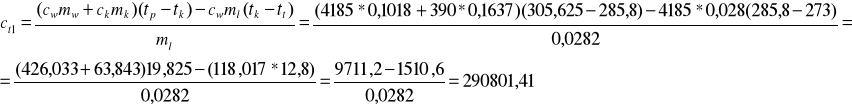
oraz doświadczenia drugiego
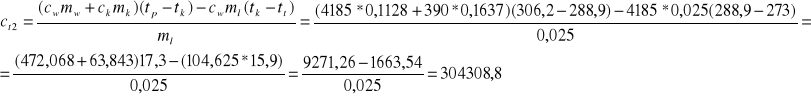
- wyprowadźmy jednostkę -
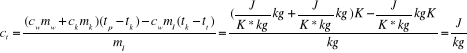
mamy więc:
ct1=290801,41 J/kg
ct2=304308,8 J/kg
Wartości te obarczone są błędem, ponieważ składowe brane do ich szacowania obarczone są błędami. Błąd ten możemy określić na podstawie analizy zależności
![]()
metodą różniczki zupełnej.
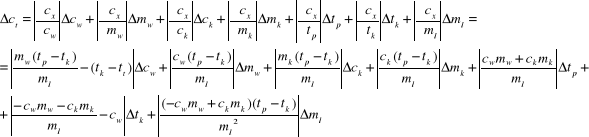
Zależność nasza będzie wyglądała następująco:

Wyznaczmy jej jednostkę, która powinna być zgodna z jednostką wartości samego ciepła topnienia:

Wartość błędu z niej wyznaczona dla pomiaru drugiego wynosi:
Posiadamy wartość ciepła topnienia oraz błędu bezwzględnego jego wyznaczania, możemy więc zapisać:
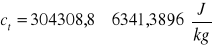
oraz policzyć wartość błędu względnego procentowego:
![]()
Przyrządy pomiarowe:
- Waga elektroniczna typu WPT2C firmy RADWAG (błąd dyskretyzacji d=0.1)
- Miernik cyfrowy TYPE-K YF-160A THERMOMETER + czujnik temperatury (termopara) -brak danych dotyczących dokładności miernika
Odczyty mas ważonych przy pomocy wagi elektronicznej są obarczone błędem 0,0001 kg.
Miernik temperatury wskazuje wartość temperatury z dokładnością 0,1K, więc przyjmujemy tą wartość jako błąd bezwzględny (minimalny).
WNIOSKI:
Ćwiczenie miało na celu zaznajomić nas z zasadami pomiarów kalorymetrycznych. Wydawałoby się, że jest to prosty pomiar doświadczalny. Jednak tak nie jest. Pragnęli byśmy, aby wymiana ciepła między lodem a wodą była idealna, czyli bez strat, tz. ciepło wymieniane w układzie woda lód nie powinno się rozpraszać, co w naszych warunkach jest niemożliwe. Najlepiej, by wymiana zaszła w nieskończenie krótkim czasie (przybliżenie części wykresu przedstawiającego wymianę ciepła pionową linią prostą), w temperaturze topnienia, w ciśnieniu normalnym, co też jest nie możliwe. Z tego względu przyjmuje się metodę wykorzystaną w ćwiczeniu, która i tak niezupełnie zachowuje zasadę bilansu cieplnego.
Mimo tego, że nie całe ciepło dostarczone zostało spożytkowane na roztopienie lodu, lecz jego część uległa rozproszeniu w otoczenie przy wrzucaniu lodu oraz naczynie kalorymetryczne, to błędy i ilość „zniweczonego” ciepła jest niewielka w porównaniu z energią oddaną na roztopienie bryłek lodu.
Największy wpływ na błąd pomiaru ma jak widać masa lodu, oraz temperatura początkowa, co jest naturalne, bo dążymy jak już wspomniałem do szybkiej wymiany w temperaturze topnienia substancji. By zniwelować te duże błędy należałoby pomiar wykonać dla małej ilości lodu (szybkość), co niepozwoliłoby na zarejestrowanie zmian temperatury na podstawie, których wyznaczamy ciepło topnienia. Nawet przy naszym niedoskonałym pomiarze już były kłopoty z rejestrowaniem temperatury ze względu na dużą szybkość jej zmian i wysoką czułość termometru.
Biorąc pod uwagę metodę i warunki, których przeprowadziliśmy pomiary, to wyniki są bardzo poprawne (zadowalające), ponieważ różnica między ciepłem wyznaczonym laboratoryjnie i umieszczanym w tablicach fizycznych (ct = 333,729 kJ/kg), a ciepłem wyznaczonym przez nas (304,308 kJ/kg), to około 30 kJ/kg co stanowi ok. 9% wartości idealnej, możemy tą różnicę potraktować jako straty energii rozpraszanej oraz błędy opóźnienia odczytu temperatury przy jej rejestrowaniu w trakcie pomiaru oraz błędy wyznaczania z załączonych wykresów temperatury początkowej i końcowej badanego układu, a błąd bezwzględny jest proporcjonalnie niewielki ok. 2%.
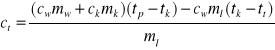
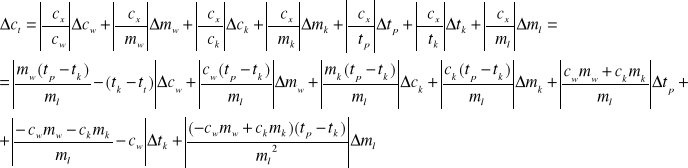
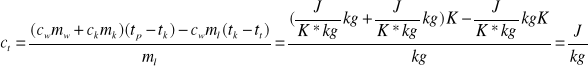


Wyszukiwarka
Podobne podstrony:
cwiczenie 43 FIZYKA H1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, f
cwiczenie 47 FIZYKA H1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, f
Cw88fiz, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
CW84FIZ, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
cw 6 W1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
cw 5 wyk2, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
Cw 4D, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizyka
laborka 3, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
cw 7 W1b, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
MOJ-LAB7, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
FIZYKA~4, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
LAB61 97, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
cw 5 wyk3, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
LAB11 ~2, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
cw 4 W1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
więcej podobnych podstron