Ćwiczenie nr 4. (2 godz.)
4. Reakcje chemiczne. Reakcje w roztworach.
Iloczyn jonowy wody, pojęcia pH i pOH.
Reakcje zobojętniania i hydrolizy.
Reakcje utleniania i redukcji.
Iloczyn jonowy wody. Pojęcia pH i pOH
Woda chemicznie czysta jest bardzo słabym elektrolitem, którego dysocjacje można zapisać w postaci równania
![]()
lub dla uproszczenia
![]()
dlatego stała dysocjacji wody ma bardzo niska wartość liczbową
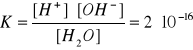
a stężenie niezdysocjowanych cząsteczek wody jest praktycznie stałe. W związku z tym iloczyn K∙[H2O] jest również stały i nosi nazwę iloczynu jonowego wody (dla ilości moli wody zawartych w 1 kg wody [H2O] = 55,5 mol)
![]()
W obliczeniach odnoszących się do temperatury pokojowej można przyjmować wartość iloczynu jonowego wody równą
![]()
W czystej wodzie stężenia jonów są równe i wynoszą
![]()
Stężenie jonów wodorowych i wodorotlenkowych charakteryzuje się za pomocą tzw. wykładników stężeń jonów wodorowych i wodorotlenowych pH i pOH
![]()
![]()
pH i pOH oznaczają odpowiednio ujemne logarytmy dziesiętne ze stężeń jonów wodorowych i wodorotlenowych. Dla czystej wody pH = 7, dla roztworów kwaśnych pH < 7, a dla zasadowych pH > 7. Pomiędzy pH i pOH, zgodnie z definicja iloczynu jonowego wody, istnieje zależność
![]()
Przykład 4.1
Obliczyć pH 0,2 molowego roztworu kwasu siarkowego zakładając, że całkowicie zdysocjował ![]()
.
![]()
Z jednego mola kwasu powstają 2 mole jonów [H+]. Zatem
![]()
Reakcje zobojętniania i hydrolizy
Według Arrheniusa rekcja zobojętniania, to taka reakcja, w trakcie której jony H+ kwasu reagują z jonami OH- zasady, tworząc wodę, a reagenty tracą swoje właściwości kwasowe i zasadowe. Uściślając, zobojętnienie należy określić jako reakcję kwasów i zasad o podobnej mocy.
Hydrolizą nazywamy proces rozkładu jakiejś substancji następujący pod wpływem wody. Hydrolizie ulegają z reguły sole słabych kwasów i mocnych zasad, sole mocnych kwasów i słabych zasad oraz sole słabych kwasów i słabych zasad. Proces ten powoduje, że roztwór przybiera odczyn kwaśny lub zasadowy, zależnie od tego, z którym z wymienionych rodzajów soli mamy do czynienia.
sól mocnej zasady i słabego kwasu, np. CH3COONa wykazuje odczyn zasadowy
![]()
gdzie: Kw - iloczyn jonowy wody
![]()
- stała dysocjacji słabego kwasu
c - stężenie rozpuszczonej soli
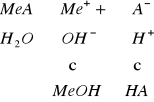
sól słabej zasady i mocnego kwasu, np. NH4Cl, ZnCl2, Fe2(SO4)3, wykazuje odczyn kwaśny
![]()
gdzie: ![]()
- stała dysocjacji słabej zasady
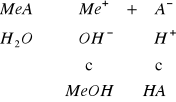
sól słabej zasady i słabego kwasu, np. CH3COONH4, (NH4)2CO3, może wykazywać odczyn obojętny
(w roztworach niezbyt rozcieńczonych c >>![]()
i c >>![]()
)
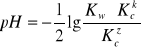
jeśli ![]()
, to
![]()
,
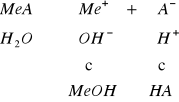
sól mocnej zasady i mocnego kwasu, np. NaCl, K2SO4, nie ulega hydrolizie; związek jest całkowicie zdysocjowany na jony i ma odczyn obojętny.
Przykład 4.2
Jaką wartość pH ma 0,01 M roztwór węglanu sodu (![]()
= 4,4∙10-11 mol/dm3)?
![]()
- odczyn zasadowy
Reakcje utleniania i redukcji
Reakcjami utlenienia i redukcji nazywamy reakcje chemiczne przebiegające ze zmianą stopnia utlenienia reagujących atomów lub jonów. Przyczyną tej zmiany jest wymiana pewnej liczby elektronów pomiędzy atomami i jonami. W procesie utlenienia elektronów ubywa, natomiast w procesie redukcji zwiększa się ich ilość. Substancje, które przyłączają elektrony nazywamy utleniaczami, a oddające - reduktorami. W czasie przebiegu reakcji utleniacz ulega redukcji, a reduktor utlenia się. Każdemu procesowi utlenienia towarzyszy zawsze proces redukcji. W dowolnej reakcji redox liczba elektronów przyłączonych i oddanych powinna być równa sobie.
W reakcjach, w których występują związki kowalencyjne posługujemy się pojęciem stopnia utlenienia. Jeśli pierwiastek występuje w postaci atomów swobodnych (helowce, pary metali) o wiązaniu kowalencyjnym ( np. F2, CO2 ) i wiązaniem metalicznym ( np. stały potas), to stopień utlenienia pierwiastka równa się zero. Jeśli atomy pierwiastka związane są z atomami innego pierwiastka tworząc cząsteczki lub jony wtedy stopień utlenienia może być określany jako ładunek, którym byłby obdarzony jeden atom danego pierwiastka w cząsteczce lub jonie, gdyby elektrony zostały przydzielone poszczególnym atomom.
Oznaczanie stopnia utlenienia opiera się na zasadach - stopień utlenienia pierwiastka:
w stanie wolnym równy jest zero,
w postaci prostego jonu ( w roztworze, fazie stałej, ciekłej i gazowej ) równa się jego elektrowartościowości,
tlen w związkach ma ładunek -2, wyjątki: OF2 +2, nadtlenki -1,
fluor we wszystkich związkach ma ładunek -1,
wodór w cząsteczkach i jonach złożonych ma ładunek +1, wyjątki: wodorki metali -1,
suma ładunków dodatnich i ujemnych w cząsteczce równa się zero,
całkowity stopień utlenienia - ilość atomów pomnożone przez ładunek pojedynczy,
Posługując się pojęciem stopnia utleniania można podać definicje procesów:
utlenianie, proces w wyniku którego stopień utleniania wzrasta, a redukcja - stopień utleniania maleje. Wobec tego utleniaczem nazywamy substancję, której stopień utlenienia w wyniku reakcji maleje, a reduktorem jest substancja, której stopień utleniania w wyniku reakcji wzrasta.
W celu zbilansowania równania złożonej reakcji redox wygodnie jest posługiwać się reakcjami połówkowymi tzw. cząstkowymi. Jedno przedstawia równanie utlenienia, a drugie redukcji.
Przykład 4.3
Rozwiązać równanie redox, napisać równania połówkowe, wskazać utleniacz i reduktor.
Zn + HCl → ZnCl2 + H2
1. ustalamy stopnie utlenienia poszczególnych pierwiastków w reakcji:
Zn0 + H+1 Cl-1 → Zn+2 Cl2-1 + H20
2. piszemy równania połówkowe wraz z ilością elektronów:
( R ) Zn0 ![]()
Zn+2 utlenienie
( U ) 2 H+1 ![]()
H20 redukcja
3. sprawdzamy, czy zgadza się nam bilans elektronowy równań, jeśli nie to doprowadzamy do wspólnego mianownika i przepisujemy stronami:
Zn0 ![]()
Zn+2
2 H+1 ![]()
H20
Zn0 + 2 H+1 → Zn+2 + H20
4. bilansujemy równanie główne wstawiając współczynniki:
Zn + 2 HCl → ZnCl2 + H2
Przykład 4.4
Rozwiązać równanie redox, napisać równania połówkowe, wskazać utleniacz i reduktor.
FeSO4 + HIO3 + H2SO4 → I2 + Fe2(SO4)3 + H2O
1. Fe2+ SO4-2 + H+1 I+5 O3-2 + H+12SO4 → I20 + Fe+32(SO4)-23 + H2O
2. ( R ) Fe+2 ![]()
Fe+3 utlenienie
( U ) 12 H+1 + 2 I+5O-13 ![]()
I20 + 6 H2O redukcja
3. Fe+2 ![]()
Fe+3 │× 10
12 H+1 + 2 I+5O-13 ![]()
I20 + 6 H2O │× 1
10 Fe+2 + 12 H+1 + 2 I+5O-13 → Fe+3 + I20 + 6 H2O
4. 10 FeSO4 + 2 HIO3 + 5 H2SO4 → I2 + 5 Fe2(SO4)3 + 6 H2O
Zadania do samodzielnego rozwiązania:
Obliczyć pH 0,1 molowego roztworu wodorotlenku amonowego, którego stała dysocjacji K = 1,8∙10-5.
Obliczyć pH roztworu, zawierającego w objętości 250 cm3 2,45 g czystego kwasu siarkowego. Założyć, że kwas jest całkowicie zdysocjowany.
Jakie jest stężenie molowe jonów OH- w 6,05% roztworze amoniaku o gęstości 0,98 g/cm3. Stała dysocjacji amoniaku wynosi 1,8·10-5.
Do 1 dm3wody wrzucono 0,46 g Na, które całkowicie przereagowało według równania:
![]()
Obliczyć pH powstałego roztworu wodorotlenku sodowego. Przyjąć, że objętość roztworu wynosi 1 dm3 (pominąć zmianę objętości układu podczas reakcji) oraz, że NaOH jest całkowicie zdysocjowany.
Roztwór kwasu jednoprotonowego (o ogólnym wzorze HR) o stężeniu 0,08 mol/dm3 ma pH = 2,4. Ile wynosi stała dysocjacji?
Jaką wartość pH ma 0,02 M roztwór chlorku amonu NH4Cl (
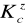
= 1,8∙10-5 mol/dm3)?Jaką wartość pH ma 0,05 M roztwór azotanu (III) amonu NH4NO2 (
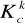
= 4,5∙10-4 mol/dm3,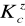
= 1,8∙10-5 mol/dm3)?Napisz reakcje sumaryczną dla poniższych reakcji „zobojętniania”
słaby kwas HNO2 reaguje z mocna zasadą KOH,
mocny kwas HClO4 reaguje z mocną zasadą Ba(OH)2,
słaby kwas HNO2 reaguje ze słabą zasadą NH3,
mocny kwas HClO4 reaguje ze słabą zasadą NH3.
W następujących reakcjach obliczyć stopnie utlenienia pierwiastków we wszystkich związkach, oraz wskazać reduktor (donor elektronów) i utleniacz (akceptor elektronów):
a) ![]()
,
b) ![]()
,
c) ![]()
.
Uzupełnić o współczynniki stechiometryczne następujące równania reakcji:
a) ![]()
b) ![]()
c) ![]()
d) ![]()
e) ![]()
f) ![]()
g) ![]()
h) ![]()
6
6
silnie
zdysocjowana
słabo
zdysocjowany
silnie
zdysocjowany
słabo
zdysocjowana
słabo
zdysocjowana
słabo
zdysocjowany
Wyszukiwarka
Podobne podstrony:
cw 1,2,3, Ćwiczenie nr 1
cw 1 Ćwiczenie nr 1 gosp
CW NR2b, ĆWICZENIE Nr 2
InstrukcjeĆw.2009 2010, Cw.1.E-01. Badanie właściwości elektrycznych kondensatora płaskiego, Laborat
CW NR1b, ĆWICZENIE Nr 1
ćwiczenia nr 8 Rozwój umysłowej reprezentacji świata, Jagodzińska, Rozwojówka ćw
ćwiczenia nr 6, Appelt, rozw cw 6
Zestaw ćw gimnst nr 7, zestawy ćwiczeń gimnastycznych
ćwiczenia nr 10, 10. rozwojowka, Oles, cw. 10
Zestaw ćw gimnast. nr 2, zestawy ćwicze gimnastycznych, zestawy ćwiczeń gimnastycznych
ćwiczenia nr 10, 10. Rozwoj cw.10
ćwiczenia nr 3, cw. 3 - poznanie społeczne I - reprezentacja wiedzy społecznej - wojciszke r. 2
InstrukcjeĆw.2009 2010, Cw.3.M-01,M-02.Równia pochyła.Wahadło, Laboratorium Fizyki; ćwiczenie Nr 1
ćwiczenia nr 13, Rozwoj cw 13 - Kepinski
ćwiczenia nr 7, Rozwoj po adolescencji; cw. 7, Olejnik M.
CW NR2a, ĆWICZENIE NR 3
ćwiczenia nr 2, ćw. 2 Trempała
Zestaw ćw gimnast. nr 5, zestawy ćwicze gimnastycznych, zestawy ćwiczeń gimnastycznych
więcej podobnych podstron