Nr .grupy Nr zespołu |
Nr ćwiczenia 8 |
Data wykonania ćwiczenia:
|
|
KRIOSKOPIA |
Ocena: |
1. Wstęp teoretyczny
Właściwości koligatywne wynikają z zmniejszenia potencjału chemicznego ciekłego rozpuszczalnika, spowodowane obecnością substancji rozpuszczonej. Zmiana potencjału chemicznego zależy jedynie od liczebności danego składnika roztworu.
Założenia dotyczące substancji rozpuszczanej;
Jest nielotna,
Jej prężność pary jest zaniedbywana,
Nie rozpuszcza się z stałym rozpuszczalniku,
Jedną z właściwości koligatywnych jest obniżenie temperatury krzepnięcia. Równowaga heterogeniczna podczas krzepnięcia dotyczy rozpuszczalnika w roztworze i w czystym stałym rozpuszczalniku.
2. Cel ćwiczenia
Celem ćwiczenia było zaobserwowanie zjawiska obniżenia temperatury krzepnięcia roztworu w stosunku do temperatury krzepnięcia czystego rozpuszczalnika, a także zależności tej różnicy temperatur od stężenia molarnego roztworu.
3. Zadane parametry
roztwór wzorcowy: NaCl w wodzie, mwzorca = 0,4 m/kg
roztwór I: Na2SO4*10 H2O, mI![]()
0,311 mol/kg
roztwór II: Na2SO4*10 H2O mII ![]()
0,158 mol/kg
4. Sposób wykonania ćwiczenia
PRZYGOTOWANIE ROZTWORU:
ważymy około 1,5 g Na2SO4* 10 H2O:
odmierzamy 15 cm3 wody
ważymy na wadze analitycznej kolbkę wraz z korkiem
dodajemy odpowiednią ilość soli
ważymy kolbkę z solą
wyliczamy ilość dodanej soli
dodajemy odmierzoną ilość wody przy użyciu pipety
ważymy kolbkę z roztworem
obliczamy rzeczywiste stężenie roztworu
PRZYGOTOWANIE POMIARU:
* naczyńka pomiarowe napełnione wodą nakładamy na głowicę pomiarową
* wkładamy głowicę do lewego otworu krioskopu
* przełączamy na stopień tłumienia 64
* próbka chłodzi się i pisak przesuwa się w prawo
* gdy próbka odpowiednio się ochłodzi, na moment włączamy wibrator
* pisak przeskakuje w lewo, co wskazuje na zamarznięcie próbki
* stopniowo przełączamy stopień tłumienia, tak, by pisak maksymalnie wychylił się w prawo na arkuszu papieru
* ustawiamy pisak na linii zerowej przy pomocy potencjometru
* przełączamy stopień tłumienia na 64
* wyciągamy próbkę, rozmrażamy ją całkowicie trzymając w palcach
* po rozmrożeniu zdejmujemy naczyńko pomiarowe, termistor osuszamy
POMIAR:
naczyńko pomiarowe napełnione roztworem wzorcowym (0,4 molarnym roztworem NaCl) nakładamy na termistor
wkładamy głowicę pomiarowa do lewej komory krioskopu i gdy próbka ulegnie odpowiedniemu przechłodzeniu włączamy wibrator
pisak przeskakuje w lewo, przełączamy wtedy stopień tłumienia na 32, 16, 8 itd., tak, by pisak nie wypadł poza skalę
na wykresie zapisujemy stopień tłumienia
przełączamy stopień tłumienia na 64 i rozmrażamy próbkę w palcach
zaznaczamy punkt, na jaki skoczył pisak po włączeniu wibratora i mierzymy jego odległość od linii zerowej
dodajemy tę odległość do podanego nam wcześniej stopnia przechłodzenia
powtarzamy pomiar dwukrotnie, włączając wibrator we właściwym punkcie przechłodzenia
w ten sam sposób wykonujemy pomiar dla przygotowanego roztworu soli
przygotowujemy roztwór soli korzystając z poprzednio przygotowanego:
ważymy kolbkę wraz z korkiem
dodajemy 1 cm3 roztworu i ważymy
dodajemy 1 cm3 wody i ważymy
obliczamy stężenie molarne nowego roztworu
wykonujemy pomiar obniżenia temperatury krzepnięcia dla nowego roztworu
5. WYNIKI POMIARÓW.
Roztwór I
|
Masa kolbki z korkiem [g] |
Masa kolbki z solą [g] |
Masa soli [g] Na2SO4*10 H2O |
Ilość moli soli [g] Na2SO4*10 H2O |
Masa wody krystalizacyjnej [g] |
Masa kolbki po dodaniu wody [g] |
Masa wody z wodą krystalizacyjną [g] |
Molarność roztworu z ważenia |
1 |
51,091 |
52,879 |
1,533 |
4,761*10-3 |
0,857 |
67,332 |
15,310 |
0,311mol/kg |
Roztwór II
|
Masa kolbki z korkiem [g] |
Masa kolbki z roztworem I [g] |
Masa roztworu I [g]
|
Ilość moli soli [g]
|
Masa wody z roztworu I [g] |
Masa kolbki po dodaniu wody [g] |
Masa wody [g] |
Molarność roztworu z ważenia |
2 |
68,599 |
69,628 |
1,029 |
0,315*10-3 |
0,984 |
70,634 |
1,992 |
0,158mol/kg |
nr |
Stopień tłumienia |
Wychylenie pisaka |
Iloczyn wychylenia pisaka*stopień tłumienia( ΔT) |
Molarność wyliczona z krioskopii |
Współczynnik izotoniczny |
Wzorzec |
8 |
83 mm |
664 |
- |
- |
Roztwór I |
32 |
20,5mm |
656 |
0,395mol/kg |
1,270 |
Roztwór II |
8 |
51mm |
408 |
0,246mol/kg |
1,557 |
![]()
;
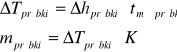
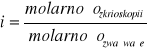
6. Wnioski.
Temperatura krzepnięcia roztworu jest niższa niż czystego rozpuszczalnika, różnica tych temperatur zależy od stężenia molarnego roztworu - im stężenie wyższe, tym większa różnica. Ponadto roztwór Na2SO4 jest mocnym elektrolitem, co dodatkowo wpływa na jeszcze większe obniżenie temperatury krzepnięcia.
Za pomocą krioskopu można tym dokładniej wyznaczać odchylenia temperatur krzepnięcia, im bardziej rozcieńczony jest roztwór - czułość pomiaru jest odwrotnie proporcjonalna do stężenia molarnego roztworu.
1
Wyszukiwarka
Podobne podstrony:
test poprawkowy grupa 1
19 183 Samobójstwo Grupa EE1 Pedagogikaid 18250 ppt
Grupa 171, Podstawy zarządzania
Grupa XVI
hatala,januszyk grupa 2a prez 1
pilot a grupa
Wykład 6 Rodzina jako grupa społeczna
Projekt grupa 3 2
Grupa rówieśnicza jako środowisko wychowawcze ptt(1)
Grupa przestrzenna id 196528 Nieznany
GRUPA 01 ZADANIA
Paszkowska Rogacz, Tarkowska Metody parcy z grupą w poradnictwie zawodowym NOTATKI
Ciekawa Chemia Sprawdzian 10 Grupa B
Ciekawa Chemia Sprawdzian 8 Grupa A
Grupa B, Studia dziennikarstwo i komunikacja społeczna, Ekonomika mediów - pytania i notatki
GRUPA I7X6S1, WAT, semestr III, Podstawy miernictwa
pytania grupa 8, kardiologia
Kationy I i II grupa, 5. - Pomoce Naukowe (PDFy , Doc itp)
Ekonomika-grupa-H-ściąga, Studia, Geologia i ekonomika złóż
więcej podobnych podstron