WODA JAKO CHEMICZNY ELEMENT ŚRODOWISKA:
75 % planety jest pokryte wodą
Życie wyszło z wody to ona rozpoczęła ewolucję
W organizmie człowieka woda (osocze) to praocean
Jest niezbędnym składnikiem w funkcjonowaniu gospodarki i w życiu każdego organizmu
Tzw. Biały węgiel -> energia pobierana z wody
65% organizmu ludzkiego to woda ( ubytek 10% prowadzi do poważnych zaburzeń)
REKORDY:
20% masy wody w organizmie- pewny zgon
Bez jedzenia można wytrzymać 7 dni, zagrożenie dla życia -30 dni /rekord 72 dni
Bez wody 7 dni /rekord 14
CECHY FIZYCZNE WODY
- wzorzec masy 1g = 1 cm3 wody w temperaturze 4oC
- w skali Celsjusza 0oC -> zamarzanie
100oC -> wrzenie
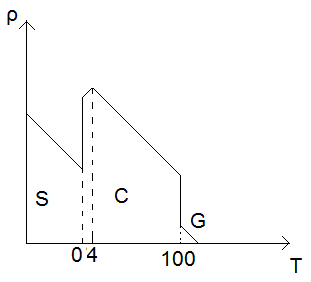
- ze wzrostem temperatury spada gęstość wszystkich substancji, bo objętość rośnie. Wszystkie substancje mają też charakterystyczne punkty nieciągłości, czyli punkty przejścia z jednej do drugiej fazy (np. ze stanu ciekłego w stały)
Dla wody jest inaczej… Jej gęstość spada, gdy temperatura spada. Dzięki temu mamy do czynienia z pokrywą lodową zimą - występuje od powierzchni (woda nie zamarza od dna) Lód nie typowo, jako ciało stałe, ma niższą gęstość niż ciecz.
WODA:
najlepszy rozpuszczalnik
pozostaje kwestia skali rozpuszczalności, bo w wodzie rozpuszcza się wszystko tylko w różnym stopniu. ( są trudności w zbadaniu rozpuszczalności platyny i irydu ze względu na niedokładność mierników ); rozpuszczalności szkła nie mierzymy bo jest to materiał do przechowywania płynów. Ścieków nie przechowujemy w szkle, bo na dnie znajdują się metale ciężkie
woda czysta to słaby przewodnik prądu
idealnie czysta woda to świetny izolator
Przewodnictwo cieplne: dla metali wręcz izolator, dla izolatorów dobry przewodnik.
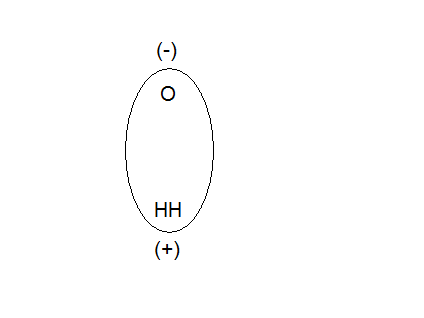
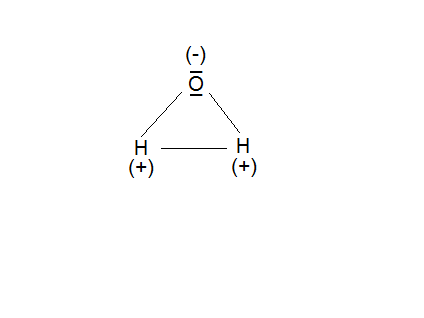
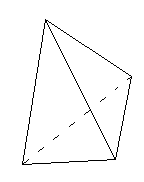
Cząsteczka wody to tetraedr (czworościan foremny).
Reakcję uwadniania nazywamy hydratacją; np.: CaO+ H2O= Ca(OH)2.
Reakcję podwójnej wymiany nazywamy hydrolizą; np.: PCl3+ 3H2O= 3HCl+ H3PO4.
Wody naturalna to woda, która bierze udział w kołowym obiegu w przyrodzie. Wody związane chemicznie to np.: gips (CaSO4•2H2O).
PODZIAŁ WÓD NATURALNYCH:
OPADOWE |
POWIERZCHNIOWE |
PODZIEMNE |
|
|
|
Zanieczyszczenia - składniki znajdujące się w wodzie poprzez działalnoś ć człowieka
Domieszki - składniki znajdujące się w wodzie poprzez warunki naturalne
Wody niezanieczyszczone - czysta woda bez domieszek i zanieczyszczeń
Jak mało Cl- to małe prawdopodobieństwo, że woda zanieczyszczona.
So42- + Cl- to wody na 97% niezanieczyszczone.
Ph w okolicach 0 to wody niezanieczyszczone
Ph większe od zera to im większe tym większe prawdopodobieństwo, że wody są zanieczyszczone.
Ścieki to wszelkie płynne produkty nieprzydatne w czasie i miejscu gdzie powstały. Ścieki dzielimy na:
Bytowe- zużyte przez człowieka wody potrzebne dla zaspokojenia potrzeb bytowych;
Przemysłowe- wynik funkcjonowania przemysłu;
Komunalne- mieszanina bytowych i przemysłowych;
Opadowe- wody powierzchniowe ujmowane do sieci kanalizacyjnych.
TLEN W WODZIE:
Rozpuszczalność gazów w wodzie spada wraz ze wzrostem temperatury (wyższa temperatura oznacza mniej tlenu w wodzie). Ściekami więc nazywamy także ciecze niosące ze sobą ładunek cieplny (zaburzają one równowagę biologiczną).
Ścieki bytowe zawierają ogromne ilości związków organicznych, taka ilość wpływa na środowisko (doprowadza do deficytu tlenu). Umownie możemy przyjąć poniższe reakcje zużycia tlenu podczas rozkładu:
Corg= CO2; Corg= CO32-; Corg= HCO32-;
Tlen trafia do wody dwutorowo:
dyfuzja z powietrza
rośliny zielone w wodzie
Stężenie tlenu:
10 mg O2/dm3 to maksymalne stężenie
6 mg O2/dm3 oznacza śnięcie narybku ryb łososiowatych
4 mg O2/dm3 bez ingerencji z zewnątrz woda przekształca się w ściek (wartość krytyczna)
W warunkach beztlenowych powstają związki toksyczne, oznacza to całkowitą zagładę życia.
Wskaźniki jakości wody:
Biologiczne: zawartość bakterii w wodzie. Przy badaniu biologicznym wykorzystuje się bakterie grupy Coli, a konkretnie najbardziej prawdopodobną liczbę bakterii w 100cm3 wody. Podstawowe oznaczenia:
Liczba bakterii wyhodowanych z 1cm3 wody na obszarze odżywczym w temperaturze 20 ៓C w ciągu 72 godzin
Liczba bakterii wyhodowanych z 1cm3 wody na obszarze odżywczym w temperaturze 37 ៓C w 24 godziny
Miano Coli- ilość cm3 wody przypadająca na 1 bakterię; E. Coli- NPL/100cm3 (Najbardziej Prawdopodobna Liczba)
Fizyczne:
Temperatura
Mętność: jednostką jest mg SiO2/dm3- czynnikiem mętnienia wody może być cokolwiek innego, co daje taki sam efekt co dana objętość krzemionki.
Przezroczystość: bada się np.: poprzez układanie pręta z białym krążkiem o średnicy 25cm w badaną wodę i ustalenie, na jakiej głębokości staje się on niewidoczny.
Barwa: nadają ją wodzie związki humusowe lub rozpuszczone związki mineralne; istnieje barwa pozorna (wystarczy filtracja zawiesiny) oraz rzeczywista (nieusuwalna fizycznie). Umowną jednostką barwy jest mg Pt/dm3.
Zapach: określony w warunkach (z-zimne, g-gorące), przydzielając do jednej z grup zapachowych (R- roślinne, G- gnilne, S- specyficzne pochodzenia nienaturalnego) i określa jego intensywność (5-cio stopniowa skala).
Smak: ze względu na niebezpieczeństwo z tym związane sprawdza się rzadko; wyróżniamy słony, kwaśny, alkaliczny i gorzki.
Przewodnictwo elektryczne: czym większa przewodność wody tym wyższe zasolenie.
Chemiczne:
Nieorganiczne (wykazują prawdopodobne zanieczyszczenie, twardosc wody, zasadowosc wody)
PH, Cl-, SO42- oddziaływanie korozyjne wody
PH>7 - kwas, który będzie atakował konstrukcje metalowe, betonowe itp.
Cl- - korozja stali
SO42 - korozja
Organiczne (oddziałują trochę toksycznie - ropopochodne, ich nadmiar jest szkodliwy, bo mogą rozwijac się bakterie)
Biogenne: dosłownie `rodzące życie'- (N, P)
Normą pH jest zakres 6,7-7,5. Latem zwiększone zużycie CO2 oznacza większą liczbę roślinności w zbiornikach wodnych, a także większe uwalnianie z powodu wzrostu temperatury; może to doprowadzić do znacznego wzrostu pH, co wcale nie musi świadczyć o zanieczyszczeniu.
WSKAŹNIKI JAKOŚCI WODY OGÓLNIE:
Siarczany i chlorki (Podwyższona zawartość daje prawdopodobieństwa zanieczyszczenia ściekami)
Odczyn PH (mówi o agresywności wody)
Poziom tlenu
Im większe stężenie tlenu tym woda jest czystsza. Teoretycznie stężenie tlenu wynosi 10mgO2/dm3 (dla wody bardzo czystej)
Stężenie tlenu:
10 mg O2/dm3 to maksymalne stężenie
6 mg O2/dm3 oznacza śnięcie narybku ryb łososiowatych
4 mg O2/dm3 bez ingerencji z zewnątrz woda przekształca się w ściek (wartość krytyczna)
Związek tlenu i związków organicznych: Bakterie odżywiają się węglem ze związków organicznych, powodują ich rozkład przez enzymy, które wydzielają otoczkę bakterii. Bakterie potrzebują tlen do przerobienia związków organicznych. Dostarczania tlenu z atmosfery jest powolne. Gdy tlenu zabraknie giną bakterie tlenowe. Są jeszcze bakterie beztlenowe, które powodują korozję betonu.
Potencjał redoks En - mówi o zdolności utleniającej danego ośrodka
Twardość wody
Przez wiele lat miernikiem twardości wody była zdolność do zmydlania wody (było to bardzo niewygodne)
Obecnośc wapnia i magnezu jest przyczyną twardości, bądź miękkości wody.
Definicja wg inżynierii sanitarnej: metale ciężkie- metale szkodliwe (o masie atomowej > 56) oddziałujące na organizmy żywe. Od lat 70 XXw twardość określamy na podstawie zawartości wapnia i magnezu:
Twogólna= TwCa+ TwMg
Tw węglanowa wynika z obecności HCO3- oraz CO32-.
Tw niewęglanowa wynika z obecności SO42-, Cl- oraz NO3-.
Twardość węglanowa i niewęglanowa to związki Ca i Mg z wymienionymi substancjami.
Jednostki twardości:
Stopień niemiecki- 1 ៓n= 10 mg CaO/dm3
Miligramorównoważnik- 1 mval/dm3= 2,8 ៓n
Obecnie jednostką w większości krajów jest miligram - mg CaCo3/dm3.
Twardość wód naturalnych waha się od 50 do 100mg CaCo3/dm3.
Twarda woda oznacza większe zużycie mydła, proszków do prania, szybsze zyżycie tkanin, spada wartość odżywcza mięsa gotowanego w twardej wodzie, tworzenie się tzw. kamienia. Węglan wapnia jest głównym przedstawicielem kamienia kotłowego. Aby zmniejszyć twardość należy usunąć CO2, np.:
CO2+ Ca(OH)2= CaCO3+ H2O
Nie można go usunąć całkowicie, musi pozostać stan równowagi, tzw.: dwutlenek węgla równowagi; nadmiar nazywa się dwutlenkiem węgla agresywnym.
Zasadowość (zdolność wody do neutralizacji kwasów)
MIERNIKI ZAWARTOŚCI ZWIĄZKÓW ORGANICZNYCH:
BzT5: 5-dobowe biochemiczne zapotrzebowanie tlenu, jednostka: mg O2/dm3.
Obecnie technika pozwala zbadać BzT w ciągu 2-3h. Można również badać ilość związków chemicznych (ilość tlenu zużytego na natlenienie związków organicznych) KMnO4, K2Cr2O7. Często występuje zawyżenie wyniku, bo utleniają one nie tylko związki organiczne ale i chemiczne.
ChzT: chemiczne zapotrzebowanie tlenu - mg O2/dm3 (oznacza ze mamy wodę o takiej zawartości chemicznej w 1dm3, która zużywa x mg substancji)
Prawie zawsze ChzT>BzT5.
OWO: ogólny węgiel organiczny- polega na katalitycznym spaleniu związków organicznych, policzeniu pozostałego węgla i przeliczeniu go na związki organiczne [mg C/dm3].
EE: ekstrakt eterowy- nie rozpuszcza się w wodzie, natomiast wiele związków w nim się rozpuszcza (większość związków ropopochodnych z wody).
RÓWNOWAGA WĘGLANOWO WAPNIOWA WODY:
….czyli kiedy woda jest agresywna, a kiedy mogą się z niej wytrącać węglany
Tematyka równowagi węglanowo - wapniowej jest zapomnianym elementem technologii uzdatniania wody zarówno podziemnej jak i powierzchniowej.
Tymczasem niestabilna woda może być albo agresywna, mając własności korozyjne, sprzyjając niszczeniu urządzeń technologicznych (zwłaszcza filtrów studziennych, rurociągów tłoczących wodę surową, urządzeń napowietrzających, filtrów - albo z drugiej strony mogą się z niej intensywnie wytrącać węglany wapnia czy magnezu i to nie tylko po przegotowaniu, czy podgrzaniu (popularny "kamień"), co również jest przyczyną poważnych komplikacji technologicznych - zwłaszcza przy filtracji.
CaCO3 + CO2 Ca(HCO3)2 [wodorowęglan wapnia]
- przy wzroście CO2 rozpuszcza się więcej CaCO3
- przy ogrzewaniu CO2 uwalnia się do atmosfery, powstaje osad CaCO3 i kamień (tylko gdy T>57o)
MAGNEZ I WAPŃ:
Mg - metal dość twardy, niekowalny, najlżejszy z użytkowych metali, otrzymujemy go z elektrolizy: MgCl2 Mg + Cl2.
Ca - jeden z najbardziej rozpowszechnionych pierwiastków na ziemi, występuje w e wszystkich skałach osadowych, metal srebrzysto-biały
Węglan wapniowy: praktycznie nie rozpuszczalny w wodzie, rozpuszczalność zaledwie 14 mg/dm3, rozpuszczalność jednak wzrasta w wodach ze zwiększoną obecnością CO2. Następuje wtedy przemiana na Ca(HCO3)2 bardzo dobre rozpuszczalny w wodzie.
Wapno - materiał stosowany w budownictwie.
CaCO3 CaO + CO2 - Q (reakcja endotermiczna pod wpływem 100-1000oC)
Reakcja realizowana w piecach „wapiennikach”, wypala się wapień i powstaje wapno palone. Gdy zostawi się je na powietrzu do wapna palonego zacznie się przyłączac CO2 i powoli będzie przebiegała reakcja odwrotna.
Przy reakcji wapna palonego zachodzi bardzo szybko reakcja
CaO + H2O Ca(OH)2 + Q
Ca(OH)2 + CO2 CaCO3 + H2O
W wyniku tych procesów powstaje spoiwo.
SPOIWA:
Spoiwa budowlane - materiały otrzymywane z surowców mineralnych na drodze wypału i rozdrobnienia, które po zmieszaniu z wodą tworzą plastyczne masy, które po dalszych procesach tracą właściwości plastyczne, wiążą i twardnieją.
Fazy wiązania spoiw:
I faza - hydroliza i hydratacja (składniki spoiwa częściowo rozpuszczają się w wodzie)
II faza - wydzielanie się substancji koloidalnych (masa zaczyna tracic własności plastyczne)
III faza - przejście ze stanu koloidalnego w postac krystaliczną
Rodzaje spoiw:
Powietrzne - tylko wiążą w powietrzu
Hydrauliczne - wiążą na powietrzu i pod wodą
Służą do wyrobów budowlanych i cementu.
SPOIWA POWIETRZNE:
Zaprawa murarska - mieszanina wapna, piasku i wody
Proces wypalania wapienia:
CaCO3 CaO (wapno palone) + CO2
CaO + H2O Ca(OH)2 + Q (silny efekt cieplny, woda się zagotuje, ryzyka dla robotników)
Ca(OH)2 + CO2 CaCO3 (węglan wapniowy) + H2O
Zatem wapno palone „gasi się” wodą. Wapno to dodajemy z piaskiem i wodą dla uplastycznienia. Wiązanie przyspiesza się zwiększając stężenie CO2 w powietrzu, ale wpływa to na zmniejszenie wytrzymałości.
Występują także reakcje, które zachodzą powoli ( po miesiącach i latach) wiązania pucalonowe (krzemianowe) np. SiO2 (piasek) + CaO CaO * SiO2. Dzięki tym wiązaniom konstrukcje mają dodatkowe umocnienie.
„Wapno hydrauliczne”: spoiwo budowlane wiążące na powierzchni i pod wodą, podstawowym składnikiem jest wapno gaszone, ale do jego gaszenia stosuje się wapno margliste + od 6% do10% materiałów ilastych.
Spoiwo gipsowe
CaSO4 - anhydryt (forma bez wodna)
CaSO4 + ½ H2O - gips półwodny
CaSO4 + 2H2O - gips dwuwodny
Wiązanie gipsu następuje bardzo szybko. Już po godzinie otrzymujemy maksymalną wytrzymałoś w stanie wilgotnym.
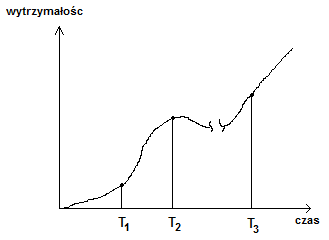
T1 - po tym czasie powstają zarodniki siarczanu wapnia dwuwodnego, kryształy zaczynają rosnac i stykac się między sobą
T2 - wartość maxymalna - krysztaly tworzą pewną strukturę całościową
T3 - następuje dalszy rozrost kryształów przy dużej obecności wody
Po czasie T3 następuje odparowanie wody (suszenie), jest to wzrost wytrzymałości, ale to etap odwracalny
Gdy zwiększymy wilgotnośc zaledwie o 1-3% następuje spadek wytrzymałości. Przy dalszej wilgotności rzędu 20-30% spadek wytrzymałości nie występuje, lecz związek (słabo rozpuszczalny w wodzie) przy dużej wilgotności może zostać wypłukany.
Współczynnik rozmiękczenia:
W = Wytrzymałość w stanie nasycenia wody (Rnas) / Wytrzymałość w stanie suchym (Rsuch)
Dla gipsu W= 0,3-0,4.
Metody przeciwdziałania:
powlekanie powierzchni gipsowych powierzchniami malarskimi (uniemożliwa wnikanie wody)
żywice syntetyczne powodują, że gips staje się substancją mniej nasiąkliwą
płyty gipsowe (wodoodporne)
SPOIWA HYDRAULICZNE:
Cement - duża grupa różnych substancji; posiadają zdolność do twardnienia po rozrobieniu z wodą i posiadają odporność na działanie wody i atmosfery
Cement powstaje z glino-krzemianu
Warunek by otrzymać cement: Stosunek tlenków zasadowych [CaO] do sumy tlenków kwasowych [SiO2]+[Al2O3]+[Fe2O3] może wahac się w granicach 2-3.
Cement podajemy prażeniu w temperaturach od 1400 do 1600oC w piecach cementowych
Przy produkcji trzeba uważac na MgO i SO3!!! Ich zawartość nie może przekraczac podanej ilości procent:
[MgO]< 5%, [SO3]< 3%, ponieważ, zbyt duża ilość siarczanów i magnezu powoduje pęcznienie.
Odmiany cementu:
Cement portlandzki (naturalnie szary)
Ze względu na barwę cement portlandzki dzielimy na: biały (bezbarwny), kolorowy (odpowiednie dodatki metali), ekspansywny (cement, który pęcznieje w trakcie wiązania)
Cement biały i kolorowy używany jest do wykończeń np. fug
Cement glinowy (podwyższona zawartość gliny)
Większa odporność na korozję, korzystny w warunkach zimowych, korzystny do napraw, szybko schnie i szybko zyskuje wytrzymałość, drogi.
Cementy żużlowe (na bazie żużlu)
Cement hutniczy (na bazie żwiru wielkopiecowego, czyli takiego, który powstaje w wielkich piecach hutniczych; wysoka odporność na korozję, korzystny w wodach morskich)
Cement gipsowo-żużlowy (na bazie żużlu i gipsu, brak zmian objętości, bez pęcznienia i kurczenia, korzystny przy wielkich blokach betonowych, w wielkich konstrukcjach)
Cement wapienno-żużlowy (słaba wytrzymałość, wapno palone + żużel, nie potrzebuje powietrza do wiązania, zastępuje zaprawę murarską, stosunkowo tani)
Wyszukiwarka
Podobne podstrony:
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
Chemia wykłady, koło II sem v.3.01, Izomeria optyczna
Chemia wykłady, koło II sem v.3.0 długopis, Izomeria optyczna
Chemia wykłady, koło II sem v.2.0, Izomeria optyczna
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
Chemia wykład I i II
pytania testowe i chemia budowlana -zestaw2(2), Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
chemia wykład 5, II rok
UZ1 - chemia - wyklady-1, II semestr, Chemia budowlana, Wykłady, Całość
Przykładowe egzaminy, Studia - Chemia kosmetyczna UŁ, I rok, II semestr, MATEMATYKA wykłady
II koło chemia, Chemia nieorganiczna Seliger
CHEMIA II KOLO, AM Gdynia, Sem. III,IV, Chemia wody, paliw i smarów
więcej podobnych podstron