
Założenia atomistycznej teorii
budowy materii
1. Wszystkie substancje składają się z niezmiernie
małych, niepodzielnych cząstek, zwanych
atomami, zachowujących swoją indywidualność
we wszystkich przemianach chemicznych.
2. Atomy danego pierwiastka są identyczne pod
każdym względem, m.in. mają jednakową masę.
Atomy różnych pierwiastków różnią się swoimi
własnościami, mają też różne masy.
3. Związki chemiczne powstają wskutek łączenia
się atomów różnych pierwiastków w określonych
i stałych stosunkach liczbowych. Masy atomów
nie ulegają zmianie w czasie reakcji chemicznej.

1.
Prawo zachowania masy – we wszystkich reakcjach
chemicznych masa produktów równa się masie substancji
wyjściowych (substratów).
2.
Prawo stosunków stałych – stosunek ilości wagowych
pierwiastków łączących się w dany związek jest stały.
3.
Prawo
stosunków
wielokrotnych
–
jeżeli
dwa
pierwiastki tworzą ze sobą dwa lub więcej związków, to
ilości wagowe jednego z nich, łączące się w tych związkach
z tą samą ilością wagową drugiego, mają się do siebie jak
proste liczby naturalne.
4.
Prawo objętościowe Gay-Lussaca – objętości substancji
gazowych (mierzonych w tej samej temperaturze i pod tym
samym ciśnieniem) biorących udział w danej reakcji
chemicznej mają się do siebie jak proste liczby naturalne.
5.
Hipoteza Avogadro – jednakowe objętości dwóch różnych
gazów znajdujących się w tej samej temperaturze i pod
tym samym ciśnieniem zawierają jednakową liczbę
cząsteczek

1. Stała Avogadra – 6,0221·10
23
2. 1 mol = 6,0221·10
23
sztuk:
cząsteczek, jonów, atomów,
elektronów, protonów…)
Części składowe atomu
• Atom jest elektrycznie obojętną mikrostruktrą
zbudowaną z dodatnio naładowanego jądra
otoczonego zespołem ujemnych elektronów.
Stanowi on najmniejszą ilość pierwiastka
zachowującą jego właściwości.
cząstk
a
symbo
l
masa
[u]
masa
przybliżo
na [u]
ładunek
[e]
proton
p
1,0072
78
1
+1
neutro
n
n
1,0086
15
1
0
elektro
n
e
0,0005
48
-1
1825
1

Atomowa jednostka masy – jest to
masy atomu węgla C-12
Elementarna jednostka ładunku –
jest to wartość równa ładunkowi
elektrycznemu jaki ma elektron
e 1,6 ·10
-19
C
12
1

• Liczba atomowa Z – określa liczbę protonów
w danym atomie
• Liczba masowa A - określa sumę protonów i
neutronów w danym atomie
N = A – Z, N – liczba neutronów w danym jądrze
atomowym
nukleon - suma protonów i neutronów w
jądrze atomowym

• Pierwiastek
chemiczny
–
zbiór
atomów o tej samej wartości liczby
masowej A i atomowej Z
• Izotopy – zbiór atomów o tej samej
liczbie atomowej Z, a różnej wartości
liczby masowej A
• Izobary – zbiór atomów o tej samej
wartości liczby masowej A i różnej
liczbie atomowej Z

Budowa atomu
wodoru
teoria Nielsa Bohra
Bohr przyjął za
punkt wyjścia
model jądrowy
Rutherforda:
zakładający, że w
geometrycznym
środku atomu
znajduje się jądro
wokół, którego
krąży elektron

Postulaty Bohra
Postulat I
• Elektron w atomie może przebywać w jednym
z wielu stanów energetycznych ( tzw. stanów
stacjonarnych), w których jego energia ma
ściśle określoną stałą wartość
2
h
n
mvr
m – masa elektronu, V – prędkość, r – promień orbity, h=6,625 ·10
-34
J ·s
- stała Plancka, n – kolejne liczby całkowite

Postulat II
Elektron może pobrać kwant energii
docierającej do atomu z zewnątrz i przejść
do stanu stacjonarnego o wyższej energii
lub może oddać kwant energii w formie fali
elektromagnetycznej i przejść do stanu
stacjonarnego o niższej energii
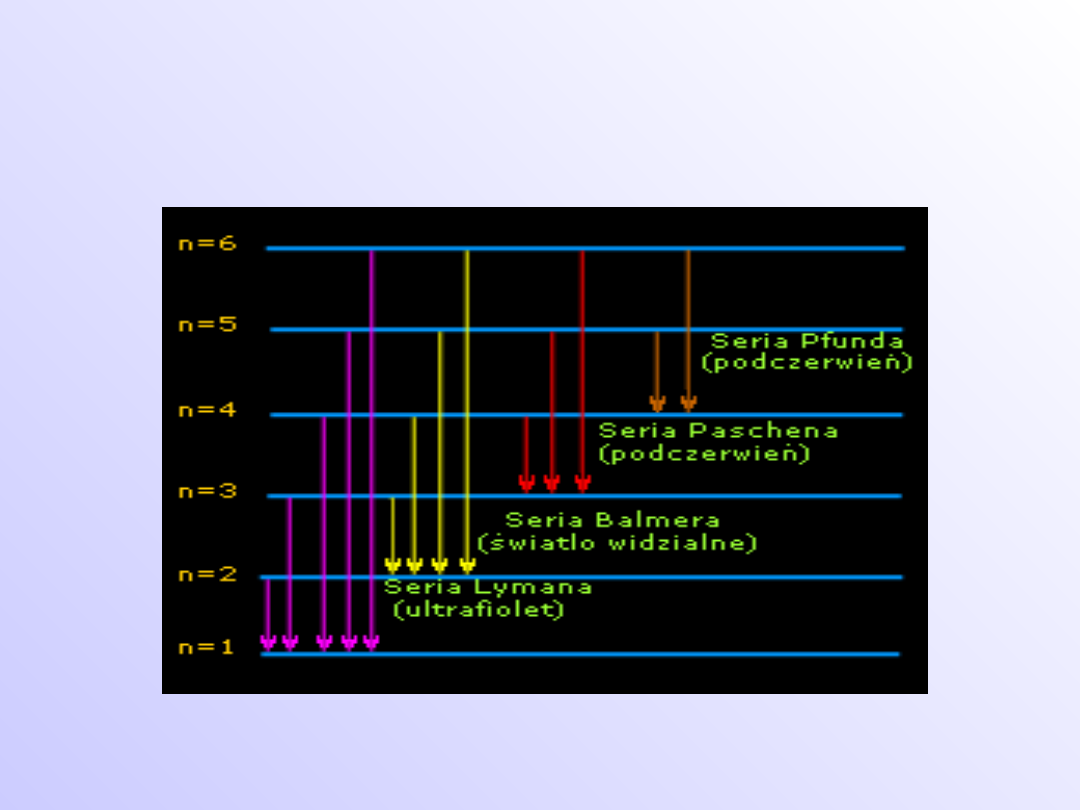
Schemat powstawania serii widma
emisyjnego wodoru.

Podstawy współczesnej teorii
kwantowej
• Elektron w atomie może przebywać w jednym z
wielu
możliwych
stanów
tzw.
stanów
kwantowych, z których każdy jest określony
skwantowanymi wartościami wielkości: energii
(n)- główna liczba kwantowa,
momentu pędu (krętu) (l) – orbitalna
(poboczna) liczba kwantowa,
rzutu momentu pędu na wyróżniony kierunek
(m) – magnetyczna liczba kwantowa,
spinu (S) – spinowa liczba kwantowa,
rzutu spinu na wyróżniony kierunek (m
s
) –
magnetyczna spinowa liczba kwantowa.

W żadnym stanie kwantowym elektron nie
wypromieniowuje ani nie pochłania energii, nie
zmienia wartości momentu pędu i spinu ani ich
orientacji przestrzennej
Nie można określić równocześnie dokładnego
położenia i pędu elektronu w danej chwili –
zasada nieoznaczoności Heisenberga
Ruch elektronu w atomie można opisać
równaniem
różniczkowym
(równaniem
Schrödingera), którego rozwiązaniem są funkcje
falowe i odpowiadające im wartości energii
H = E
Operator H działa na funkcję = (energia całkowita) razy
funkcja

Dla każdego stanu kwantowego można
obliczyć prawdopodobieństwo przebywania
elektronu w danej odległości od jądra oraz
określić
kształt
i
rozmiary
orbitalu
atomowego.
Orbital atomowy jest to najmniejszy obszar
przestrzeni wokółjądrowej, wewnątrz którego
prawdopodobieństwo znalezienia elektronu
ma określoną wartość (90%)
Zbiór stanów kwantowych o wspólnej wartości
głównej liczby kwantowej n – nazywamy powłoką
elektronową;
liczba
stanów
kwantowych
jest
określona iloczynem 2n
2
wartość n
1 2 3 4 5 6 7 ...
nazwa powłoki
K L M N O P Q ...
Główna liczba kwantowa n decyduje o wielkości
orbitalu

Zbiór stanów kwantowych, z których wszystkie
mają wspólną wartość głównej liczby kwantowej
n oraz wspólną wartość orbitalnej liczby
kwantowej l – nazywamy podpowłoką kwantową
– liczba stanów kwantowych wynosi 4l+2
wartość l 0 1 2 3 4 5 6 ...
symbol podpowłoki
s p d f g h i ...
Orbitalna liczba kwantowa l decyduje o kształcie
orbitalu
Orbitalna liczba kwantowa l przyjmuje wartości
od 0 do (n-1)

Zbiór stanów kwantowych o wspólnych
wartościach
głównej
n,
orbitalnej
l
i
magnetycznej m liczby kwantowej – nazywamy
poziomem orbitalnym. Liczba poziomów
orbitalnych w powłoce wynosi n
2
, a w
podpowłoce 2l+1. Do każdego poziomu
orbitalnego należą dwa stany kwantowe
różniące się orientacją przestrzenną spinu.
magnetyczna liczba kwantowa m decyduje o
orientacji przestrzennej orbitalu.
magnetyczna liczba kwantowa m przyjmuje
następujące wartości: od –l do +l z zerem
włącznie

Spinowa liczba kwantowa S nie wpływa na
zróżnicowanie
stanów
kwantowych
i
przyjmuje wartość równą ½
Magnetyczna spinowa liczba kwantowa m
s
określa liczbę stanów kwantowych w poziomie
orbitalnym i przyjmuje wartość –1/2 lub +1/2
Elektron może absorbować kwant energii
docierający do atomu z zewnątrz i przejść do
stanu kwantowego o wyższej energii lub może
emitować do otoczenia kwant energii w formie
fali elektro magnetycznej przechodząc do
stanu o niższej energii
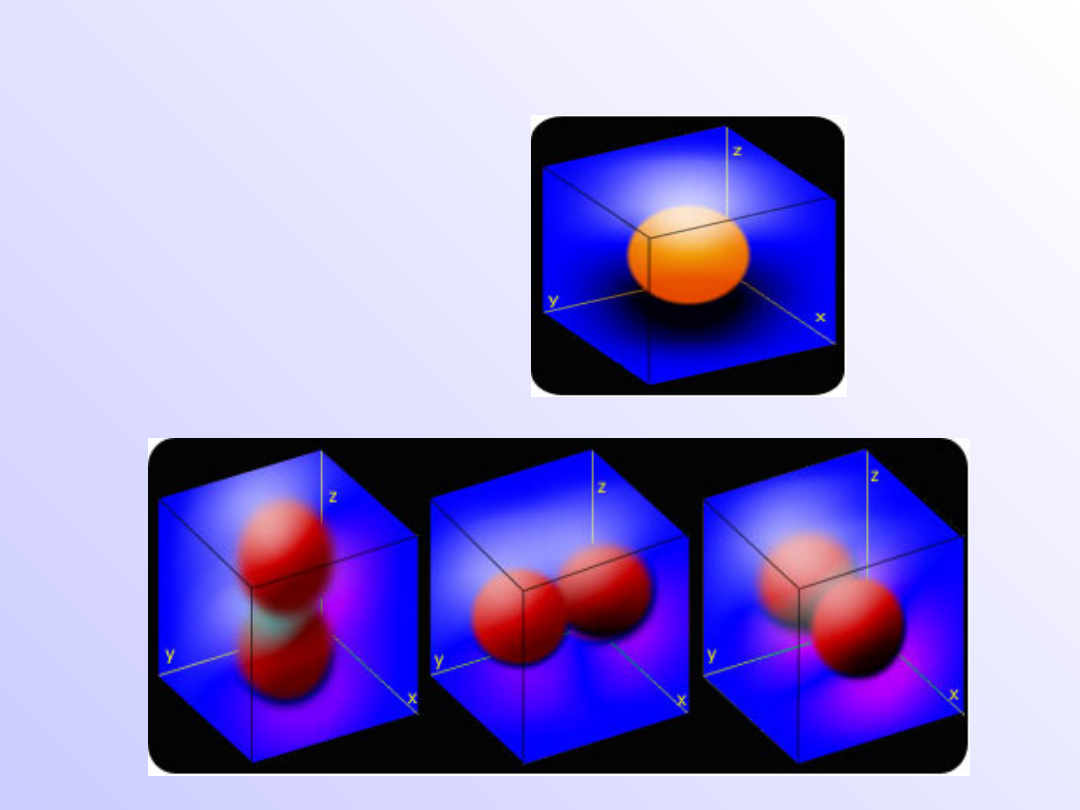
Kształty orbitali
Orbital typu s
Orbitale typu p

Orbitale typu d
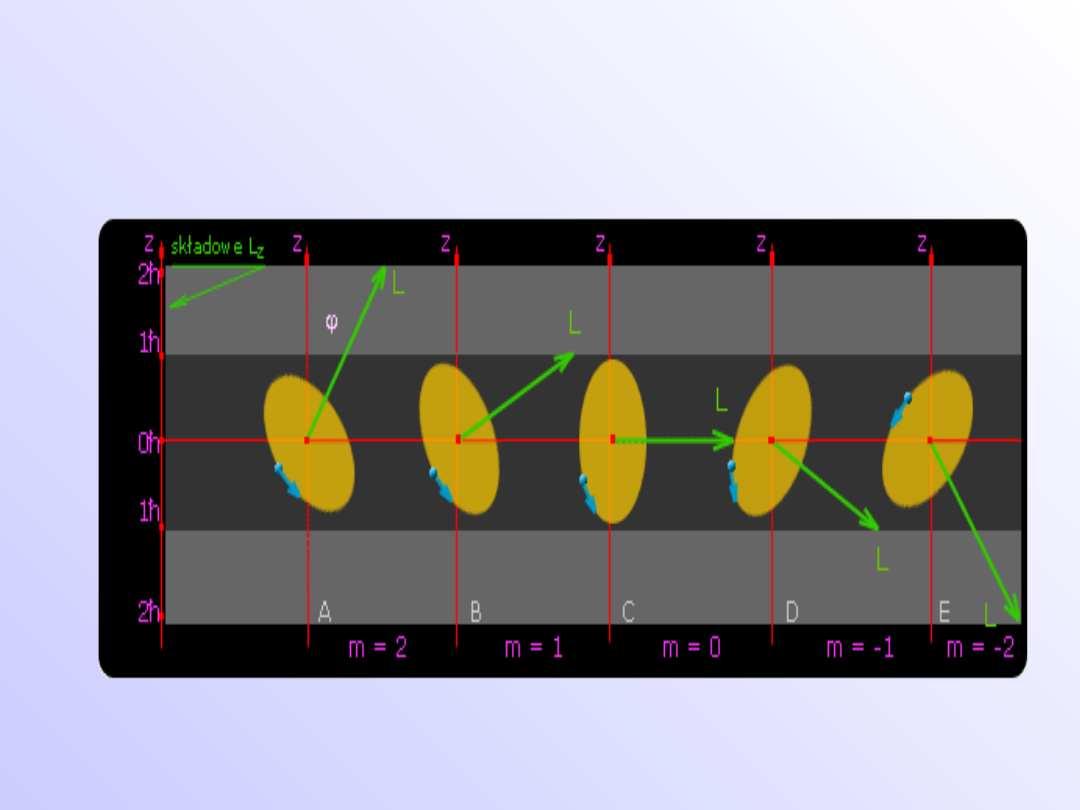
• Wektor orbitalnego momentu L jest skwantowany w
przestrzeni. Względem danego kierunku z dozwolone
są jedynie pewne ustawienia wektora L.
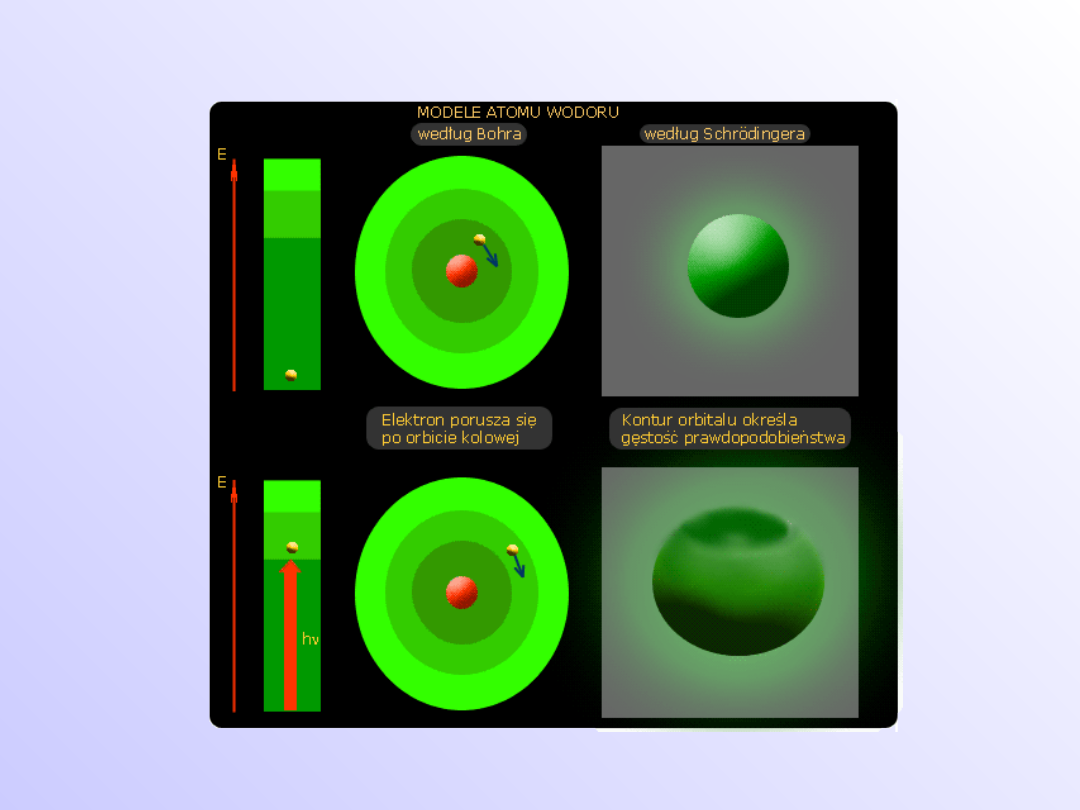
Modele atomu wodoru

Konfiguracja elektronowa
• Konfiguracja elektronowa, czyli
rozmieszczenie
elektronów
w
atomie, daje chemikowi cenne
informacje,
pozwalające
przewidywać
właściwości
i
zachowanie się pierwiastka w
różnych warunkach oraz reakcje
chemiczne, w jakie może wchodzić
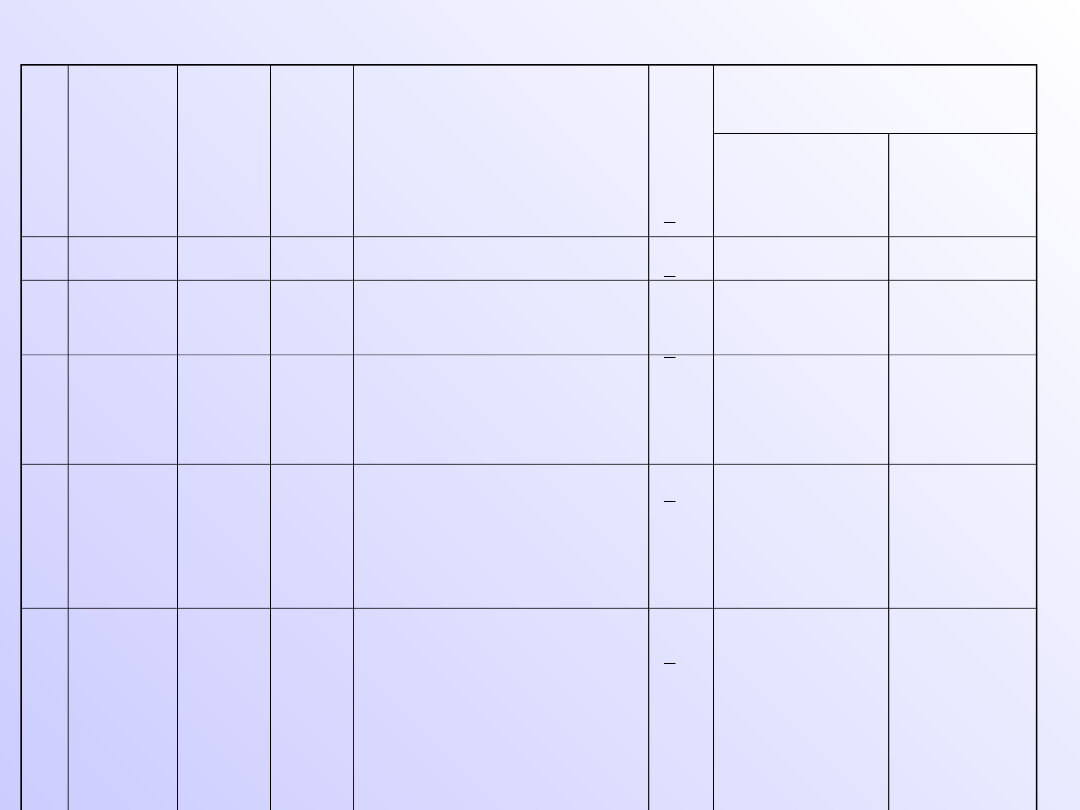
Rozmieszczenie elektronów na poziomach
kwantowych
n
powło
ka
l
pod
pow
łoka
m
m
s
Największa możliwa
liczba elektronów
W podpowłoce
W powłoce
1
K
0 (s)
1s
0
2
2
2
L
0 (s)
1 (p)
2s
2p
0
+1,0,-1
2
6
8
3
M
0 (s)
1 (p)
2 (d)
3s
3p
3d
0
+1,0,-1
+2, +1,0, -1,-2
2
6
10
18
4
N
0 (s)
1 (p)
2 (d)
3 (f)
4s
4p
4d
4f
0
+1,0,-1
+2, +1,0, -1,-2
+3,+2, +1,0, -1,-2,-3
2
6
10
14
32
5
O
0 (s)
1 (p)
2 (d)
3 (f)
4 (g)
5s
5p
5d
5f
5g
0
+1,0,-1
+2, +1,0, -1,-2
+3,+2, +1,0, -1,-2,-3
+4,+3,+2, +1,0, -1,-
2,-3,-4
2
6
10
14
18
50
2
1
2
1
2
1
2
1
2
1

Zakaz Pauliego :
W atomie nie mogą istnieć dwa elektrony,
których stan kwantowy nie różniłby się
przynajmniej jedną liczbą kwantową
Zasada Hunda
Liczba niesparowanych elektronów w danej
podpowłoce powinna być możliwie największa
Pary elektronów w danej podpowłoce tworzą
się dopiero po zapełnieniu wszystkich poziomów
orbitanych danej podpowłoki przez elektrony
niesparowane
elektrony
niesparowane
w
poziomach
orbitalnych danej podpowłoki mają jednakową
wartość spinu
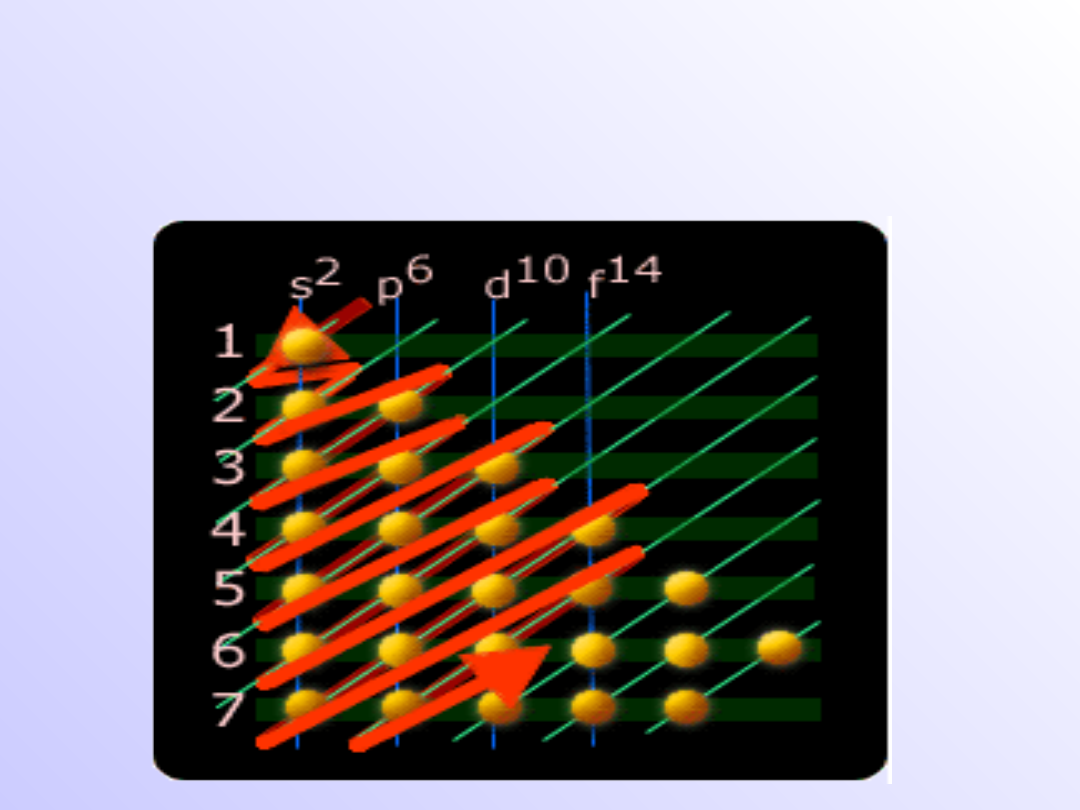
Kolejność obsadzania poziomów
energetycznych

Przykłady konfiguracji
elektronowej
• Sód
1s
2
2s
2
2p
6
3s
1
• 1s
2
• 2s
2
2p
6
• 3s
1
• Żelazo
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
• 1s
2
• 2s
2
2p
6
• 3s
2
3p
6
3d
6
• 4s
2
Fe
56
26
Na
23
11
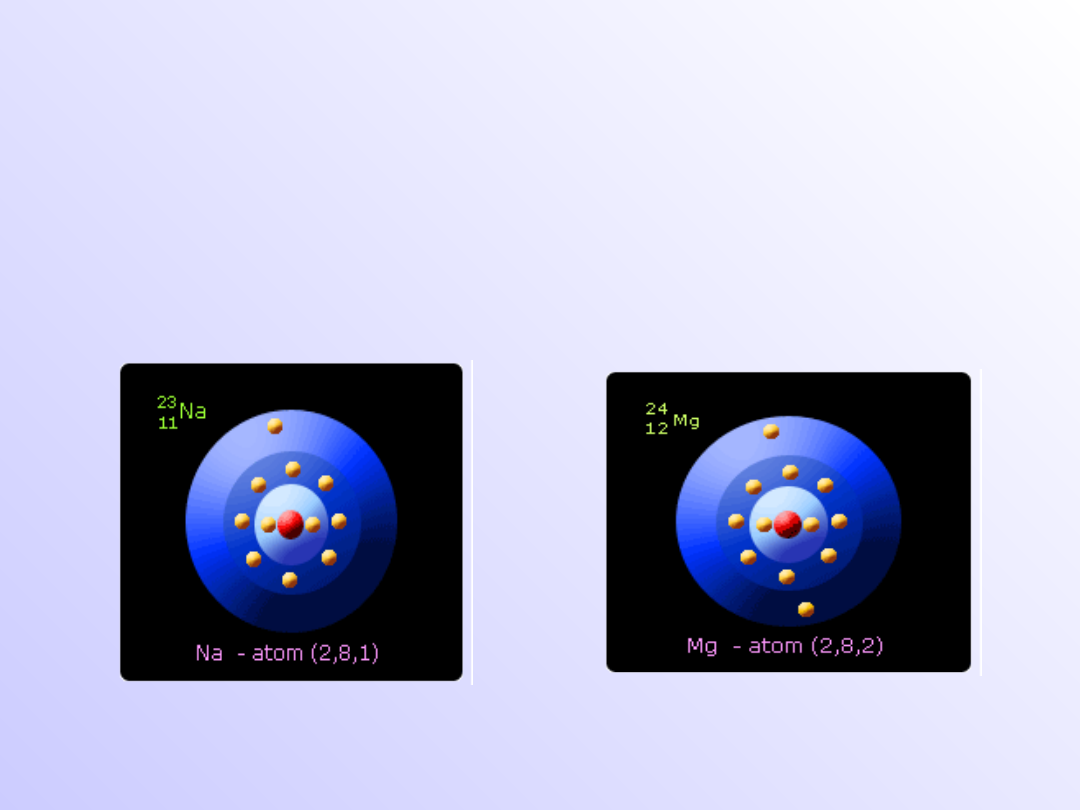
Elektrony walencyjne
• Elektrony znajdujące się na ostatniej
powłoce słabo związane z jądrem atomu
–
decydują
o
właściwościach
chemicznych danego pierwiastka

Układ okresowy
pierwiastków
• Prawo okresowości w swojej
współczesnej wersji mówi, że
właściwości
pierwiastków
chemicznych
uporządkowanych
według
wzrastających
liczb
atomowych Z powtarzają się
okresowo.
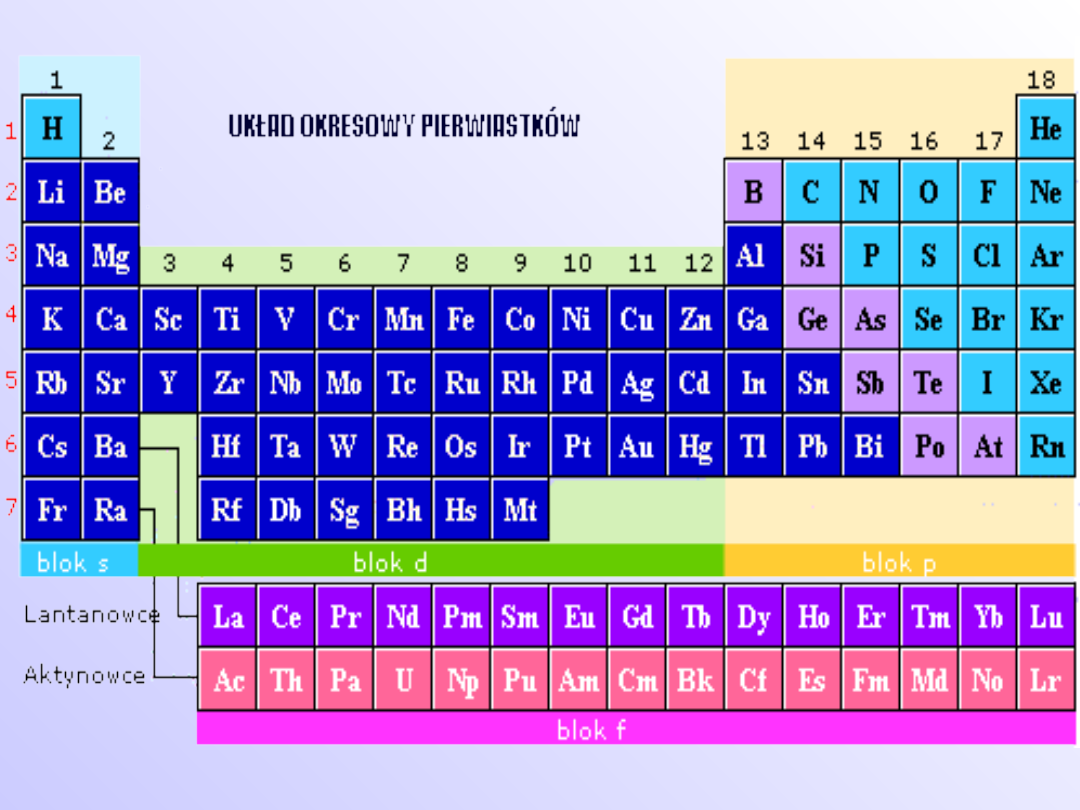

Okresowość cech chemicznych
• Własności chemiczne, a szczególnie okresowość
ich zmian można odczytać z katalogu elektronów.
• Najprostsze zależności występują w przypadku
pierwiastków grup głównych. Podczas tworzenia
wiązania elektrony są tak oddawane, pobierane
lub rozdzielane między partnerami wiązania, aby
została osiągnięta najbliższa konfiguracja gazu
szlachetnego.

• Konfiguracji
gazu
szlachetnego
odpowiada
ośmioelektronowa powłoka zewnętrzna, mówi się
wtedy o tworzeniu oktetu lub o regule oktetu. W
tych przegrupowaniach elektronów towarzyszących
tworzeniu się związku chemicznego uczestniczą
tylko elektrony walencyjne. Ponieważ zarówno
liczba elektronów walencyjnych, jak i liczba
niesparowanych elektronów powtarzają się z
określoną prawidłowością, to uzależnione od nich
właściwości chemiczne zmieniają się okresowo.
• Pierwiastki znajdujące się jeden pod drugim mają
jednakowe liczby elektronów walencyjnych, a zatem
tworzą też szeregi związków o jednakowym wzorze
ogólnym. W obrębie danej grupy właściwości
zmieniają się monotonicznie, natomiast w obrębie
jednego okresu własności te zmieniają się skokowo
od grupy do grupy.

Promień atomowy
• Promień atomy pierwiastka definiuje się jako połowę
odległości między środkami sąsiednich atomów.
- Jeśli pierwiastek jest metalem chodzi o odległość między
środkami sąsiednich atomów w fazie stałej – np. odległość
między sąsiednimi jądrami atomów miedzi wynosi 256 pm
to promień atomowy jest równy 128 pm.
- Jeśli pierwiastek jest niemetalem, to rozpatrujemy
odległość między środkami atomów połączonych
wiązaniem chemicznym – połowę tej odległości nazywamy
wtedy promieniem kowalencyjnym, np. odległość między
jądrami chloru w cząsteczce Cl
2
wynosi 198 pm, więc
promień atomowy jest równy 99 pm.
• Promienie atomowe wzrastają ku dołowi grupy i
maleją w okresie od strony lewej do prawej

Promień jonowy
• Promień jonowy pierwiastka jest określany
jako udział w odległości między sąsiednimi
jonami w jonowej substancji stałej.
• Odległość między jadrami kationu i
sąsiadującego z nim anionu jest sumą
dwóch promieni jonowych.
• Promienie jonowe kationów są z reguły
mniejsze niż promienie anionów.
• Na ogół promienie jonowe wzrastają ku
dołowi grupy i maleją w okresie od strony
lewej do prawej. Kationy są mniejsze, a
aniony – większe od swych macierzystych
atomów.

Energia jonizacji
• Jest to energia potrzebna do oderwania elektronu od
atomu pierwiastka w fazie gazowej - pierwsza
energia jonizacji
• Cu
(g)
→ Cu
(g)+
+ e
-
I
1
=785 kJ/mol
• Druga energia jonizacji jest to energia potrzebna do
oderwania elektronu od pojedynczo naładowanego
kationu w fazie gazowej
• Cu
(g)+
→ Cu
(g)2+
+ e
-
I
2
=1958 kJ/mol
• Wszystkie energie jonizacji są dodatnie, ponieważ
oderwanie elektronu od atomu wymaga dostarczenia
energii.
• Pierwsze energie jonizacji są największe dla
pierwiastków położonych bliska hel, a najmniejsze
dla pierwiastków położonych blisko cezu.
• Metale mają niskie wartości energii jonizacji , więc
łatwo tracą elektrony.
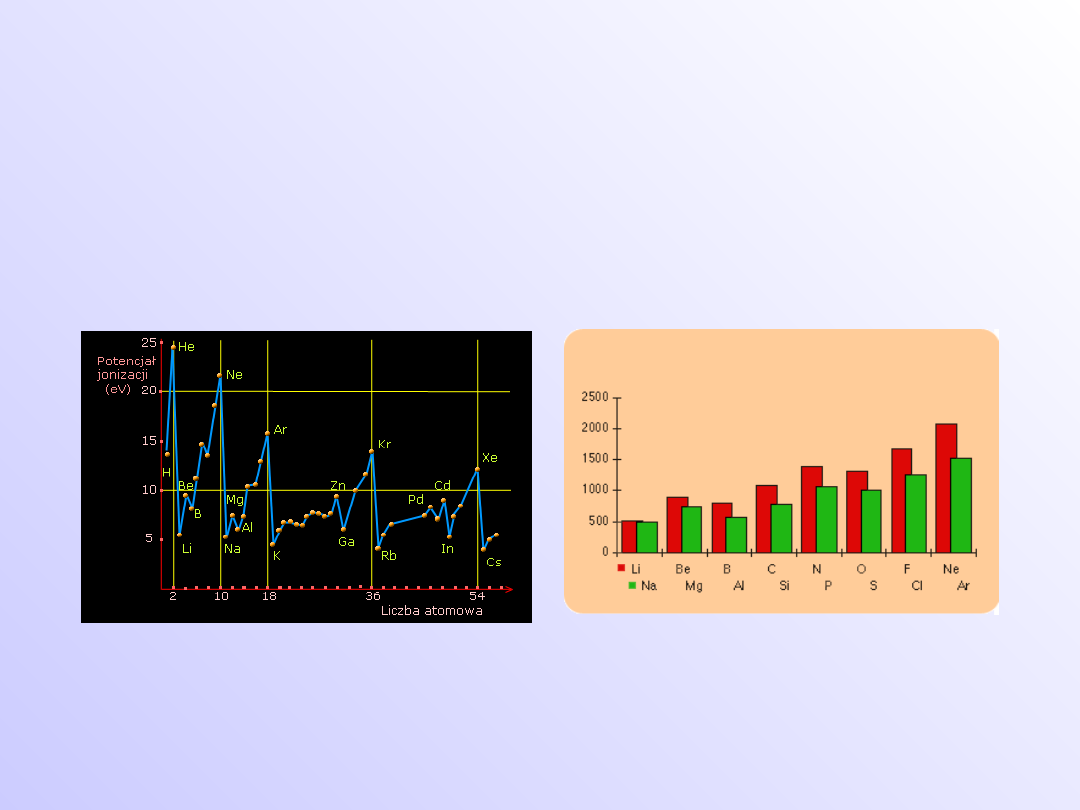
Potencjały jonizacyjne,
w zależności od
wzrastającej liczby
atomowej
pierwiastków
.
Pierwszy potencjał jonizacji
pierwiastki I, II i III okresu
.

Powinowactwo elektronowe
• E
p,e
– jest to energia wydzielona podczas
przyłączenia elektronu do atomu
pierwiastka w stanie gazowym
• Cl
(g)
+ e
-
→ Cl
(g)-
• Dodatnie powinowactwo elektronowe
oznacza, że energia anionu jest mniejsza
od łącznej energii atomu i swobodnego
elektronu.
• Największą wartość powinowactwa
elektronowego posiadają pierwiastki
położone blisko tlenu, fluoru i chloru

Podsumowanie
• Wszystkie pierwiastki bloku s są reaktywnymi
metalami
• Pierwiastki bloku p wykazują tendencje do
przyłączania elektronów w celu osiągnięcia
zamkniętych powłok; charakter tych
pierwiastków zmienia się od metalicznego,
poprzez półmetaliczny , do niemetalicznego.
• Dwa powiązane diagonalnie pierwiastki często
wykazują podobne właściwości chemiczne
• Wszystkie pierwiastki bloku d są metalami o
właściwościach pośrednich między
właściwościami pierwiastków bloku s i p. Wiele
pierwiastków bloku d tworzy kationy na
różnych stopniach utlenienia
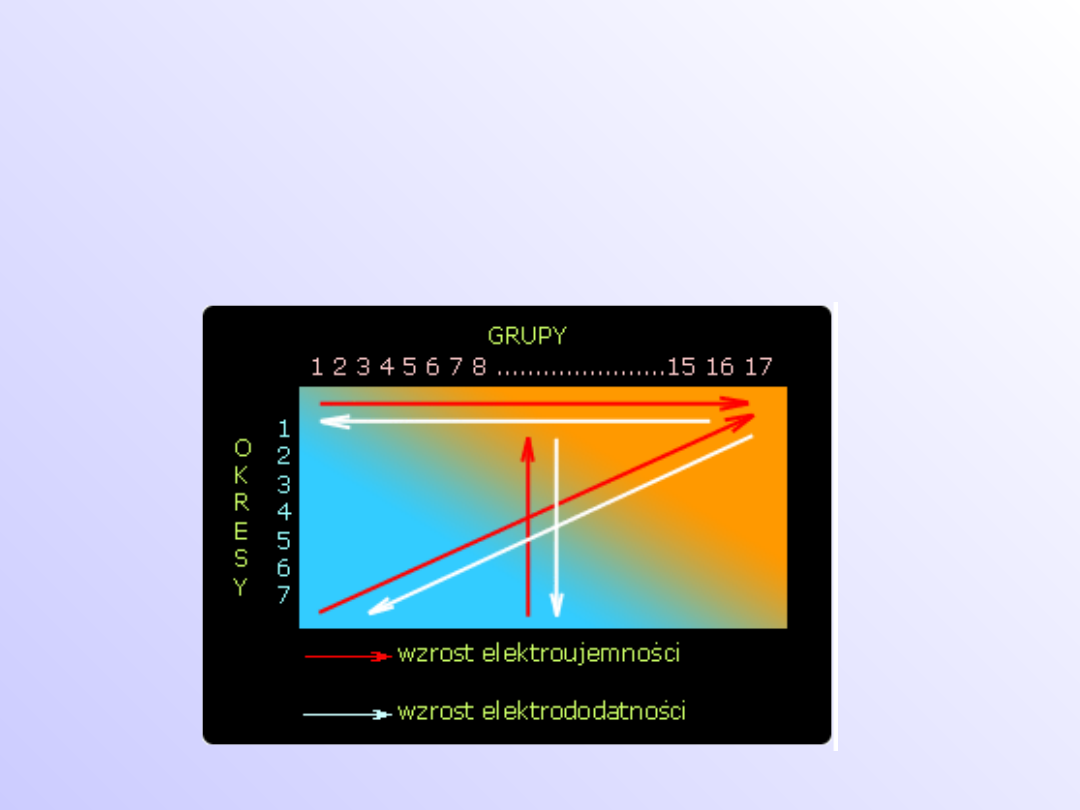
• Pierwiastki, których atomy w reakcjach
chemicznych przyłączają elektrony, przyjmując w
związkach ujemne stopnie utlenienia lub tworzą
jony ujemne - nazywamy elektroujemnymi.
• Pierwiastki, których atomy w reakcjach
chemicznych "tracą" elektrony lub tworzą jony
dodatnie - nazywamy elektrododatnimi

Skala elektroujemności Paulinga:
• Oparta jest na wartości energii wiązań
• Energia wiązania jest równa różnicy między
energią cząsteczki a energią tworzących ją
atomów
• W przypadku cząsteczek dwuatomowych
energia
wiązania
odpowiada
energii
potrzebnej do rozerwania cząsteczki na atomy
• Skala
elektroujemności
pozwala
na
przybliżone szacowanie trwałości i mocy
wiązań.

Skala elektroujemności Paulinga

Teorie tworzenia wiązań
chemicznych:
• elektronowa teoria wiązania chemicznego –
(Kossel, Lewis (1916) Langmuir (1919)) :
opiera się na trwałości konfiguracji oktetowej i w sposób
jednolity na podstawie reguły oktetu i dubletu wyjaśnia
różne typy i liczby wiązań w związkach chemicznych.
• kwantowa
teoria
tworzenia
wiązań
chemicznych:
– teoria orbitali molekularnych (MO) –zakłada, że
wiążące elektrony zajmują orbitale molekularne,
przypominające orbitale atomowe, lecz obejmujące całe
cząsteczki
– teoria wiązań walencyjnych (VB)- opisuje powstanie
wiązania jako wynik sparowania elektronów w
orbitalach atomowych łączących się atomów

• Cząsteczki powstają w wyniku połączenia się
dwóch lub więcej atomów. Atomy łączą się ze sobą
tylko wtedy, gdy energia cząsteczki jest mniejsza od
sumy energii poszczególnych atomów. Oznacza to,
że proces tworzenia się cząsteczki powinien być
energetycznie korzystny, a więc powinien
prowadzić do osiągnięcia przez układ minimum
energii. A to oznacza, że w procesie łączenia się
atomów w cząsteczkę jest uwalniana energia.
Najczęściej uwalniana energia ma postać ciepła.
• wszystkie atomy podczas reakcji chemicznych dążą
do uzyskania konfiguracji elektronowej
najbliższego gazu szlachetnego, czyli posiadania
ośmiu elektronów - oktetu elektronowego na
zewnętrznej powłoce, lub posiadania dwóch
elektronów - dubletu elektronowego
Wiązania chemiczne
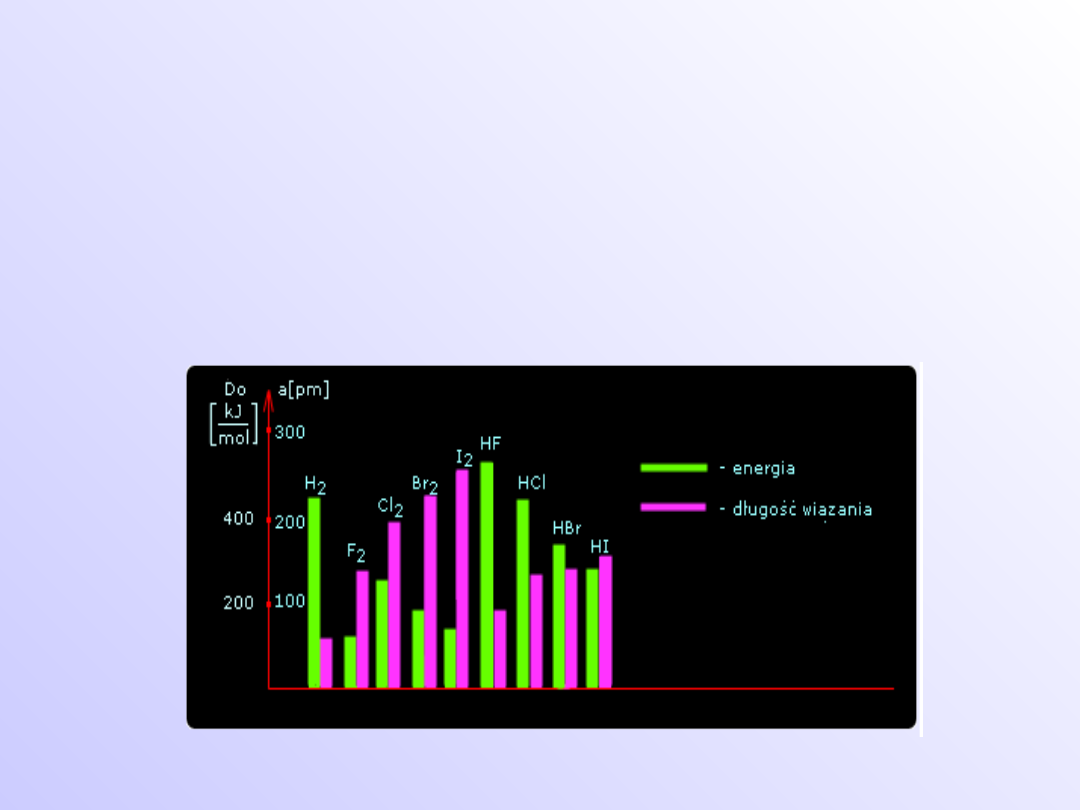
Wielkości charakteryzujące
wiązanie
• energia dysocjacji (energia wiązania)
• odległość pomiędzy atomami (długość
wiązania)
• kąt pomiędzy kierunkami wiązań (kąt
walencyjny).

Typy wiązań chemicznych
• wiązanie jonowe czyli elektrowalencyjne
• wiązanie atomowe czyli kowalencyjne
• wiązanie pośrednie czyli atomowe
spolaryzowane (kowalencyjne
spolaryzowane)
• wiązanie donorowo-akceptorowe
(koordynacyjne)
• wiązanie wodorowe
• wiązanie międzycząsteczkowe czyli
wiązanie siłami van der Waalsa
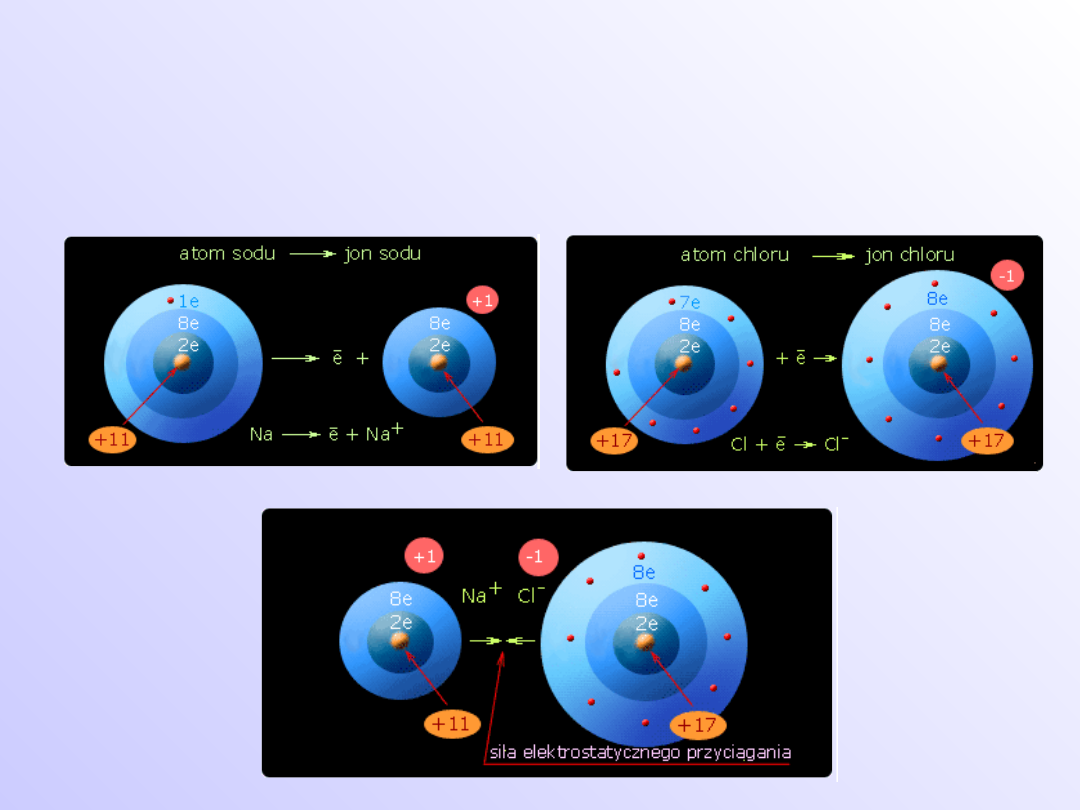
Wiązanie jonowe (elektrowalencyjne)
• Wiązania jonowe występują w układach
złożonych z atomów skrajnie różniących się
elektroujemnością
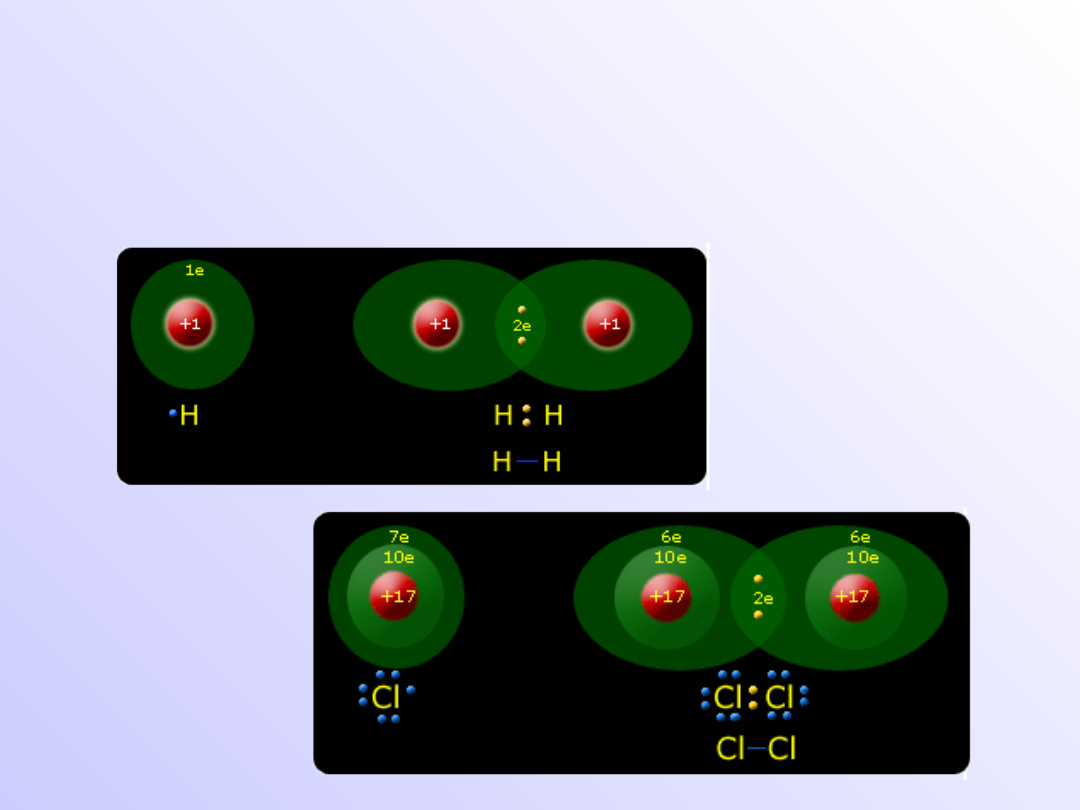
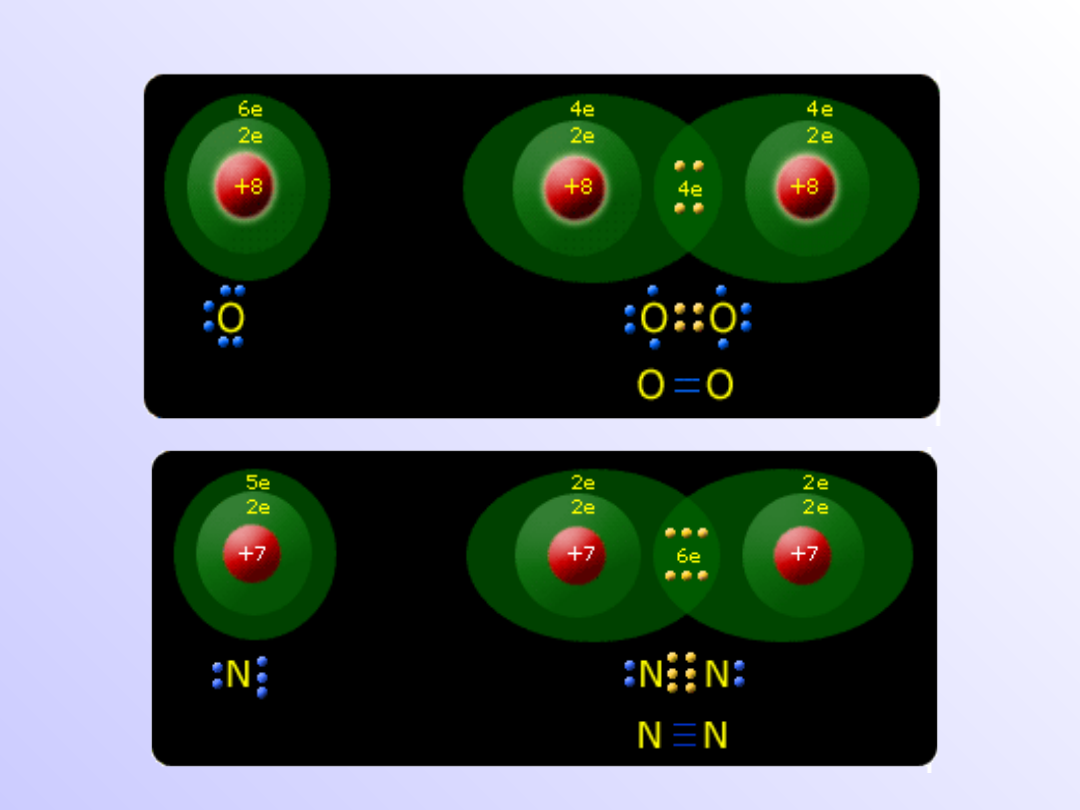
Wiązanie atomowe
(kowalencyjne)
• Wiązania atomowe (kowalencyjne) powstają, gdy
łączą
się
z
sobą
atomy
pierwiastków
elektroujemnych o takich samych wartościach
elektroujemnością
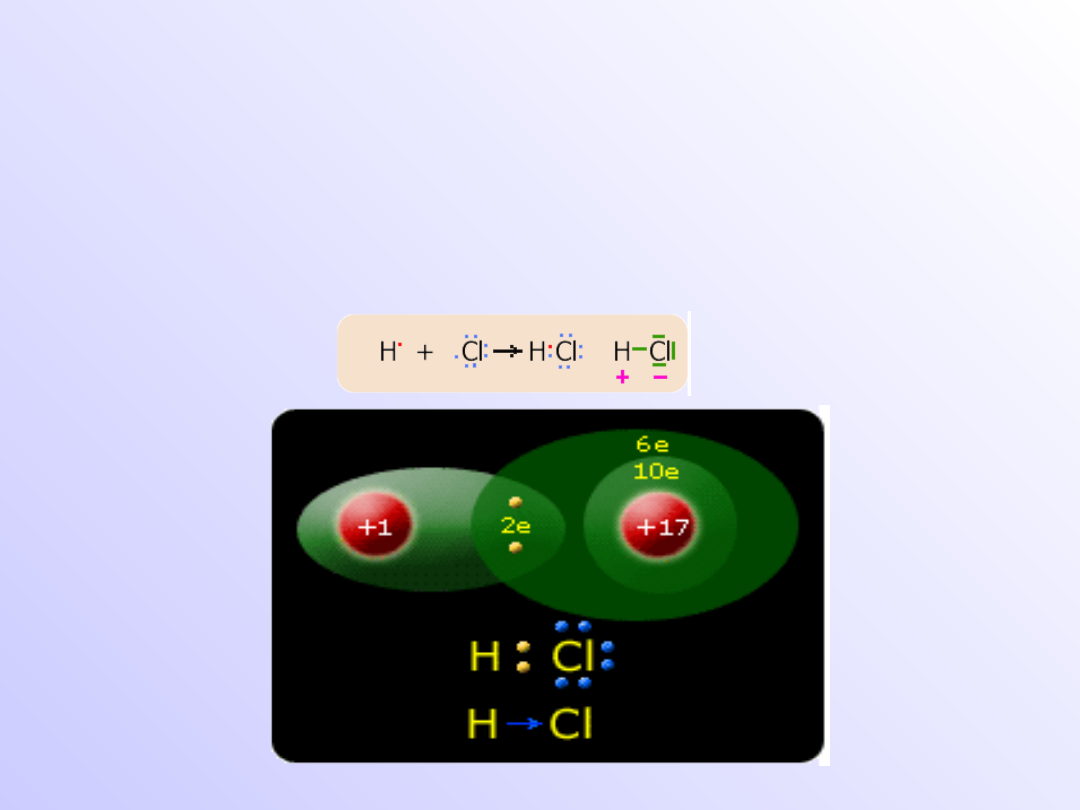
Wiązanie atomowe (kowalencyjne)
spolaryzowane
• Wiązanie
atomowe
spolaryzowane
jest
wiązaniem pośrednim między jonowym a
atomowym; powstaje wówczas, gdy łączą się
ze sobą atomy pierwiastków różniących się
elektroujemnością, lecz nie tak znacznie jak w
przypadku tworzenia wiązania jonowego.
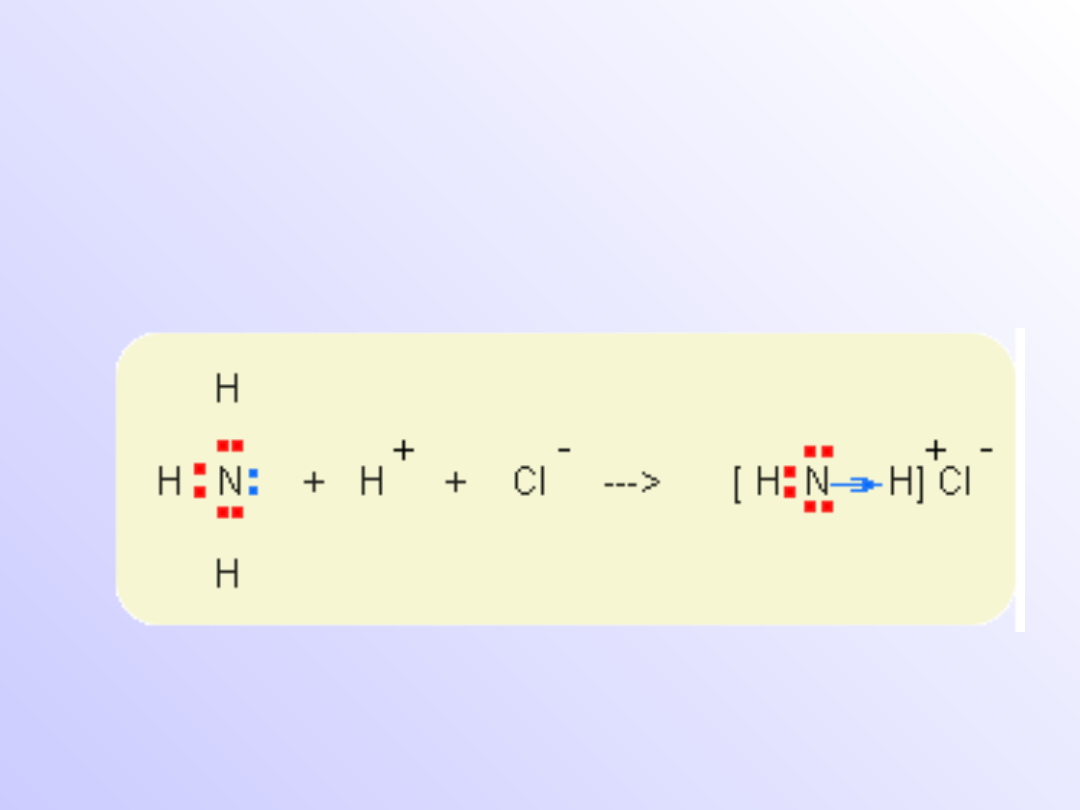
Wiązanie donorowo-akceptorowe
(koordynacyjne)
• Wiązanie donorowo-akceptorowe tym różni się
od wiązania atomowego lub atomowego
spolaryzowanego,
że
para
elektronowa
tworzących wiązanie oddawana jest przez
jeden z dwóch łączących się atomów.

Wiązanie metaliczne
• Pojęcie wiązania metalicznego stosowane jest
dla scharakteryzowania wiązania chemicznego
istniejącego pomiędzy atomami metalu w
stanie stałym kiedy mamy do czynienia z tzw.
siecią metaliczną.
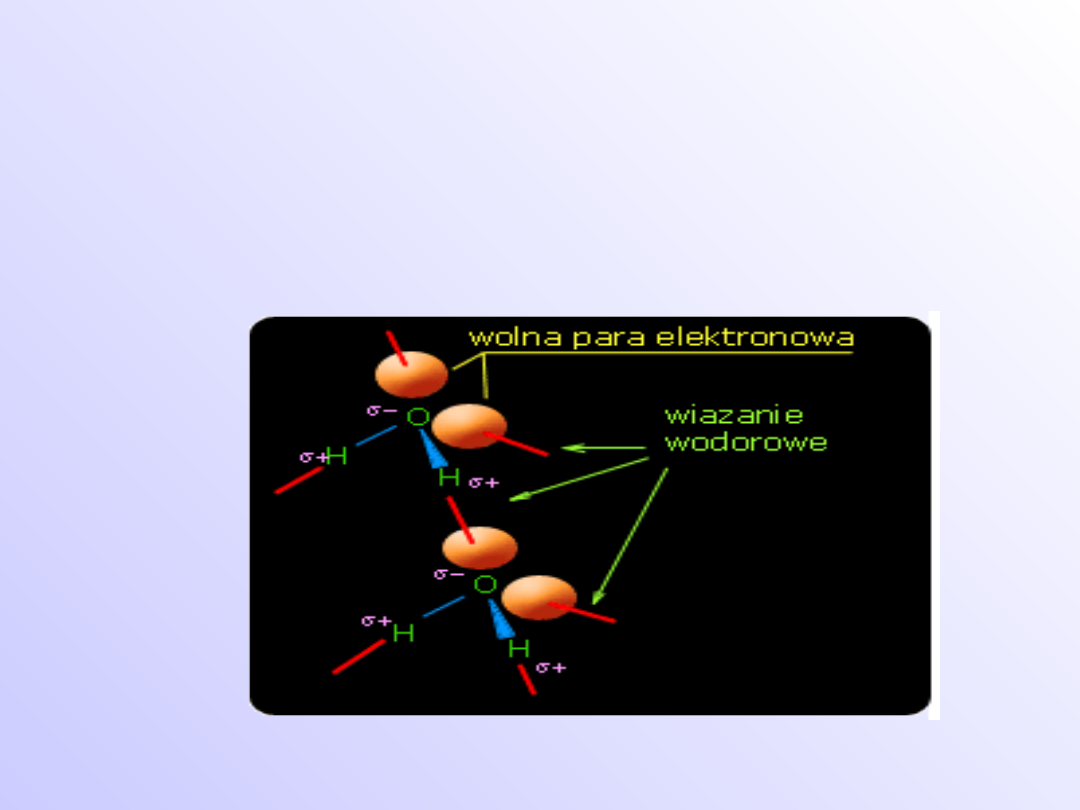
Wiązanie wodorowe
• Wiązanie wodorowe tworzy się pomiędzy
atomem wodoru związanym z atomem o
dużej elektroujemności, a atomem z
wolnymi parami elektronowymi.

Wiązania van der Waalsa
•
Siły van der Waalsa są wynikiem
wzajemnego oddziaływania elektronów i
jąder w cząsteczkach - polegają one na
przyciąganiu się szybkozmiennych albo
falujących
dipoli.
W wyniku ruchu elektronów walencyjnych
gęstość ładunku ujemnego na zewnętrznej
powłoce atomów ulega szybkim fluktuacjom
wzbudzając podobną fluktuację w powłoce
walencyjnej sąsiednich atomów. Powstają
szybkozmienne dipole, które wzajemnie
przyciągają się zwiększając, w miarę
zbliżania
się,
wzajemną
polaryzację
elektronową.

Teoria orbitali molekularnych
• Teoria ta zakłada, że podczas powstawania wiązania
chemicznego
chmury
elektronowe
orbitali
(zawierających niesparowany elektron) każdego z
wiążących się atomów przenikają się lub nakładają
nawzajem i powstają w ten sposób tzw. orbitale
molekularne.
• Przy kombinacji dwu orbitali atomowych tworzą się dwa
energetycznie różne orbitale cząsteczkowe:
jeden (nisko energetyczny) wiążący (σ
1s
) gdy
występuje interferencja konstruktywna- amplitudy fal
się dodają
Ψ = Ψ
A
+ Ψ
B
i jeden (wysoko energetyczny) antywiążący (σ
*1s
) –
interferencja destruktywna – amplitudy fal się odejmują
Ψ = Ψ
A
- Ψ
B
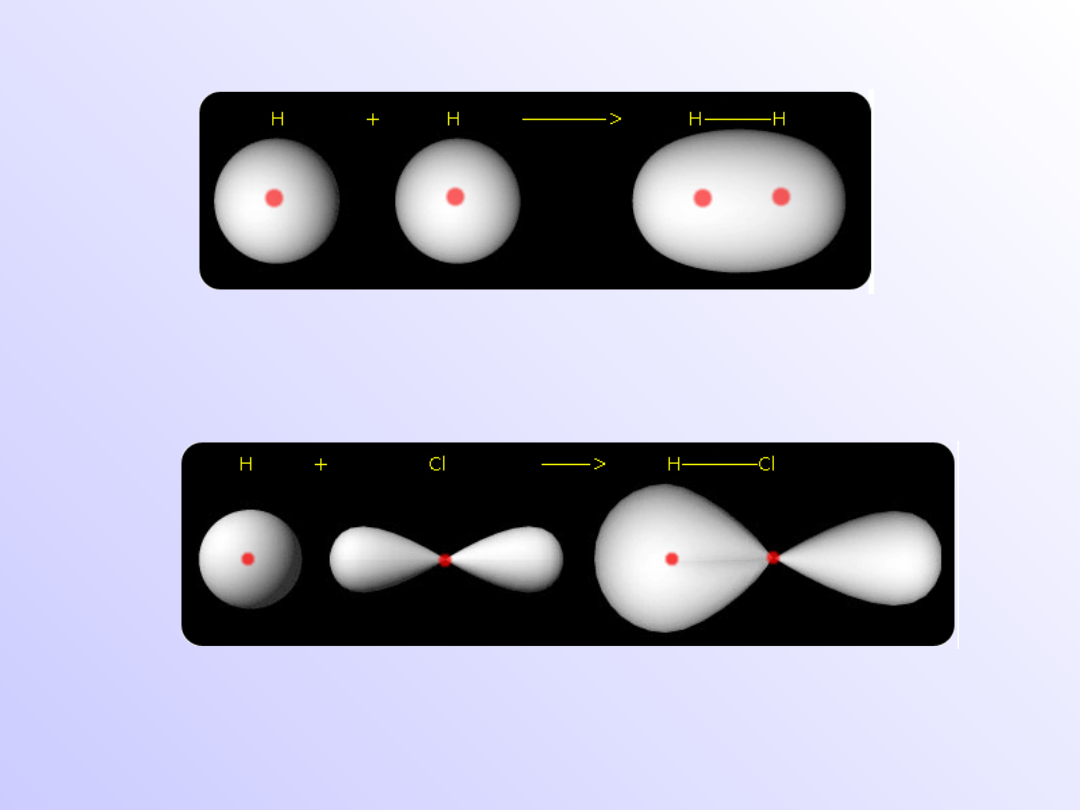
Nakładanie się osiowe orbitali s
Nakładanie się osiowe orbitali s i p
wiązanie
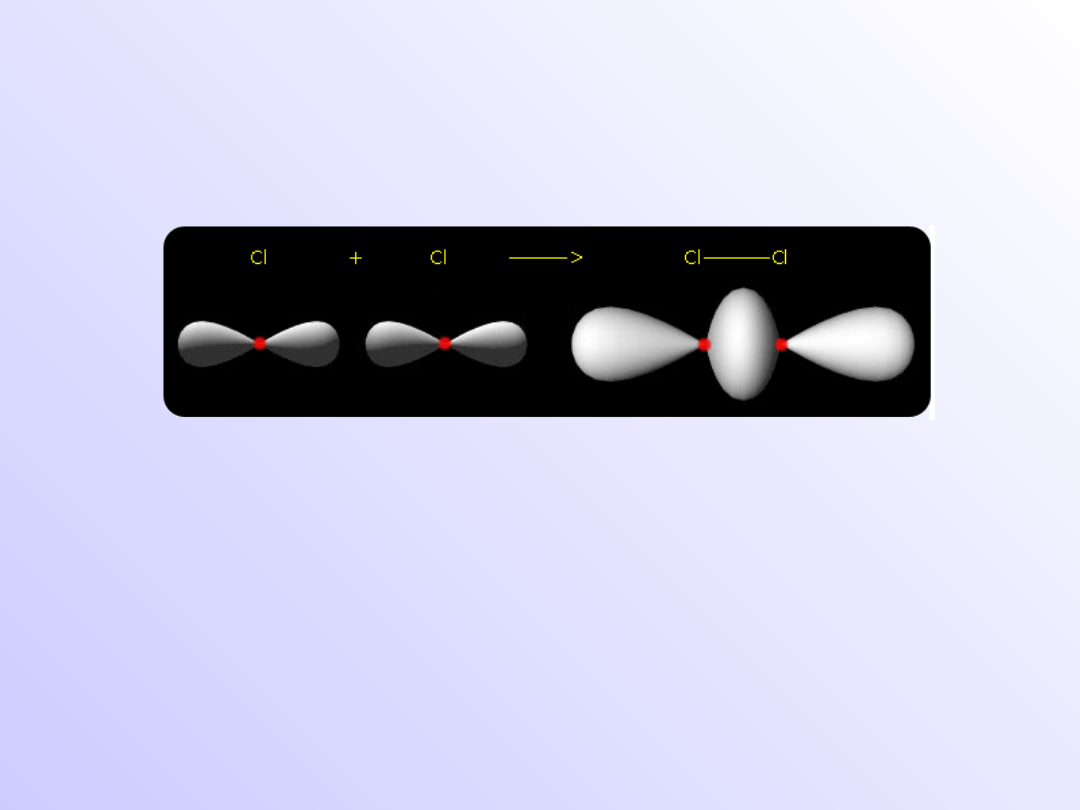
Nakładanie się osiowe orbitali p

Nakładanie boczne orbitali p
Wiązanie

Teoria wiązań walencyjnych
• Teoria wiązań walencyjnych opisuje powstawanie
wiązania jako wynik sparowania elektronów w
orbitalach atomowych łączących się atomów. Punktem
wyjścia dla tej teorii jest założenie, że w cząsteczce nie
jest możliwe odróżnienie elektronu (1) należącego do
atomu A od elektronu (2) należącego do atomu B.
• nie można traktować orbitali atomowych w
cząsteczce w izolacji od siebie bez uwzględnienia
ich
wzajemnego
oddziaływania,
jeżeli
takie
oddziaływanie może doprowadzić do zmniejszenia
energii wewnętrznej układu.
• przez wzajemne "wymieszanie" orbitalu s i orbitalu p
powstają
korzystniejsze
dla
tworzenia
wiązań
chemicznych,
dwa
równorzędne
orbitale
sp.
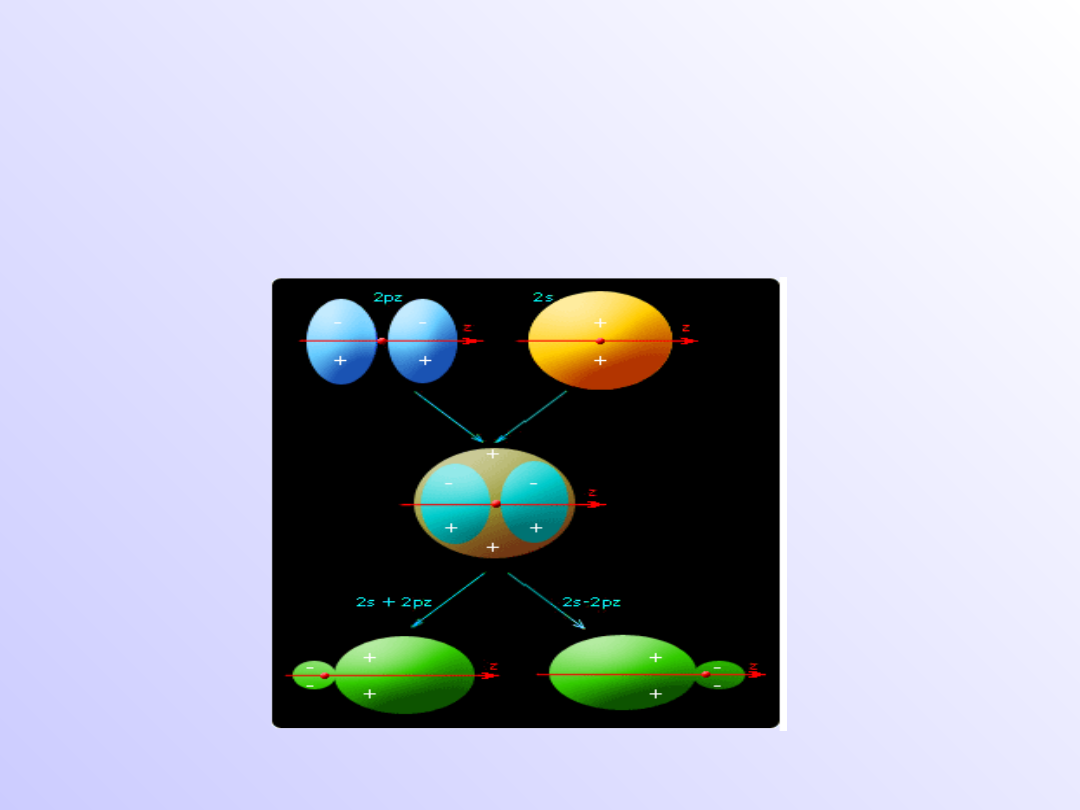
Hybrydyzacja
• Proces tworzenia takich orbitali nazywamy
hybrydyzacją, a powstałe w ten sposób
orbitale - orbitalami zhybrydyzowanymi
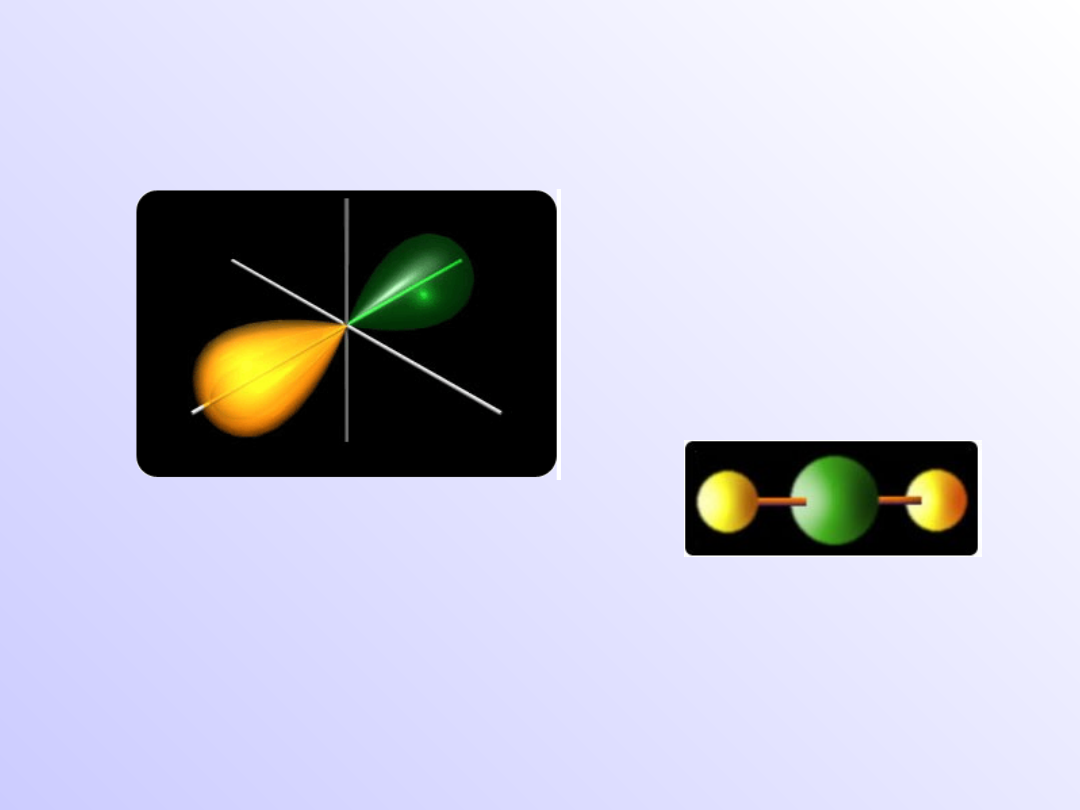
Typy orbitali zhybrydyzowanych
Hybrydyzacja sp - liniowa
Cząsteczka
BeH
2
H---Be---H
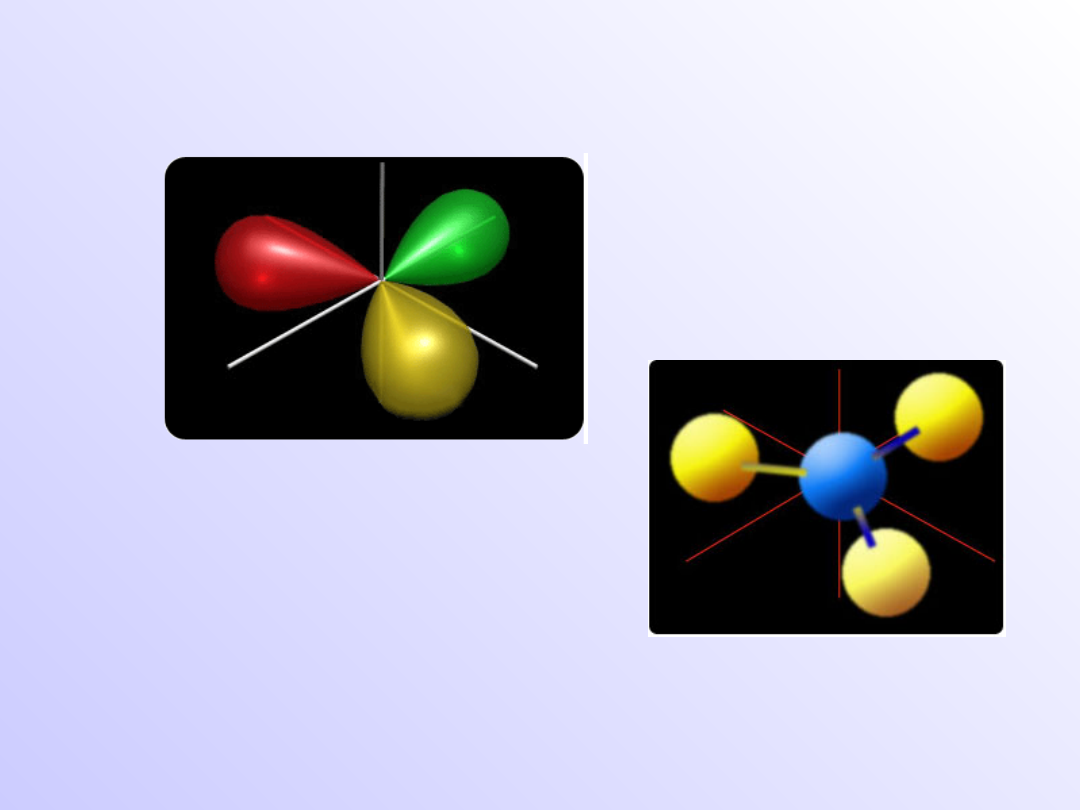
Hybrydyzacja sp
2
-
trygonalna
Cząsteczka
BF
3
Hybrydyzacja sp
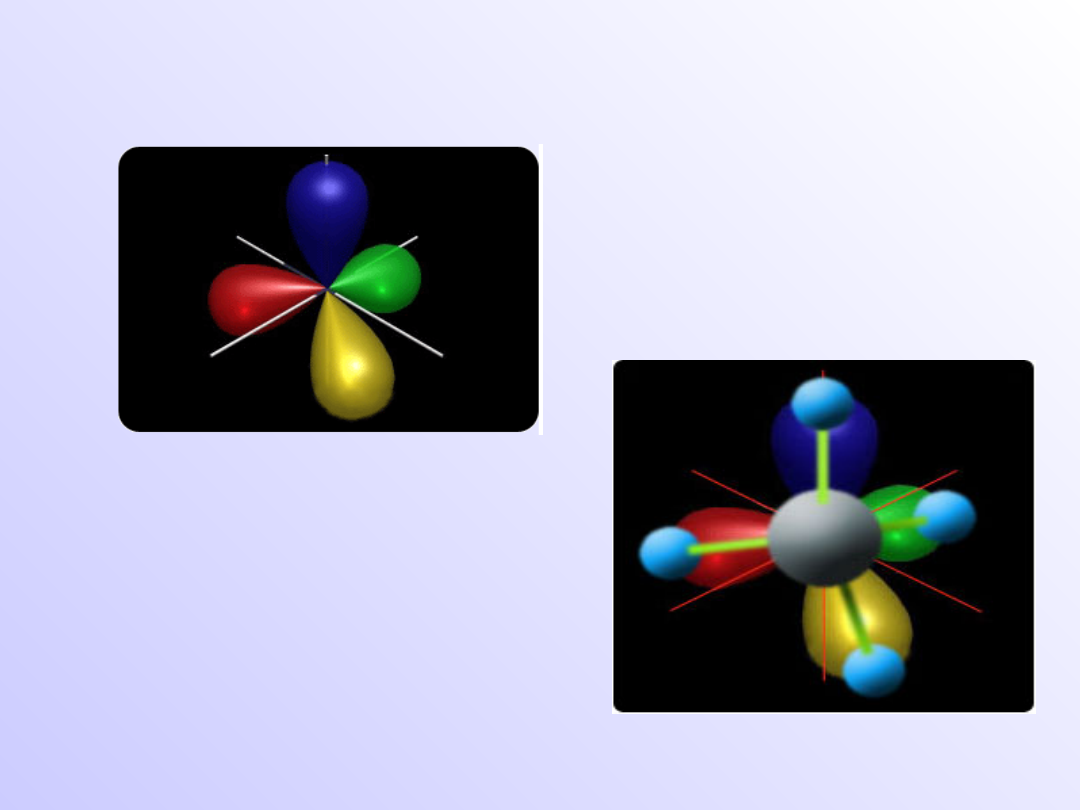
3
- tetraedryczna
Cząsteczka CH
4
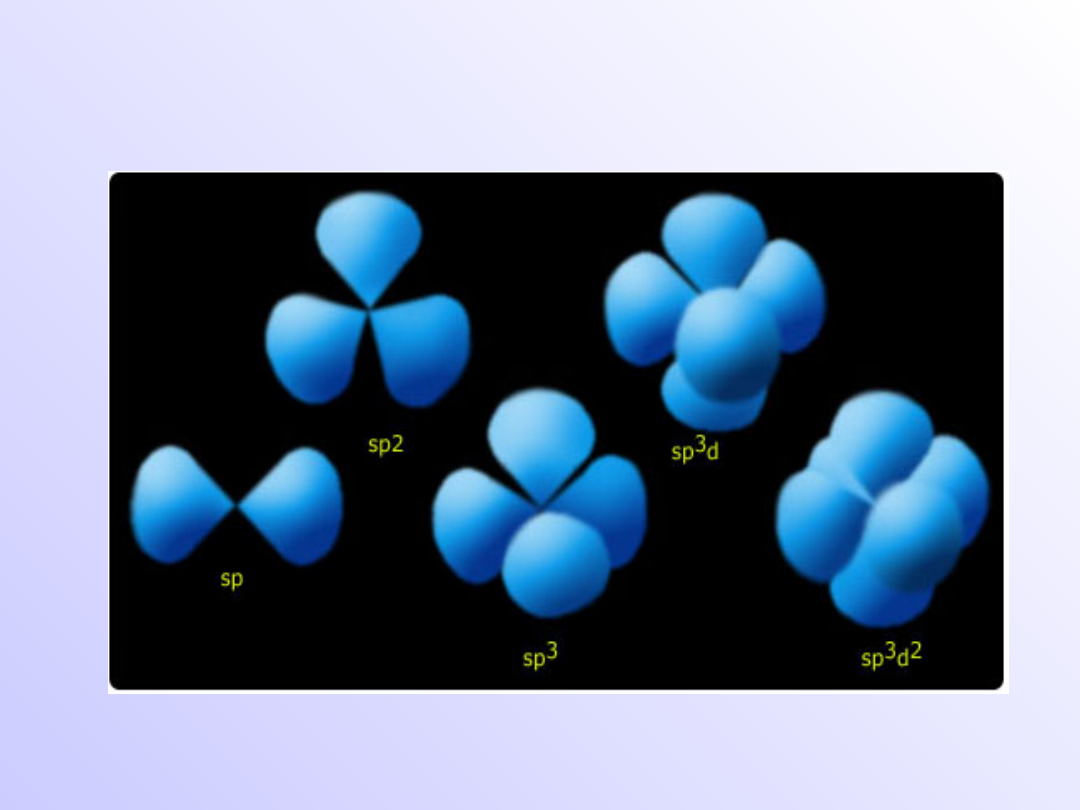
Przykłady orbitali zhybrydyzowanych

Podsumowanie
• Różnica między teorią MO a teorią VB
polega na tym, że orbital molekularny
określa obszar przestrzeni, który może ,
ale nie musi, być zajęty przez najwyżej
dwa elektrony. Orbital molekularny tworzy
się przez nałożenie orbitali atomowych, a
elektrony wprowadza się później.
• W teorii VB elektrony uczestniczą w
łączeniu się orbitali i nigdy nie myślimy o
„pustym” obszarze wiążącym

Nazwy jonów dodatnich – kationy
nazwę kationu tworzy się od nazwy
pierwiastka w dopełniaczu
• Li
+
- jon litu
• Cu
2+
- jon miedzi II
• Hg
22+
- jon dirtęci I
• H
+
- jon wodoru I lub hydron- (gdy liczba
przyłączonych cząsteczek nie jest znana lub
nieistotna)
• H
3
O
+
- jon oksoniowy lub oksonium
• NH
4+
- jon amonu lub jon amonowy,
amonium, azanium
• UO
22+
- jon uranylowy VI lub jon dioksouranu
VI

Nazwy anionów tworzy się za pomocą
końcówki „-owy” dołączonej do nazwy
grupy lub pierwiastka
• H
-
- jon wodorkowy
• OH
-
- anion
wodorotlenowy
• F
-
- jon fluorkowy
• S
2-
- jon siarczkowy
• C
4-
- jon węglikowy
• O
2-
- jon ditlenkowy(-1)
nazwa dopuszczalna-
anion ponadtlenkowy
• O
22-
- jon ditlenkowy (-2)
nazwa dopuszczalna-
anion nadtlenkowy
• O
3-
- jon tritlenkowy (-
1) nazwa
dopuszczalna anion
ozonkowy
• N
3-
- jon
triazotkowy(1-)
• NO
3-
- jon azotanowy V
• HSO
4-
- jon
wodorosiarczanowy VI
• SCN
-
- jon
tiocyjnianowy

Nazewnictwo tlenków
• Tlenki to związki o wzorze ogólnym E
n
O
m
E –jest
symbolem dowolnego pierwiastka z wyjątkiem
fluoru
• Nazwy tlenków prostych tworzy się łącząc słowo
tlenek z nazwą pierwiastka w dopełniaczu a w
nawiasie podaje się stopień utlenienia
• Cl
2
O
7
– tlenek chloru VII
• NO
2
– tlenek azotu IV
• Al
2
O
3
– tlenek glinu
• FeO – tlenek żelaza II
• Cs
2
O tlenek cezu
• Pb
2
PbO
4
tlenek diołowiu II ołowiu IV –tlenek
mieszany
• H
2
O
2
– nadtlenek wodoru

Podział tlenków
•
Kwasowe – reagujące z zasadami- w reakcji z
wodą dają kwasy
•
Zasadowe- reagujące z kwasami – w reakcji z
wodą dają zasady
•
Amfoteryczne – reagują z kwasami i
zasadami
•
Obojętne – niereagujące z kwasami,
zasadami i wodą – mogą rozpuszczać się w
wodzie na zasadzie fizycznej
rozpuszczalności
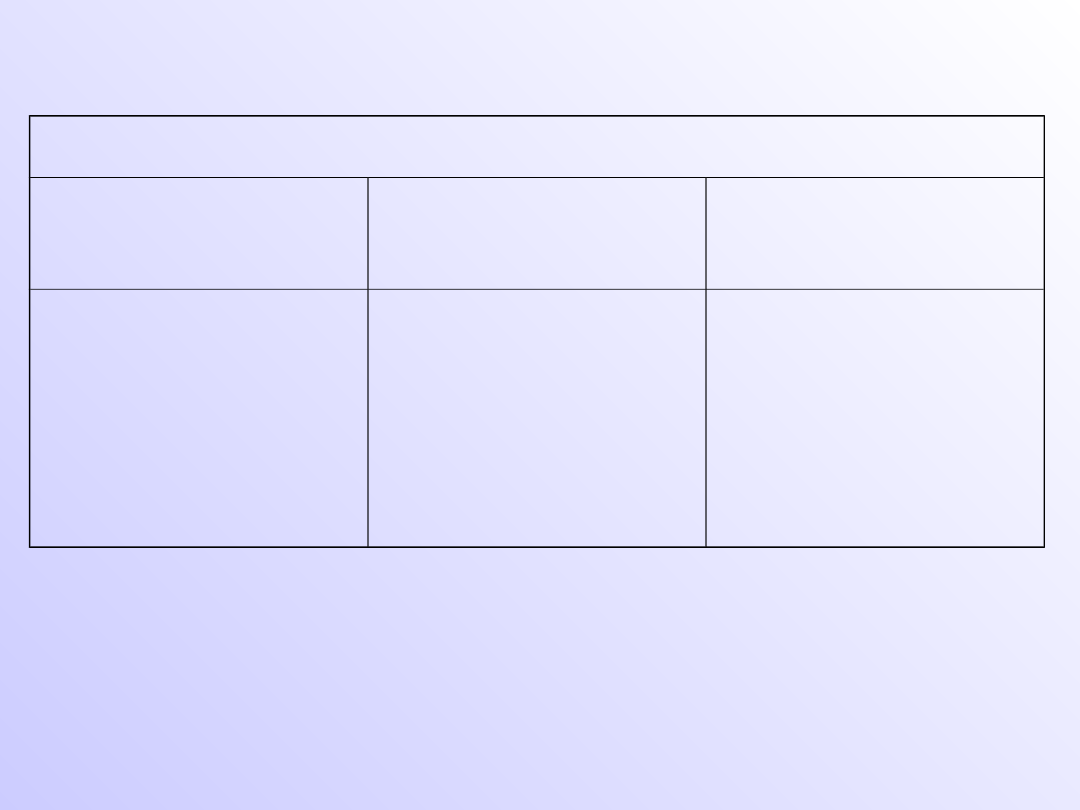
Tlenki reagujące z wodą
Tlenki
kwasowe
Tlenki
zasadowe
Tlenki
amfoteryczne
Niemetali
SO
2
, NO
2
Metali
CrO
3
, Mn
2
O
7
Metali K
2
O,
CaO
Półmetali
As
2
O
3
Metali V
2
O
5
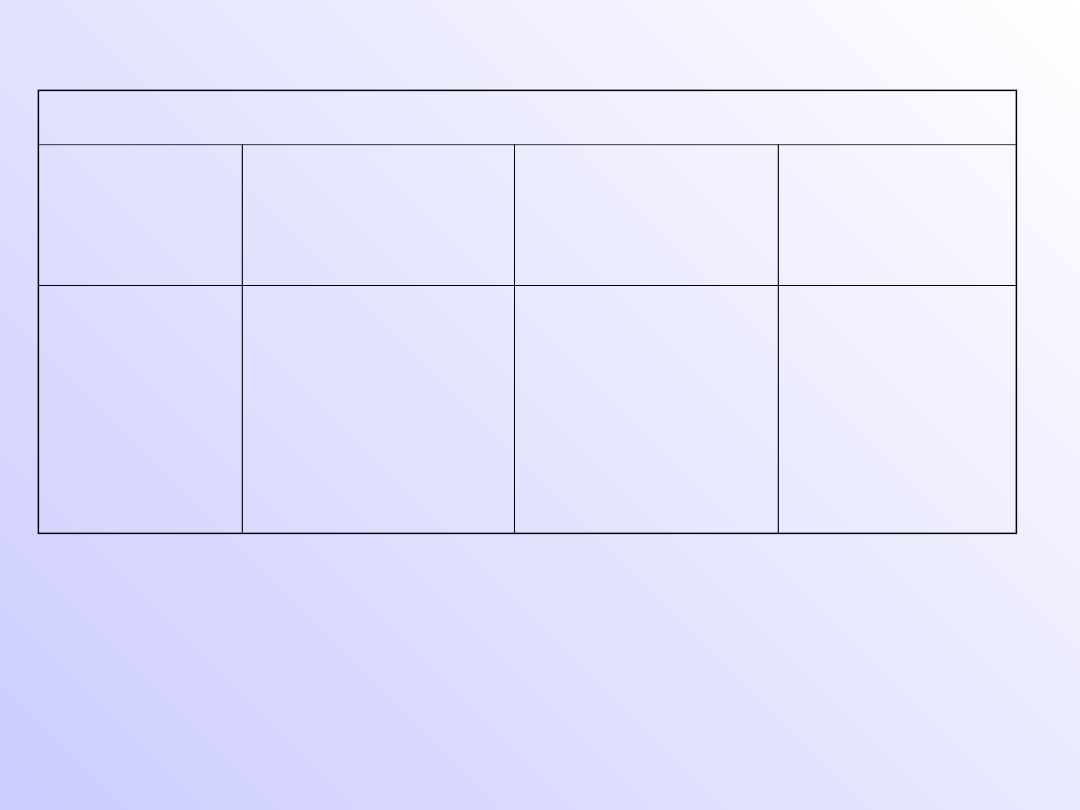
Tlenki niereagujące z wodą
Tlenki
obojętne
Tlenki o
charakterze
kwasowym
Tlenki o
charakterze
zasadowym
Tlenki
amfoterycz
ne
CO, SiO,
NO, N
2
O
Niemetali
SiO
2
Metali MoO
3
Metali NiO,
CrO
Półmetali
GeO
2
Metali
Al
2
O
3
, BeO,
ZnO
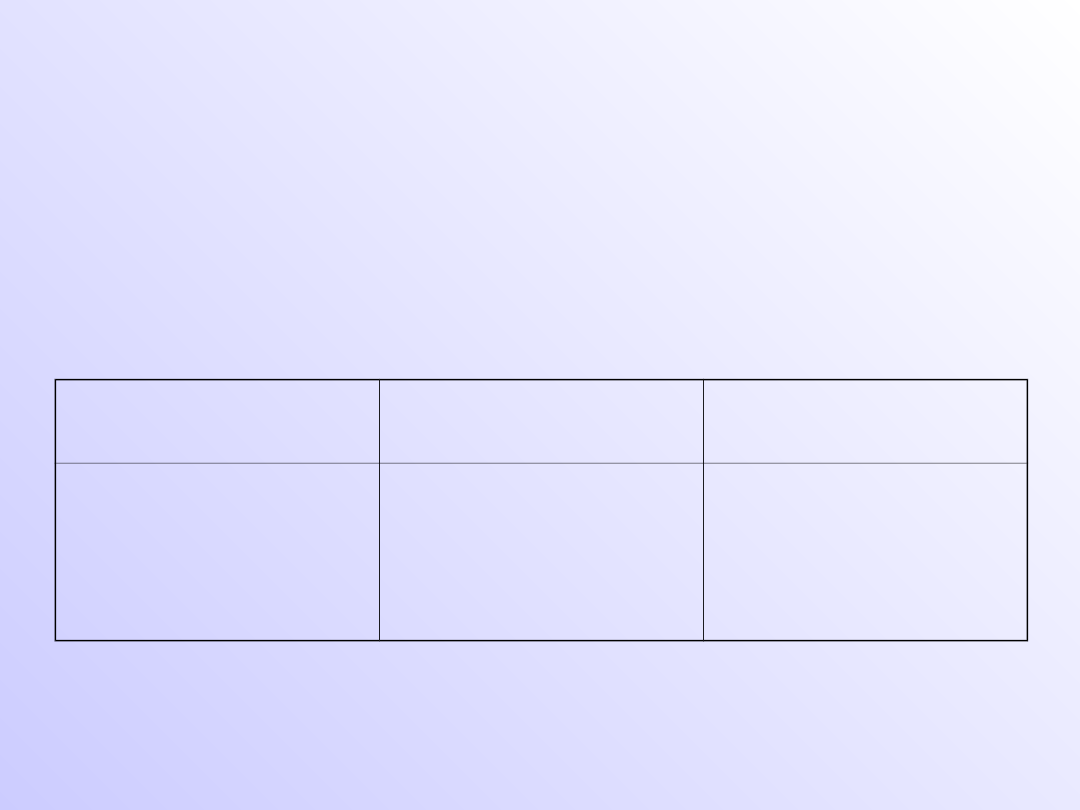
Nazewnictwo związków z
wodorem
• Związki z wodorem opisuje wzór ogólny E
n
H
m
lub H
m
E
n
. Wybór właściwego wzoru zależy od
relacji elektroujemności danego pierwiastka i
wodoru.
Wzór
Nazwa zwyczajowa
(dopuszczalna)
Nazwa
systematyczna
HF
HCl
HBr
HI
Fluorowodór
Chlorowodór
Bromowodór
jodowodór
Fluorek wodoru
Chlorek wodoru
Bromek wodoru
Jodek wodoru

Wzó
r
Nazwa zwyczajowa
(dopuszczalna)
Nazwa
systematyczna
B
2
H
6
CH
4
SiH
4
NH
3
N
2
H
4
PH
3
H
2
O
H
2
S
H
2
S
e
H
2
T
e
Diborowodór (6) lub
diboran (6)
Metan
Silan
Amoniak
Hydrazyna
Fosfina
Woda
Siarkowodór
Selenowodór
tellurowodór
Diborowodór (6) lub
diboran (6)
metan
Silan
Azan
Diazan
Fosfan
Oksydan
Sulfan
Selan
tellan

Nazewnictwo wodorotlenków
• Wzór ogólny wodorotlenków – M(OH)
n
gdzie M oznacza atom metalu
• Nazwy wodorotlenków tworzy się
łącząc słowo wodorotlenek z nazwą
pierwiastka w dopełniaczu w nawiasie
podając stopień utlenienia.
• KOH- wodorotlenek potasu
• Cu(OH)
2
– wodorotlenek miedzi II

Nazewnictwo kwasów
• Wzór ogólny kwasów H
n
R
• Kwasy beztlenowe nie zawierają w swojej
cząsteczce grupy E-O-H
• Nazwy anionów kwasów beztlenowych mają
końcówkę –owy, a nazwy soli tych kwasów –ek.
• Kwasy tlenowe- oksykwasy zawierają w swojej
cząsteczce grupę E-O-H
• Nazwy kwasów tlenowych mają końcówkę –owy,
nazwy ich anionów –anowy, a nazwy soli -an

Kwasy beztlenowe
Wzór
kwasu
Wzór
reszty
kwasow
ej
Nazwa
zwyczajowa
Nazwa
systematyczna
Nazwa
soli
HF
(aq)
HCl
(aq)
HBr
(aq)
HI
(aq)
H
2
S
(aq)
HCN
(aq
)
NH
3
HNCO
F
-
Cl
-
Br
-
I
-
S
2-
CN
-
N
3
-
NCO
-
kwas
fluorowodorowy
kwas
chlorowodorowy
kwas
bromowodorowy
kwas jodowodorowy
kwas
siarkowodorowy
kwas
cyjanowodorowy
kwas
azotowodorowy
kwas izocyjanowy
Fluorek wodoru
Chlorek wodoru
Bromek wodoru
Jodek wodoru
Siarczek
(di)wodoru
cyjanek wodoru
Azydek wodoru
kwas
izocyjanowy
Fluorek
Chlorek
Bromek
Jodek
Siarczek
cyjanek
Azydek
izocyjani
an

Kwasy tlenowe
Wzór
kwasu
Wzór
reszty
kwasowej
Nazwa w systemie
Stocka
Nazwa soli
H
3
AsO
3
H
3
AsO
4
HNO
2
HNO
3
(HBO
2
)
n
H
3
BO
3
HClO
HClO
2
HClO
3
HClO
4
AsO
3
3-
AsO
4
3-
NO
2
-
NO
3
-
BO
2
-
BO
3
3-
ClO
-
ClO
2
-
ClO
3
-
ClO
4
-
kwas arsenowy III
kwas arsenowy V
kwas azotowy III
kwas azotowy V
kwas metaborowy
kwas ortoborowy
kwas chlorowy I
kwas chlorowy III
kwas chlorowy V
kwas chlorowy VII
Arsenian
III
Arsenian
V
Azotan III
azotan V
Metabora
n
Ortobora
n
Chloran I
Chloran
III
Chloran V
Chloran
VII

Kwasy tlenowe
Wzór
kwasu
Wzór
reszty
kwasowe
j
Nazwa w systemie
Stocka
Nazwa soli
H
2
CrO
4
H
2
Cr
2
O
7
H
3
PO
3
(H
2
PHO
3
)
(HPO
3
)
n
H
3
PO
4
H
4
P
2
O
7
HIO
4
H
5
IO
6
H
4
SiO
4
(H
2
SiO
3
)
n
CrO
4
2-
Cr
2
O
7
2-
PHO
3
2-
PO
3
-
PO
4
3-
P
2
O
7
4-
IO
4
-
IO
6
5-
SiO
4
4-
SiO
3
2-
kwas chromowy VI
kwas dichromowy
VI kwas fosforowy
III
kwas
metafosforowy V
kwas
(orto)fosforowy V
kwas difosforowy V
kwas
(meta)jodowyVII
kwas ortojodowyVII
kwas
ortokrzemowy
kwas
metakrzemowy
Chromian VI
Dichromian
VI
fosforan III
metafosfora
n V
(orto)fosfora
n V
Difosforan V
(meta)jodan
VII
ortojodanVII
ortokrzemia
n
metakrzemia
n

Kwasy tlenowe
Wzór
kwasu
Wzór
reszty
kwasow
ej
Nazwa w systemie
Stocka
Nazwa soli
HMnO
4
H
2
MnO
4
H
2
SO
3
(SO
2
•H
2
O)
H
2
SO
4
H
2
S
2
O
7
H
2
S
2
O
8
H
2
S
2
O
3
H
2
CO
3
(CO
2
•H
2
O)
HOCN
MnO
4
-
MnO
4
2-
SO
3
2-
SO
4
2-
S
2
O
7
2-
S
2
O
8
2-
S
2
O
3
2-
CO
3
2-
OCN
-
kwas manganowyVII
kwas manganowy VI
kwas siarkowy IV
kwas siarkowy VI
kwas disiarkowy VI
kwas
peroksodisiarkowy VI
kwas tiosiarkowy VI
kwas węglowy
kwas cyjanowy
manganianVII
manganian VI
siarczan IV
siarczan VI
disiarczan VI
peroksodisiarcz
an VI
Tiosiarczan VI
Węglan
cyjanian

Nazwy związków jonowych
• Nazwa związku jonowego składa się z nazwy
anionu i kationu w dopełniaczu, ewentualnie
także z cyfry rzymskiej określającej ładunek jonu
(stopień utlenienia) w przypadku gdy ten ładunek
może być różny.
• CuCl
2
– chlorek miedzi II
• Pb(NO
3
)
2
– azotan V ołowiu II
• Niektóre związki jonowe tworzą kryształy
zawierające jony związku i określoną liczbę
cząsteczek wody. Związki te noszą nazwę
hydratów.
• CuSO
4
•5H
2
O – pentahtydrat siarczanu VI miedzi II

Podział soli
• Sole obojętne o wzorze ogólnym M
n
R
m
• Au
2
S – siarczek złota I
• Wodorosole powstają w wyniku niecałkowitego
zapełnienia kationów wodorowych kwasu – o wzorze
ogólnym M
n
(HR)
m
– wodorosole mogą tworzyć jedynie
kwasy wieloprotonowe
• LiH
2
PO
4
– diwodorofosforan V litu
• Ca(HCO
3
)
2
– wodorowęglan wapnia
• Hydroksysole – powstają w wyniku niecałkowitego
zastąpienia anionów wodorotlenkowych wodorotlenku
– wzór ogólny- [M(OH)
k
]
n
R
m
– hydroksysole mogą
tworzyć wodorotlenki o większej niż jeden liczbie grup
wodorotlenowych.
• FeCl(OH) – chlorek wodorotlenek żelaza II
• AlF(OH)
2
– fluorek diwodorotlenek glinu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
Wyszukiwarka
Podobne podstrony:
Chemia wykład I i II
chemia wykład 5, II rok
UZ1 - chemia - wyklady-1, II semestr, Chemia budowlana, Wykłady, Całość
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
Instrukcja do prób barwnych I (alkohole, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
pytania testowe i chemia budowlana -zestaw2(2), Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Chemia II kolo (1), CHEMIA - WYKŁADY PART 2
Chemia wykłady, koło II sem v.3.01, Izomeria optyczna
Instrukcja do zmydlania tłuszczów, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
AA Chemia Wykład, ZUT Szczecin, S II Chemia
więcej podobnych podstron