ĆWICZENIE 51
POTENCJAŁ CHEMICZNY
Wiemy, że wielkością charakteryzującą daną substancję wchodzącą w skład układu termodynamicznego jest entalpia swobodna. Jest ona wielkością ekstensywną, a zatem zależy między innymi od liczby moli tej substancji. (Niezależna od tej liczby jest inna wielkość, intensywna — molowa entalpia swobodna, odniesiona do jednego mola tej substancji).
Zmianę entalpii swobodnej substancji i wchodzącej w skład układu termodynamicznego może spowodować zmiana ilości tej substancji — np. po jej wejściu w reakcję chemiczną, przemieszczeniu się czy zmianie fazy. Jeżeli proces ten jest całkowicie odwracalny, wykonana podczas jego zachodzenia praca W jest równa zmianie entalpii swobodnej G:
![]()
Zmiana entalpii swobodnej jest proporcjonalna do zmiany liczby moli n danej substancji, czyli:
![]()
Współczynnik proporcjonalności μ nazywamy potencjałem chemicznym substancji i.
Fizyczne znaczenie tej wielkości jest następujące: potencjał chemiczny składnika układu wyraża liczbowo pracę wykonaną podczas zmiany liczby moli tego składnika o jeden, przy zachowaniu temperatury, ciśnienia oraz ilości innych składników wchodzących w skład układu. Wykonywaną pracę nazywamy pracą chemiczną lub pracą osmotyczną; odpowiednia jest również nazwa „praca transportu”.
Potencjał chemiczny danego składnika w roztworze doskonałym (takim, w którym nie występują oddziaływania międzycząsteczkowe — w przybliżeniu spełniają ten warunek roztwory bardzo rozcieńczone) dany jest wzorem:
![]()
gdzie μ0 oznacza potencjał chemiczny składnika w stanie czystym
T — temperaturę,
a xi — ułamek molowy tego składnika w badanym roztworze.
Ułamek molowy substancji w badanym układzie dany jest wzorem:
![]()
gdzie ni oznacza liczbę moli danej substancji,
a n — łączną liczbę moli wszystkich substancji w tym układzie.
Potencjał chemiczny odgrywa kluczową rolę przy ocenie stanu układu pod względem możliwości wystąpienia w nim transportu materii. Jeżeli w układzie istnieją różnice (gradienty) potencjałów chemicznych, wtedy zachodzą w nim procesy fizyczne lub chemiczne, związane z transportem substancji i zmieniające stan układu (substancja transportowana jest od potencjałów chemicznych wyższych do niższych, aż do wyrównania się potencjałów i osiągnięcia stanu równowagi). Przykładami takich zjawisk są dyfuzja i osmoza.
POTENCJAŁ ELEKTROCHEMICZNY
Jeżeli układ zawiera cząsteczki mające ładunek elektryczny (elektrolity, koloidy), to zmiana liczby moli któregoś ze składników może się wiązać z wykonywaniem pracy nie tylko chemicznej, ale także elektrycznej. Zmiana entalpii swobodnej składnika i przy zmianie jego ilości o n moli wyraża się zależnością:
![]()
czyli:
![]()
gdzie μi oznacza potencjał chemiczny składnika
φ — potencjał elektryczny;
w — liczbę ładunków elementarnych związanych z cząsteczką (wartościowość jonu),
a F — stałą Faradaya.
Pierwsza z tych czterech wielkości opisuje wartość pracy chemicznej, pozostałe trzy wiążą się z pracą elektryczną.
Zmiana entalpii swobodnej na 1 mol substancji wynosi zatem:
![]()
Jest ona nazywana potencjałem elektrochemicznym i w układzie zawierającym ładunki elektryczne odgrywa tę samą rolę, co potencjał chemiczny w układzie bez ładunków elektrycznych.
POTENCJAŁ ELEKTRODOWY
Gdy zanurzamy metal w roztworze elektrolitu zawierającym kationy tego metalu, zachodzi reakcja:
![]()
Atomy metali, pozostawiając elektrony walencyjne, przechodzą do roztworu w postaci jonów. Na granicy metalu i roztworu tworzy się podwójna warstwa ładunków elektrycznych przeciwnego znaku. Dodatki ładunek elektrolitu hamuje dalszy dopływ kationów z metalu. Przy określonej różnicy potencjałów między metalem a elektrolitem powstaje zatem stan równowagi dynamicznej (reakcja przebiega z jednakową szybkością w obie strony, a proces można uznać za odwracalny).
W tych warunkach różnica potencjałów między metalem a elektrolitem, ![]()
, zwana potencjałem elektrodowym ∆V danego metalu, wyraża się wzorem Nernsta:
![]()
gdzie cj oznacza stężenie jonów metalu w elektrolicie,
a ∆V0 — potencjał standardowy danego metalu (elektrody), równy różnicy potencjałów między metalem a elektrolitem przy jednostkowym stężeniu jonów w elektrolicie.
Jednostką potencjału elektrodowego (w tym potencjału standardowego) jest 1 wolt (1 V).
OGNIWA STĘŻENIOWE BEZ PRZENOSZENIA
Jeżeli dwie elektrody z tego samego metalu, zanurzone w roztworach soli tych metali o różnym stężeniu, połączymy kluczem elektrolitycznym, a następnie zamkniemy je obwodem elektrycznym, otrzymamy ogniwo zwane ogniwem stężeniowym bez przenoszenia (obecność klucza elektrolitycznego zapobiega mieszaniu się roztworów i przepływowi jonów).
W ogniwie takim przepływ prądu będzie powodowała różnica potencjałów elektrodowych połączonych ze sobą metali. Siłę elektromotoryczną takiego ogniwa wyraża się wzorem Nernsta:
![]()
POTENCJAŁ DYFUZYJNY. RUCHLIWOŚĆ JONÓW.
Na granicy zetknięcia roztworów elektrolitów o różnych stężeniach tworzy się różnica potencjałów elektrycznych ∆V = φ1 - φ2, zwana potencjałem dyfuzyjnym. Jest ona wynikiem różnych szybkości dyfundujących jonów dodatnich i ujemnych.
Rozpatrzmy zjawisko tworzenia się potencjału dyfuzyjnego, powstającego na granicy dwóch roztworów AgNO3 o różnych stężeniach. Bodziec w postaci różnicy potencjałów chemicznych (różnicy stężeń) uruchamia przepływ dyfuzyjny jonów. Jony NO3- poruszają się z prędkością większą niż jony Ag+, wyprzedzają je więc i powodują wzrost ładunku ujemnego w obszarze roztworu o mniejszym stężeniu. Na granicy elektrolitów tworzy się więc warstwa ładunków przeciwnego znaku.
Warstwa ładunku ujemnego hamuje dalszy przepływ jonów ujemnych NO3-, a przyspiesza jony dodatnie Ag+, tak że przy określonej różnicy potencjałów ∆V = φ1 - φ2 szybkości obydwu rodzajów jonów zrównują się. Odpowiada to stanowi równowagi dynamicznej — dyfuzja zachodzi w dalszym ciągu, czynne są jednak dwa przeciwstawne bodźce: różnica potencjałów chemicznych ∆μ i potencjałów elektrycznych ∆V. Tę właśnie różnicę potencjałów określa się mianem potencjału dyfuzyjnego.
Po osiągnięciu wartości potencjału dyfuzyjnego na granicy elektrolitów ustala się stan stacjonarny, wyrażający się wzorem Hendersona:
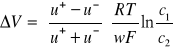
Wielkości u+ i u-, występujące w powyższym wzorze, oznaczają ruchliwości jonów dodatnich i ujemnych.
Ruchliwość jonu definiuje się jako stosunek prędkości v unoszenia jonu w kierunku pola elektrycznego, w którym jon się porusza, do wartości natężenia tego pola E:
![]()
![]()
Ruchliwość jonu charakteryzuje własności jonu lepiej od jego prędkości, jest bowiem niezależna od wartości natężenia pola (innymi słowy równa się liczbowo prędkości jonu w polu o natężeniu jednostkowym).
OGNIWA STĘŻENIOWE Z PRZENOSZENIEM
Ogniwa stężeniowe z przenoszeniem powstają wtedy, gdy między dwoma roztworami soli danego metalu o różnych stężeniach istnieje możliwość transportu jonów zgodnie z mechanizmem opisanym powyżej. Do siły elektromotorycznej takiego ogniwa, wynikającej z różnicy potencjałów elektrodowych, należy wówczas dodać lub odjąć (zależnie od jego znaku) wartość potencjału dyfuzyjnego.
PRZEWODNOŚĆ ELEKTRYCZNA. PRZEWODNOŚĆ WŁAŚCIWA.
Przewodność elektryczną danego układu (substancji) definiujemy jako odwrotność oporu elektrycznego R tego układu. Jest ona związana z wielkością układu, a jednostką jej jest ![]()
Wygodniejszą nieco wielkością jest niezależna od parametrów ekstensywnych układu przewodność elektryczną właściwą (konduktywność). Opisujemy ją jako odwrotność oporu właściwego ρ badanego układu lub substancji:
![]()
![]()
Jeżeli mówimy o przewodności układu złożonego z większej liczby składników, w tym składników jonowych (przykładem takiego układu może być cytoplazma żywej komórki), konduktywność możemy opisać wzorem:
![]()
gdzie ni oznacza koncentrację,
qi — ładunek elektryczny,
a ui — ruchliwość i-tych nośników ładunku.
Wartość przewodności elektrycznej zależy zatem od rodzaju i stężenia jonów w badanym układzie a także od ich ruchliwości.
20218/L → 2374505
Wyszukiwarka
Podobne podstrony:
BLOK V A, medycyna, Biofizyka, opracowania bloków
BLOK I A, medycyna, Biofizyka, opracowania bloków
BLOK 5B, medycyna, Biofizyka, opracowania bloków
blok 5 od konca, biofizyka, biofizyka opracowania blokow
BLOK 1B, medycyna, Biofizyka, opracowania bloków
Blok 1A, biofizyka, biofizyka opracowania blokow
Blok 4B, biofizyka, biofizyka opracowania blokow
Blok 4A, biofizyka, biofizyka opracowania blokow
blok V cz1, biofizyka, biofizyka opracowania blokow
Blok 1B, biofizyka, biofizyka opracowania blokow
Blok 5A, biofizyka, biofizyka opracowania blokow
Blok 2A, biofizyka, biofizyka opracowania blokow
BLOK V AB, medycyna, Biofizyka, opracowania bloków
BLOK 1A, medycyna, Biofizyka, opracowania bloków
Blok 3A, biofizyka, biofizyka opracowania blokow
BLOK 5A2, medycyna, Biofizyka, opracowania bloków
234, Biofizyka, Opracowanie
10a 285-297, Biofizyka, Opracowanie
biofizyka opracowania
więcej podobnych podstron