Arkadiusz Kasprzyk Szczecin 15.02.2000
IMCa
ĆWICZENIA LABORATORYJNE Z CHEMII NIEORGANICZNEJ.
Temat: ROZTWORY.
Część teoretyczna:
Roztwór jest to jednolita mieszanina substancji rozpuszczanej i rozpuszczalnika.
Rozpuszczalnik występuje w przyrodzie w przewadze ilościowej w danym roztworze. Rozróżniamy trzy rodzaje rozpuszczalników:
Roztwory w stanie gazowym, których przykładem jest powietrze.
Roztwory w stanie ciekłym są to między innymi roztwór soli w wodzie, roztwór alkoholu w wodzie.
Roztwory w stanie stałym są to różne stopy metali, szkło.
Roztwory wodne zależnie od wielkości cząsteczek substancji rozpuszczonej dzielimy na: właściwe (rzeczywiste), koloidalne i zawiesiny. W roztworze właściwym średnica cząsteczek substancji rozpuszczonej jest w przybliżeniu równa średnicy cząsteczek rozpuszczalnika i wynosi od 10-8 do 10-7 cm. Wymiary te wykazują, iż w roztworze właściwym rozdrobnienie substancji rozpuszczonej dochodzi do wymiarów atomów lub cząsteczek. W roztworze koloidalnym średnica cząstek substancji rozpuszczanej jest znacznie większa od średnicy cząstek rozpuszczalnika i wynosi od 10-7 do 10-5 cm. Stwierdzono że ta sama substancja morze tworzyć zarówno roztwory właściwe jak i roztwory koloidalne w zależności od stopnia jej rozdrobnienia. Przykładem morze być NaCl (chlorek sodowy), który po rozpuszczeniu w wodzie daje roztwór właściwy, zaś rozpuszczony w rozpuszczalniku organicznym (benzenie) daje roztwór koloidalny. Jednym ze zjawisk pozwalających odróżnić roztwór koloidalny od roztworu rzeczywistego, jest tak zwane zjawisko (efekt) Tyndalla.
Rozpuszczanie jakiejkolwiek substancji jest możliwe tylko wtedy gdy oddziaływanie między substancją rozpuszczoną, a rozpuszczalnikiem jest dostatecznie silne i prowadzi do zniszczenia sieci krystalicznej.
Łączenie się cząstek fazy rozpuszczonej w większe widoczne nieraz gołym okiem zespoły nazywamy koagulacją. Przyłączanie do powierzchni międzyfazowej cząsteczek lub jonów fazy rozpuszczającej nazywamy absorpcją. Otaczanie się cząstek , których cząsteczkami rozpuszczalnika nazywamy solwatacją lub w szczególnym przypadku gdy rozpuszczalnikiem jest woda jest to hydratacja.
Jeśli rozpuszczana substancja ma budowę krystaliczną to część ciepła hydratacji zużywana jest na niszczenie sieci krystalicznej. Jeżeli przeważa ciepło hydratacji to rozpuszczalność takiej substancji maleje wraz ze wzrostem temperatury.
Podczas rozpuszczania substancji stężenie roztworu stopniowo rośnie, aż do osiągnięcia pewnej granicy - stężenia roztworu nasyconego.
Roztwór nasycony to taki roztwór, w którym wartość granicy rozpuszczalności została osiągnięta i nic więcej nie da się rozpuścić.
Roztwór nienasycony to taki, w którym nie została przekroczona krotność rozpuszczania można w nim jeszcze rozpuścić trochę substancji.
Roztwór przesycony to taki, w którym wartość rozpuszczalności została przekroczona, dodatek nawet najmniejszej cząstki substancji powoduje natychmiastową krystalizację.
Zawartość substancji w roztworze określamy poprzez stężenie procentowe lub molowe. Stężenie procentowe to stosunek masy substancji rozpuszczonej ms do masy roztworu mr wyrażamy w %.
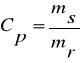
.
Stężenie molowe to stosunek ilości moli n substancji rozpuszczonej do objętości roztworu V wyrażanej w dm3:
![]()
.
Masa molowa to masa jednego mola substancji wyrażona w g/mol, jest liczbowo równa masie atomowej danej substancji.
Doświadczenia.
Wszystkie doświadczenia były wykonywane w temperaturze otoczenia.
W moździerzyku należy dokładnie rozetrzeć KCl aby przyspieszyć proces rozpuszczania, następnie wsypuje się ją do próbki dolewając 5 cm3 H2O. Trzykrotnie musieliśmy rozdrabniać KCl aby starczyło tej substancji do uzyskania roztworu nasyconego. Ilość substancji potrzebnej do uzyskania roztworu nasyconego w danej temperaturze przedstawia poniższa tabela.
W temperaturze ok. 100°C mieszaniny z nadmiarem CH3COONa (octan sodu) z H2O stał się roztworem nienasyconym. Po ostudzeniu tej samej probówki charakter roztworu nie zmienił się. Po dodaniu kilku ziaren soli w probówce wytworzyły się czyste kryształki tej soli w kształcie gwiazdek śnieżnych. W tym doświadczeniu roztwór został przesycony.
Wodorotlenek wapnia Ca(OH)2 nasycony w temperaturze pokojowej podgrzewamy do wrzenia. Wraz ze wzrostem temperatury rozpuszczalność Ca(OH)2 maleje. Są także takie substancje, w których przy wzroście temperatury ich rozpuszczalność większości substancji wzrasta. Zależność rozpuszczalności od temperatury przedstawiamy na wykresie krzywych rozpuszczalności.
Do pierwszej probówki wlewamy 5 cm3 H2O i dorzucamy 4 mikro łopatki NH4NO3 (azotanu amonowego), a do drugiej probówki 5 cm3 H2O i 4 mikro łopatki MgCl2 (chlorku magnezowego). Pierwsza probówka oziębiła się w wyniku procesu egzotermicznego zachodzącego w jej wnętrzu. Natomiast w przypadku probówki drugiej obserwujemy ogrzanie spowodowane zajściem we wnętrzu reakcji endotermicznej.
Rozpuszczalność soli w gramach na 100g H2O czyli rozpuszczalnika.
Nazwa soli |
00C |
200C |
600C |
800C |
1000C |
NaCl |
35,7 |
36 |
37,3 |
38,4 |
39,8 |
KNO3 |
13,3 |
20,9 |
85,5 |
169 |
246 |
KCl |
27,6 |
34 |
45,5 |
51,1 |
56,7 |
NH4NO3 |
118,3 |
192 |
421 |
580 |
871 |
Ca(OH)2 |
0,185 |
0,165 |
0,116 |
0,094 |
0,077 |
CH3COONa |
119 |
123,5 |
139 |
153 |
170 |
Wyszukiwarka
Podobne podstrony:
Redox, AM, CHEMIA- WICZENIA
Dysocjacja ele, AM, CHEMIA- WICZENIA
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
spr10 teoria, fizyczna, chemia fizyczna, Fizyczna, laborki
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
chemia zywnosci sciaga teoria, 2 rok, Chemia żywności, danm
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
blok 3 teoria, semestr 1, Chemia, teoria
Ściaga na chemię - teoria, AGH, chemia
kationy - wejsciowka, Ochrona Środowiska, Chemia analityczna, Laboratorium
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
teoriac, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
więcej podobnych podstron