TEORIA ATOMISTYCZNA
Demokryt z Abdery (gr. Δημόκριτος ὁ Ἀβδηρίτης Demokritos ho Abderites, ur. ok. 460 p.n.e., zm. ok. 370 p.n.e.) myśliciel i podróżnik, uczeń Leucypa, wszechstronny naukowiec, znany jako "śmiejący się filozof". Prace Demokryta, których stworzył 70, dotyczyły wielu różnych dziedzin (fizyki, astronomii, medycyny, chemii, gramatyki, techniki, logiki, strategii, muzyki itd.) nie zachowały się, przetrwały z nich nieliczne fragmenty, głównie dzięki Epikurowi i poematowi Lukrecjusza "De rerum natura"[1]. Powiedział on: Istnieją jedynie atomy i pusta przestrzeń; cała reszta to tylko poglądy
Atomizm Demokryta wywarł poprzez systemy Epikura, Lukrecjusza, atomistów średniowiecza, Galileusza i Gassendi'ego wpływ na nowożytną chemię. Był znakomitym przyrodnikiem w starożytności, a swe poglądy oparł na wyjaśnianiu zjawisk przyrodniczych na zasadzie mechanicznej konieczności. Wszystko według niego dzieje się na mocy techniki atomów, które są wieczne, rozmaite pod względem kształtu, wielkości, położenia i układu i znajdują się one w ciągłym ruchu.
JOHN DALTON
John Dalton (ur. 6 września 1766 w Cockermouth, zm. 27 lipca 1844), angielski fizyk, chemik i meteorolog. Twórca nowożytnej atomistycznej teorii materii, odkrył prawo ciśnień cząstkowych, prawo stosunków wielokrotnych, opisał wadę wzroku nazywaną później daltonizmem. Na jego cześć jednostkę masy atomowej nazwano daltonem (Da).
Materia złożona jest z niewidzialnych atomów
Wszystkie atomy jednego pierwiastka mają identyczną masę i inne właściwości
Każdy pierwiastek zbudowany jest z niepowtarzalnych atomów, różniących się od innych masą
Atomy są niezniszczalne i nie podlegają przemianom podczas reakcji chemicznych, zmienia się tylko ich wzajemne ułożenie i powiązanie
Cząsteczka związku chemicznego składa się ze skończonej i niewielkiej liczby atomów różnych pierwiastków
Rozłożenie cząsteczki na atomy
Atomy niektórych pierwiastków mogą tworzyć cząsteczki H2, Cl2 itp
Elementy struktury atomu
Okrycie (odkrywanie) elektronu
Promieniowanie katodowe

Thompson nazywa cząstki stanowiące promienie katodowe elektronami (elektron = bursztyn)
Wyznaczył stosunek ładunku do masy
1913 rok Milikan wyznacza ładunek elektronu 1.6022 x 10-19 C
masa elektronu 9.1095 x 10 -31 kg albo 9.1095 x 10-28 g 9.1095 x 10-25 mg
Odkrycie jądra atomu, model planetarny Rutherforda, protony
Przestrzeń pozajądrowa jądro 10-16 m, atom 10-10 m, elektron 10-20 m
cząstka alfa to jądro helu He +2
Podsumowywując wyniki prac Rutherford stwierdził, że atom składa się z jądra o rozmiarach 10-15-10-14 metra. Znajduje się w nim, cały ładunek dodatni i właściwie cała jego masa. Dookoła jądra po obszarze o rozmiarach rzędu 10-10 metra krążą lekkie elektrony. Elektrony muszą krążyć wokół jądra po orbitach, aby przyciągane przez ładunki dodatnie nie spadły na jądro. Orbity te zależne są od energii elektronów. Elektrony w atomach tego samego pierwiastka krążą po tych samych charakterystycznych dla niego orbitach - widmo optyczne atomów tego samego pierwiastka jest takie same.
Model Rutherforda miał jednak kilka poważnych niezgodności. Zgodnie z klasyczną mechaniką poruszający się dookoła jądra elektron powinien emitować falę elektromagnetyczną. Emisja taka jest związana z ucieczką pewnej energii z układu elektron-jądro. Elektron powinien poruszać się nie po okręgu lecz po spirali i ostatecznie zderzyć się z jądrem. Atom jednakże jest trwały. Inne sprzeczności dotyczyły promieniowania - miało ono być ciągłe (gdyż czas obiegu elektronu zgodnie ze stratą energii powinien się w sposób ciągły zmieniać), a linie widmowe nie powinny występować.
Nie jest to zatem model ostateczny
Co jeszcze ciekawego zauważył Rutherford w swoich doświadczeniach?
Pierwiastek Z oblicz. Z rzeczywist. Masa atomowa
Cu 29.3 29 63.5
Ag 46.3 47 108
Pt 77.4 78 195
Miejsce w układzie okresowym Mendelejewa nie masa, ale tzw. liczba porządkowa (ładunek jądra)
Moseley promieniowanie rentgenowskie 1913-1914

Co 58.9332 przed Ni 58.69
Pierwiastek to zbiór atomów (substancja o tej samej liczbie atomowej (Z)
Postulat istnienia neutronu (odkryty później w 1920)
Liczba masowa A sumaryczna liczba protonów i neutronów (nukleony)
![]()
Izotopy izobary izotony
Z-stale Z-różne A-Z stałe tzn. jądra o jednakowej ilości neutronów
A-różne A-stałe

izotopy wodoru
prot, deuter i tryt
Masa atomowa w układzie okresowym jest średnią ważona wszystkich izotopów danego pierwiastka
Jednostka masy atomowej u
liczba określająca ile razy jeden reprezentatywny atom danego pierwiastka chemicznego jest cięższy od 1/12 izotopu 12C,
Mol i masa molowa
Mol -taka liczba elementów materii równa liczbie atomów węgla 12C zawartej w 0.012 kg tego nuklidu.
Liczba Avogadro
Liczba Avogadro, stała Avogadra, NA, liczba cząstek (np. cząsteczek, atomów, jonów, elektronów) w jednym molu dowolnej substancji: NA = 6,022137·1023 mol-1, czyli nieco ponad 602 tryliardów sztuk.
Do obliczeń wystarczy 6,02·1023
u = 0.166 10-23 g
Masa molowa = Masa 1 mola atomów cząsteczek, jonów (g/mol)
Zadanie1. Chlor występujący w przyrodzie składa się z dwóch izotopów 35Cl (34.968 u) i 37Cl (36.956u) w procentach (75.53% i 24.47%). Oblicz masę atomową naturalnego chloru.

Masa molowa pierwiastka (cząsteczki) wyrażona w gramach jest równa liczbowo masie atomowej pierwiastka wyrażonej w jednostkach masy u.
He
Masa atomowa 4u
Masa atomu 4u 1,66 10-23 g/u= 6.64 10-23 g
Masa molowa 4u 1,66 10-23 g/u 6.02 1023 1/mol = 4g/mol
Ile cząsteczek H2O jest w 4 g wody ? Rzecz dotyczy liczby Avogadro
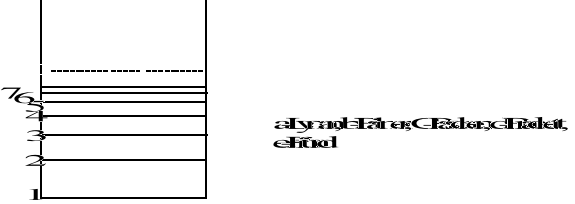
Kłopoty z spektroskopią. Linie widma wodoru.
Światło białe, pryzmat, rozszczepienie
Ciała w wysokich temperaturach
700 K światło czerwone
2000 K światło żółte (żarówka)
6000 K światło białe
Gazy podgrzane i pobudzone np. iskra elektryczna - widmo emisyjne liniowe.
Jak to wytłumaczyć?
Seria Lymana
Seria Balmera, Paschena, Bracketta, Funda
Niels Henrik David Bohr (ur. 7 października 1885 w Kopenhadze, zm. 18 listopada 1962 w Kopenhadze) fizyk duński, laureat Nagrody Nobla z dziedziny fizyki w roku 1922 za opracowanie teorii budowy (struktury) atomu.
Jego prace naukowe przyczyniły się do zrozumienia budowy atomu oraz rozwoju mechaniki kwantowej.
Urodził się w Kopenhadze jako syn Christiana Bohra, profesora fizjologii uniwersytetu w Kopenhadze i Ellen Adler, pochodzącej z bogatej żydowskiej rodziny aktywnej w duńskich kołach finansowych i politycznych. Uzyskał tytuł doktora na Uniwersytecie w Kopenhadze w 1911 roku. W Manchesterze podjął pod nadzorem Ernesta Rutherforda pracę nad teorią budowy atomu opierając się na teoriach Rutherforda. W 1913 roku opublikował pracę, w której opisał swój model budowy atomu wodoru. Oparł swój model na pewnych postulatach.
I postulat Bobra
Dla stacjonarnej orbity musi być spełniony warunek: moment pędu elektronu (mevr) może przyjmować tylko wartości będące całkowita wielokrotnością h/2.
meV = n h/2
Bohr wyliczył promień pierwszej orbity 0.53 m 10-10
i prędkość elektronu na tej orbicie 2,18 106 m/s
II postulat Bobra
W atomie wodoru dopuszczalna jest tylko taka zmiana energii elektronu dla której spełniony jest warunek
Ek - Ep = E = h v
Ek - energia elektronu znajdującego się w stanie końcowym na orbicie nk
Ep - energia elektronu znajdującego się w stanie początkowym na orbicie np.
Jeśli różnica większa od zera to kwant (hv) zostaje pochłonięty
Jeśli mniejsza to zostaje wypromieniowany
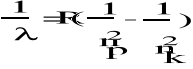
Ten wzór pozwala wyjaśnić naturę widma atomowego wodoru
Nobody is perfect
Moment pędu jest kwantowany, ale dlaczego. Dla atomów wieloelektrodowych trudno wyjaśnic ich trwałość.
Fale materii - Książe de Broglie - Dwoisty charakter elektronu
Książę Louis Victor Pierre Raymond de Broglie (ur. 15 sierpnia 1892 w Dieppe, zm. 19 marca 1987 w Louveciennes we Francji), francuski fizyk, laureat Nagrody Nobla w 1929 za odkrycie falowej natury elektronów.
De Broglie wysunął propozycje - skoro światło ma charakter falowy jak i korpuskularny, to z ruchem każdej cząstki poruszającej się z prędkością v i pędzie p związana jest fala.
p = h/
p = me v
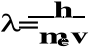
W 1927 roku Davisson i Gerber pokazali, że wiązka elektronów padając na kryształ metalu ulega dyfrakcji (podobnie promienie Roentgena). Czyli cząstka elementarna (elektron, proton, foton… może mieć właściwości korpuskularne i falowe w zaleznosci od warunkow obserwacji)
Zadanie
Oblicz długość fali de Broglie'a dla elektronu poruszającego się z prędkością 106 m/s. Masa elektronu 9,11 10-31 kg.
Wyszukiwarka
Podobne podstrony:
heisenberg, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Redox, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Regula Hunda, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
skala Paulinga, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
OSMOZA, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
wiązania, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Równanie Schroedingera, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
terzykZestaw B, I semestr, Chemia, nieorganiczna, wyklad
chemia nieorganiczna wykłady cz II
chemia nieorganiczna wykłady cz 1
Pierwiastki o liczbach atomowych 104-111, WAT chemia zaocznie, chemia nieorganiczna wyklady
Chemia- pytania na egzamin, ROK 1 Technologia żywności Kraków UR, CHEMIA NIEORGANICZNA, Wyklady, Che
chemia nieorganiczna wykład, Górnictwo i Geologia AGH, chemia
Wodor, WAT chemia zaocznie, chemia nieorganiczna wyklady
terzykZestaw A, I semestr, Chemia, nieorganiczna, wyklad
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
więcej podobnych podstron