Wiązania chemiczne i oddziaływania międzycząsteczkowe
1. Wiązania jonowe
2. Wiązania kowalencyjne (atomowe)
„czyste”
spolaryzowane
koordynacyjne
3. Wiązania metaliczne
4. Wiązania wodorowe
5. Oddziaływania międzycząsteczkowe (van der Waalsa)
siły orientacyjne (kulombowskie dipol dipol)
siły indukcyjne (dipol indukowany)
siły dyspersyjne (oscylacje w cząsteczkach)
Wiązanie jonowe]
Wiązanie jonowe powstaje między dwoma atomami, których wzajemna różnica elektroujemności jest bardzo duża (Δjedn. elektroujemn.≥1,7, no prawie zawsze). Elektrony zamiast się uwspólnić "przeskakują" na stałe do jednego z atomów. W wyniku tego jeden z atomów ma nadmiar ładunku ujemnego (anion), a drugi ma nadmiar ładunku dodatniego (kation). Oba atomy tworzą parę jonową (+)(-), która trzyma się razem na zasadzie przyciągania ładunków elektrostatycznych i może w sprzyjających warunkach ulegać dysocjacji elektrolitycznej.
Kryształ jonowy
Wiązanie kowalencyjne - wtedy, gdy atomy tworzące wiązanie maja jednakową lub zbliżoną elektroujemność. Zwróćcie uwagę na siły przyciągające i odpychające podczas tworzenia wiązania chemicznego.
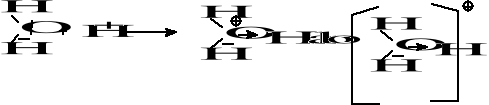
Wiązanie koordynacyjne tym różni się od wiązania atomowego lub atomowego spolaryzowanego, że para elektronowa tworzących wiązanie oddawana jest przez jeden z dwóch łączących się atomów.
Najprostszym przykładem powstawania wiązania koordynacyjnego jest tworzenie się jonu amonowego
Wiązanie metaliczne
Wiązania wodorowe
Wiązanie wodorowe - rodzaj stosunkowo słabego wiązania chemicznego polegającego głównie na przyciąganiu elektrostatycznym między atomem wodoru i atomem elektroujemnym zawierającym wolne pary elektronowe.
Wiązania wodorowe są znacznie słabsze od wiązań kowalencyjnych dzieli się je na słabe, silne i bardzo silne. Granica między słabszymi i silniejszymi wiązaniami wodorowymi jest dość umowna. Na ogół przyjmuje się, że silnie wiązanie wodorowe to takie, które posiada energię powyżej 4 kcal/mol, zaś pozostałe są słabe. Najsilniejsze znane wiązania wodorowe posiadają energię zbliżoną do słabszych wiązań kowalencyjnych - rzędu 40 kcal/mol.
cząsteczki biologiczne -białka i kwasy nukleinowe !!!!!!!!!
to na obrazie siły dyspersyjne
Siły orientacyjne

Siły indukcyjne
Wyszukiwarka
Podobne podstrony:
heisenberg, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Redox, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Regula Hunda, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
skala Paulinga, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
OSMOZA, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Równanie Schroedingera, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
teoriac, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
terzykZestaw B, I semestr, Chemia, nieorganiczna, wyklad
chemia nieorganiczna wykłady cz II
chemia nieorganiczna wykłady cz 1
Pierwiastki o liczbach atomowych 104-111, WAT chemia zaocznie, chemia nieorganiczna wyklady
Chemia- pytania na egzamin, ROK 1 Technologia żywności Kraków UR, CHEMIA NIEORGANICZNA, Wyklady, Che
chemia nieorganiczna wykład, Górnictwo i Geologia AGH, chemia
Wodor, WAT chemia zaocznie, chemia nieorganiczna wyklady
terzykZestaw A, I semestr, Chemia, nieorganiczna, wyklad
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
więcej podobnych podstron