ZWIĄZKI KOMPLEKSOWE
Dotyczy grup pobocznych w układzie okresowym.
Zapełnienie powłoki ostatniej do konfiguracji gazu szlachetnego
Wiązanie koordynacyjne (prawie atomowe spolaryzowane)
Atom centralny (jon centralny)
Ag+, Zn2+, Fe2+, Cu2+, Fe 3+
Ligandy (grupy dołączone do centrum koordynacyjnego, jony ujemne lub cząsteczki obojętne)
CN-, NH3, H2O, F-, Cl-, NO, OH-, ……
Jon centralny +ligandy =wewnętrzna strefa koordynacyjna
(istnieje też zewnętrzna, inne jony, hydratacja)
Liczba koordynacyjna
(zwykle 2,4,6)
Ag(NH3)2+, Zn(CN)42+, Fe(CN)63+
Wyznaczanie liczby kord.
Fe - 26 elektronów
Fe3+ - 23 elektrony Krypton -36 elektronów
36-23 = 13 13 : 2 = 6 (no prawie ) Fe (CN)6 3+
Cu 29 elektronów Cu2+ - 27 36-27 = 9 9:2 = 4
Inna wersja
Liczba kord. jest często podwojoną wartością ładunku kationu
Ag+ = 2, Cu2+ = 4, Fe3+ = 6 (Fe2+ też 6., 36-24 =12 12:2 = 6)
Nazwy jonów kompleksowych
[Zn(NH3)4]Cl2 dichlorek tetraaminacynku NH3 -amina
K3[Fe(CN)6] heksacyjanożelazian (III) tripotasu CN- cyjano
Fe3[Fe(CN)6]2 heksacyjanożelazian (III) żelaza (II)
Fe(CO)5 pentakarbonyl żelazo (0) CO karbonyl
Stała trwałości kompleksów ()
Cu2+ + 4 NH3 = Cu(NH3)42+
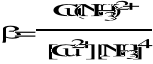
Cu(NH3)4 2+ ![]()
Cu(NH3)3 2+ + NH3 k1
Cu(NH3)3 2+ ![]()
Cu(NH3)2 2+ + NH3 k2
Cu(NH3)2 2+ ![]()
Cu(NH3)2+ + NH3 k3
Cu(NH3)2+ ![]()
Cu2+ + NH3 k4
= k1 x k2 x k2 x k3 x k4
Niektórym reakcjom towarzyszy powstawanie jonów kompleksowych
Znacie Zn(OH)42+, Fe(CN)62+, Fe(NO)x
Rozpuszczanie złota (woda królewska)
1) HNO3 utlenia złoto do Au3+
2)jony Cl- (z HCl) łączą się jonem złotowym (Au3+) dając jon chlorozłocianowy (AuCl4-)
Au + 4 HCl + 3 HNO3 → HAuCl4 + 3 NO2 + 3 H2O
Dlaczego Cu(OH)2 rozpuszcza się w nadmiarze NH4OH?
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
niebieski osad
CuSO4 + 2NH4OH → Cu(OH)2 + (NH4)2SO4 NH4OH = NH3 X H2O
Cu2+ + 4 NH3 → [Cu(NH3)4]2+
niebieski (bardzo intensywny) roztwór jon tetraaminamiedzi (II)
Jony Cu2+ wiązane są przez amoniak i przechodzą w kompleks miedziowo-amoniakalny i ich stężenie maleje i zaczyna ich być za mało do wymaganego wytracenia Cu(OH)2.
Podobnie ma się sprawa np. z Zn(OH)42+ Al.(OH)4-
---------------------------------------------------------------------------------
Barwa związku kompleksowego zależy od ilości ligandów i ich konfiguracji
[Co(NH3)6]3+ żółty
[Co(NH3)5(H2O)]3+ różowoczerwony
[Co(H2O)6]3+ purpurowy
[Cr(NH3)6] 3+ żółty
[Cr(NH3)5Cl]2+ purpurowy
[Cr(NH3)4Cl2]+ zielony
[Cr(NH3)3Cl3] fioletowy
[Cr(NH3)2Cl4]- pomarańczowoczerwony
Twardość wody
Twardość wody - jest to cecha wody, będąca funkcją stężenia soli wapnia, magnezu i innych metali, które są zdolne do tworzenia soli na wyższym niż pierwszy stopniu utlenienia.
Napięcie powierzchniowe - zdolność zwilżania-trudno w wodzie twardej prać i zmywać..
Dodatek detergentów powoduje zmniejszenie twardości wody - im woda jest twardsza, tym więcej trzeba ich dodawać, aby uzyskać skuteczny efekt mycia.
Twardość wody może być trwała i przemijająca (nietrwała)
nietrwałą, zwaną też węglanową - która jest generowana głównie przez węglany
Twardość wody tak naprawdę jest sumą obu trwałości
mydło
2 C17H35COONa +Ca2+ = (C17H35COO)Ca + 2Na+
sole wapniowe i magnezowe mydeł tworzą kłaczki (osad)
Twardość węglanowa zanika po zagotowaniu.
Ca(HCO3)2 --> CaCO3 + H2O + CO2
Mg(HCO3)2 --> MgCO3 + H2O + CO2
Powstaje kamień kotłowy (w domu raczej czajnikowy)
Należy pamiętać, że w wodzie lekko lekkokwasnej (pH<6) tworzą się z węglanów lekkokwaśne wodorowęglany
CaCO3 + CO2 + H2O = Ca(HCO3)2
Twardość trwała
MgCl2, MgSO4, Ca(NO3)2, CaSiO3 itp. itp
Mg (Ca)2+ + 2 C17H35COO- + Ca(C17H35COO)2 nierozpuszczalne kłaczki
Dodanie węglanu sodu
Na2CO3 + Ca2+ = CaCO3 + 2Na+
Dodanie amoniaku
Ca2+ + HCO3- + OH- = CaCO3 + H2O
Dodanie polifosforanów - jon Ca2+, Mg2+ związany przez polifosforany
3 MgCl2 + 2Na3PO4 = Mg3(PO4)2 + 6NaCl
Wymieniacze jonowe
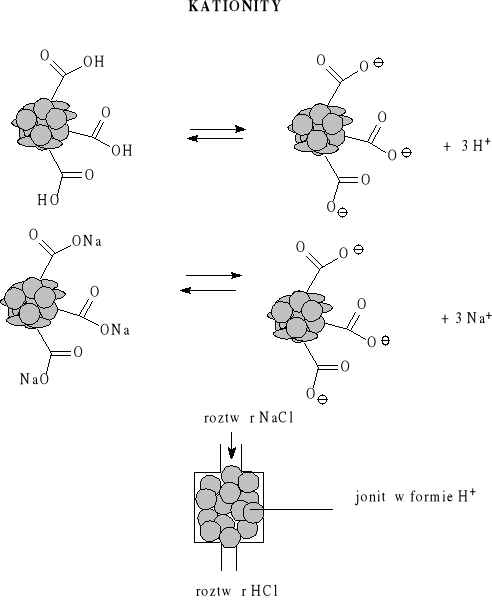
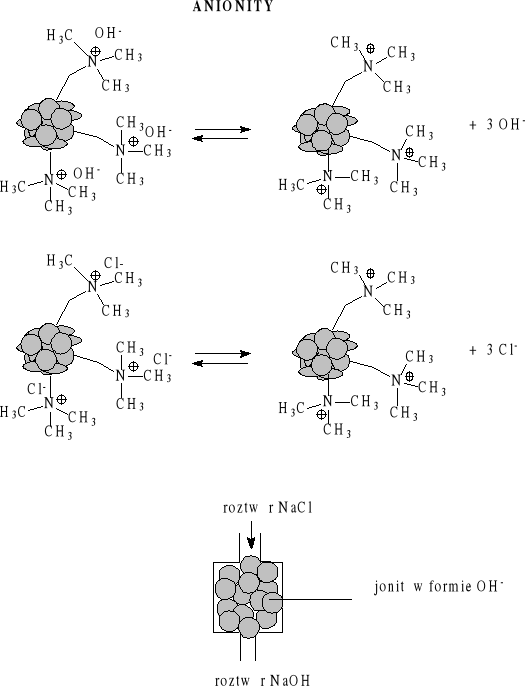
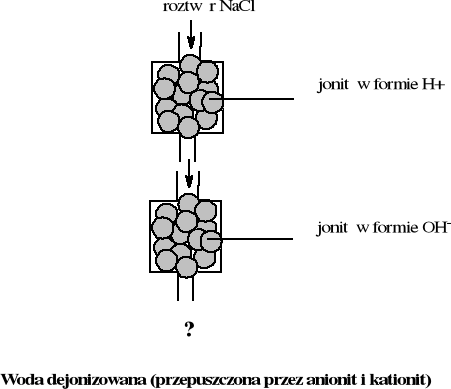
Twardość wody
- stopień niemiecki
-stopień milimolowy
- mMol na dcm3
oN - ilość jonów wapnia i magnezu, która powoduje twardość wody identyczna z twardością powstałą po rozpuszczeniu 10 mg CaO w 1 dcm3 wody
omM - połowa milimola jonów wapnia lub magnezu w 1 dcm3 (=20.04 mg Ca*lub
12,16 mg Mg2+)
stężenie molowe X 1000 ponieważ 1 mol = 1000 mmoli (tak jak 1g = 1000 mg)
mg/cm3/mmol
g/dcm3/mol
Stopień twardości |
Jakość |
|
[oN] |
[omMol] |
|
0-5 |
0-1,78 |
woda b. miękka |
5-10 |
1.78 - 3.57 |
woda miękka |
10-15 |
3.57-5.35 |
woda lekko twarda |
15-20 |
5.35-7.13 |
woda dosyć twarda |
20-30 |
7,13-10,70 |
woda twarda |
30 i powyżej |
10,70 |
woda b. twarda |
woda wodociągowa ok. 15 oN
1o mM to 0.5 mM/dcm3 1o mM to 2.8 oN 1o N to 0.357 omM
|
Zadanie 1
Wyraź stężenie wody w stopniach niemieckich, stopniach milimolowych oraz w milimolach na dcm3, jeżeli wiadomo, że na miareczkowanie 50 cm3 tej wody zużyto 10,2 cm3 roztworu EDTA o stężeniu 0.0190 mol/dcm3.
Ile moli wersenianu (EDTA) użyto w miareczkowaniu
0.0102 dcm3 x 00m/dcm3 = 0.0001919 moli
cmol = 0.0001919moli/ 0.050dcm3 = 0.003838 m/dcm3 = 3,84 mM/dcm3
patrz powyżej
1omM to 0.5 mM/dcm3
3,84 mM/dcm3
czyli 7,68 omM
1 oN to 0.357 omM
7,68 omM
czyli 21,5 oN twarda woda
Zadanie 2
Oblicz ile cm3 0.020 molowego roztworu EDTA należy zużyć ana kompleksometryczne miareczkowanie 100 cm3 wody o twardości 8 stopni milimolowych.
1 omM = 0.5 mM/dcm3
8 omM
to roztwór 4 mmol/dcm3 = 0.004 m/dcm3
w 100cm3 = 0.1 dcm3 jest zatem 0.0004 moli
obliczam objętość roztworu EDTA n = c x v
0,0004 mola = 0,020 m/dcm3 x V
V = 0.0004mola / 0.020 mol/dcm3 = 0.020 dcm3 = 20 cm3
Zadanie 3
Oblicz ile cm3 0.025 molowego roztworu EDTA należy zużyc na kompleksometryczne miareczkowanie 100 cm3 wody o twardości 15 oN.
1 oN to 0,357 omM
15 oN
to 15 oN x 0.357 omM = 5,35 omM
5,35 omM to 2,675 mmol/dcm3
w 1 dcm3 jest 2,675 mmola czyli 0,002675 mola
0,1 dcm3 0,0002675 mola
0.0002675 mola = 0,025 mol/dcm3 X V
V = 0,0107 dcm3 czyli 10,7 dcm3
Zadanie 4.
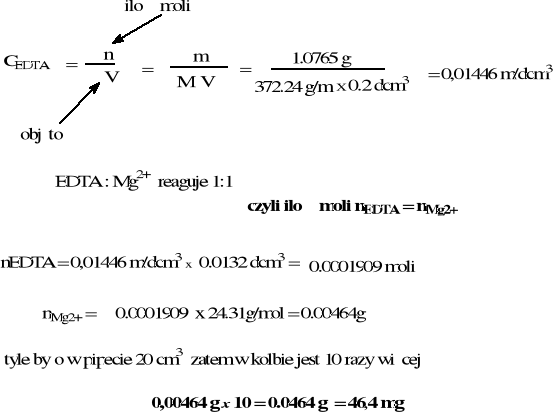
1, 0765 g EDTA rozp. w wodzie kolbie miarowej na 200 cm3. Na miareczkowanie 20.0 cm3 (jedna pipeta) roztworu MgCl2 zużyto 13.2 cm3 tego roztworu EDTA. Oblicz masę jonów Mg2+ w kolbie na 200 cm3.
EDTA (372.24 g/mol) Mg - (24.31 g mol)
stężenie molowe EDTA
9
Wyszukiwarka
Podobne podstrony:
heisenberg, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Redox, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Regula Hunda, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
skala Paulinga, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
OSMOZA, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
wiązania, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Równanie Schroedingera, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
teoriac, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
terzykZestaw B, I semestr, Chemia, nieorganiczna, wyklad
chemia nieorganiczna wykłady cz II
chemia nieorganiczna wykłady cz 1
Pierwiastki o liczbach atomowych 104-111, WAT chemia zaocznie, chemia nieorganiczna wyklady
Chemia- pytania na egzamin, ROK 1 Technologia żywności Kraków UR, CHEMIA NIEORGANICZNA, Wyklady, Che
chemia nieorganiczna wykład, Górnictwo i Geologia AGH, chemia
Wodor, WAT chemia zaocznie, chemia nieorganiczna wyklady
terzykZestaw A, I semestr, Chemia, nieorganiczna, wyklad
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
więcej podobnych podstron