Obliczenia stechiometryczne wykonywane są przy pomocy wzorów i równań; wyznaczają teoretyczne zużycie surowców, przy założeniu 100% wydajności procesu. Powstające przy tym równania przedstaw. stosunek ilościowy substancji reagujących między sobą. Niezbędna tu jest znajomość ciężarów cząsteczkowych reagentów. Przebieg reakcji : po lewej stronie zapisujemy wzory i liczby wszystkich subst. wchodzących w reakcję(substraty) a po prawej: wzory i liczby cząsteczek substancji powstałych w wyniku reakcji (produkty).
H2 + Cl2 2HCl
substraty produkt
Jedna dwuatomowa cząsteczka wodoru reaguje z jedną dwuatomową cząsteczką chloru i otrzymujemy dwie cząsteczki chlorowodoru.
Jeżeli chodzi o przedstawienie ilościowe ww relacji to zamiast mówić o cząsteczkach mówimy o molach: 1 mol cząsteczek wodoru reaguje z 1 molem cząsteczek chloru i otrzymujemy 2 mole cząsteczek chlorowodoru HCl.
Współczynnik stechiometryczny(ν) jest to współcz. liczbowy przed wzorem poszczególnych substancji w reakcji chemicznej. Współczynniki Stachom. Dla substratów poprzedzamy znakiem „-„, natomiast dla produktu znakiem „+”
Suma wszystkich wyrazów stanowiących iloczyn współczynnika stechiometrycznego (z wzgl.. znaku) jakiejś substancji oraz odpowiadającej jej masy molowej jest równa zero.
![]()
gdzie M=masa molowa
Jeżeli znamy liczby moli cząsteczek substancji reagujących ze sobą oraz jeżeli wiemy jaka jest masa jednego mola każdej z tych substancji to możemy obliczyć masy reagujących ze sobą substancji oraz masy powstających produktów.
Mol jest jednostką liczności substancji, która zawiera tyle samo atomów jonów cząsteczek ile atomów węgla zawartych jest w 12 g izotopu węgla 12C.
Mol to liczba gramów substancji odpowiadająca masie atomowej.
Mol jest jednostką np. ilości substancji i oznacza, że 1 mol substancji zawiera tyle jej np. gramów ile wynika z obliczenia jej masy cząsteczkowej.
Masa cząsteczkowa jest sumą mas atomowych wchodzących w skład cząsteczki związku chemicznego.
1 mol materii zawiera liczbę Avogadra równą 6,022 x 1023 składników.
1 mol atomów zawiera liczbę Avogadra atomów.
1 mol cząsteczek zawiera 6,022 x 1023 cząsteczek.
Np. 1 mol atomów wodoru zawiera 6,022 x 1023 atomów wodoru;
1 mol cząsteczek chloru zawiera 6,022 x 1023 cząsteczek Cl2; 1 mol żelaza zawiera 6,022 x 1023 atomów żelaza.
Objętość 1 mola gazu doskonałego w warunkach normalnych( p=101325 Pa, T=273 K) nosi nazwę objętości molowej i wynosi 22,414 dm3.
Stężenia :
Stężenie % (w % masowych) jest to liczba jednostek masowych substancji zawartych w 100 jednostkach masowych roztworu:
C%=( ms/mr ) x 100 % =ms/(ms+mrozp.) x 100%
Stężenie % objętościowe jest to liczba jednostek objętości substancji rozpuszczonej, zawartej w 100 jednostkach objętości roztworu:
C%= (Vs/Vr) x 100% = Vs/(Vs+Vrozp) x 100%
Stężenie molowe określa liczbę moli substancji rozpuszczonej, zawartej w 1 dm3 roztworu.
CM=(ns/Vr) = ms/(Ms x Vr)
w [mol/dm3]
ms - masa subst. rozpuszczonej
mr - masa roztworu
mrozp - masa rozpuszczalnika
Vs - objętość subst.rozpuszcz.
Vr - objętość roztworu
Vrozp - objętość rozpuszczaln.
ns - liczba moli subst.rozpuszczonej [mol]
Ms -masa molowa substancji rozpuszczonej [g/mol] mr = ms + mrozp.
Podział substancji ze względu na charakter chemiczny:
a) materia nieorganiczna:
-pierwiastki chemiczne
- związki chemiczne;
b) materia organiczna:
- związki chemiczne.
Podział substancji występ. w powietrzu ze względu na postać w warunkach otoczenia:
a) gazy
b) pary
c) aerozole:
- pyły
- mgły;
d) substancje smoliste.
Właściwości fiz-chem substancji chemicznych.
- temperatura topnienia
- temperatura wrzenia
- prężność pary
- rozpuszczalność w wodzie
- współczynnik podziału
n-oktanol/woda
- temperatura zapłonu
- palność substancji stałych
- palność gazów
- samozapalność ciał stałych
i cieczy
Temperatura topnienia to temperatura przy której przy normalnym ciśnieniu atmosferycznym zachodzi zmiana fazowa ze stałej na ciekłą. Określa stan, w którym substancja zmienia swoją fizyczną postać ze stałej na ciekłą. Może być miarą czystości substancji, daje nam informacje o zanieczyszczeniach. Jest ona taka sama jak temp.krzepnięcia.
Wybór metody wyznaczania temp.topnienia zależy od postaci fizycznej subst. i od tego czy subst. łatwo da się sproszkować ,trudno czy wcale. Metody wyznaczania temp.topnienia to:
a) rurka kapilarna w ciekłej kąpieli
T=t+273,15
b) rurka kapilarna w bloku metalowym.
Im niższa temp. topnienia tym większe zagrożenie
Temperatura wrzenia jest to temp. przy której prężność pary nasyconej danej cieczy równa się atmosferycznemu ciśnieniu standardowemu 101,325 kPa.
Temp.wrzenia podaje się w K.
Temp.wrzenia wyznacza się metodą Siwoloboff`a.
Ciecz badaną umieszcza się w probówce przymocowanej do termometru. W probówce umieszcza się rurkę z przewężeniem zanurzoną w cieczy. Układ stopniowo podgrzewamy. W momencie osiągnięcia temp. wrzenia ciecz gwałtownie wnika do rurki z przewężeniem-wtedy zapisujemy temp. wrzenia.
Prężność pary jest to ciśnienie pary nasyconej nad stałą lub ciekłą substancją. Jedn. jest Pascal [Pa].
Logarytm prężności pary liczymy z wzoru Clapeyron`a:
log p=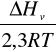
+ const
p-prężność pary w Pa
ΔHv -ciepło parowania w J mol-1
R-uniwersalna stała gazowa 8,314 J mol-1K-1
T-temperatura w K
Prężność pary jest informacją o możliwości ewent.przemian fazowych ciecz-gaz i ciało stałe-gaz. Prężność pary i rozpuszczalność w wodzie są niezbędne do obliczania lotności substancji z roztworów wodnych.
Prężność pary pomaga nam w przewidywaniu stężenia substancji w powietrzu.
Metody badania prężności pary:
- za pomocą IZOTENISKOPU:
A. Regulacja ciśnienia
B. Rurka o średnicy 8mm
C. Osuszony azot w systemie regulacji ciśnienia.
D. Pary próbki
E. Mała końcówka
F. Ciekła próbka
Metoda nie nadaje się do badania substancji wieloskładnikowych.
Bańkę z próbką ogrzewa się na małym płomieniu aż wydostające się pary próbki zajmą wystarczającą objętość przesuwając część próbki z górnej części bańki i ramienia manometru, tworząc przestrzeń wypełnioną parą, wolną od azotu. Gdy aparat zostanie napełniony, umieszcza się go w kąpieli o temperaturze regulowanej termostatem i ustala się ciśnienie azotu aż do osiągnięcia równowagi próbki. W stanie równowagi, ciśnienie azotu jest równe prężności pary substancji.
- metodą statyczną dla jedno i wieloskładnikowych substancji stałych i ciekłych w zakresie 10Pa do 105 Pa oraz od 1 do 10 Pa ale przy zachowaniu szczególnej uwagi.
Rozpuszczalność w wodzie jest to masowe stężenie nasycenia substancji w wodzie w funkcji temperatury. Podaje się ją w jednostkach masy substancji na objętość rozpuszczalnika (np. kg/m3, g/l). Substancje rozpuszczalne w wodzie łatwo przedostają się do organizmów ludzkich .
Metody pomiaru rozpuszczalności:
- metoda wymywania z kolumny,
- metoda z zastosowaniem kolby.
Współczynnik podziału (P) jest to stosunek równowagowych stężeń (ci) rozpuszczonej substancji w układzie dwufazowym składającym się z dwóch nie mieszających się rozpuszczalników. Dla wody i
n-oktanolu: Pow=
Współcz. podziału P jest wyrażany ilorazem dwóch stężeń i często przedstawia się go w postaci logarytmu dziesiętnego(log P)
Współczynnik (P) dla wody i n-oktanolu jako lipofilowego rozpuszczalnika bierze się pod uwagę przy opisywaniu zdolności transportu substancji ze środowiska wodnego do organizmów żywych.
Temperatura zapłonu jest to najniższa temperatura (przy ciśnieniu 101,325 kPa) przy której ciecz wyzwala pary, tak że w naczyńku badawczym powstaje palna mieszanina para/powietrze.
Jednostka: oC. T= t+ 273,15
t: temp. w oC T: temperatura w K.
Przy badaniach , ze względu na bezpieczeństwo stosuje się małe próbki, ok.2cm3.
Palność substancji stałych - badania przeprowadza się na substancjach w postaci proszku, granulek lub pasty.
Do substancji łatwo palnych zalicza się te, których prędkość palenia przekracza przyjętą granicę i te które w czasie palenia stwarzają wyjątkowo niebezpieczne warunki.
Czas palenia w [s].
METODY POBIERANIA PRÓBEK:
Dozymetria indywidualna:
wskaźnikiem narażenia, którego wartość nie powinna przekraczać NDS jest stężenie średnie ważone dla zmiany roboczej:
Cw=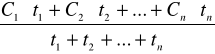
C1,C2..Cn - stężenia poszczeg.próbek [mg/m3]
t1 ,t2, tn- czas pobierania poszcz.próbek [h]
n-ilość próbek
Sposób pobierania próbek:
1. próbnik lub głowica w strefie oddychania;
2. czas pobierania próbki min.5min.
3. gdy wyniki są niższe od oznaczalności metody badawczej,w obliczeniach uwzględniamy ½ wartości stężenia które można oznaczyć;
4. gdy grupa liczy 6 na jednej zmianie to przeprowadzamy ocene narażenia dla wszystkich, jeżeli więcej niż 6 to badania przeprowadzamy dla co najmniej 6 osób;
5. w przypadku jednakowego narażenia-do badania wybieramy losowo;
6. stosując pompkę indywidualną z próbnikiem, próbki powietrza pobieramy w sposób ciągły przez co najmniej 75% czasu trwania zmiany, 1-5 próbek
7. stosując dozymetr pasywny umieszczamy go w strefie oddychania na czas co najmniej 75% zmiany roboczej
Pomiary stacjonarne:
1.pracownik na jednym stanowisku-próbki na tym stanowisku
2. grupa pracowników pracuje w tym samym pomieszczeniu, na tych samych stanowiskach-próbki w nie więcej niż 6 stanowiskach wybranych losowo;
3.pracownik obsługuje 2-3 stanowisk,-próbki pobiera się na każdym stanowisku w czasie przebywania pracownika;
4.pracownik obsługuje więcej niż 3 stanowiska lub wykonuje czynności w całym pomieszczeniu-punkty pomiarowe wybiera się losowo, w zależności od ilości osób i wielkości pomieszczenia - 1 punkt pomiarowy na 4 pracowników, jednak nie więcej niż 6 punktów w pomieszczeniu.
Ocena narażenia w pomiarach stacjonarnych:Pracownik obsługuje stale jedno stanowisko przy jednorodnym procesie technologicznym:
1. logarytm średniej geometryczn.:
n-liczba próbek
2. logarytm geometrycznego odchylenia standardowego:
3. logarytm górnej granicy (GG) przedziału ufności dla średniej z wyników pomiarów
logGG=
t-wartość parametru rozkładu Studenta dla prawdopodobieństwa 0,95 i liczby swobody n-1 (z tablic)
4. Logarytm dolnej granicy:
log DG=
5.Obliczamy wskaźniki narażenia GG i DG przez odlogarytmowanie
odpowiednio logGG i logDG .
Pracownik obsługuje stale jedno stanowisko, przy procesie technologicznym składającym się z kilku etapów:
1. Obliczamy wszystko tak jak wyżej oddzielnie dla każdego etapu procesu.
2. obliczamy wskaźniki narażenia- górną(GGw) i dolną (DGw) granicę przedziału ufności dla stężenia średniego ważonego dla całej zminy roboczej:
GGw=
DGw=
3. Obliczamy średnią ważoną średnich geometrycznych (Xgw) dla całej zmiany roboczej:
Xgw=
T1,t2tk - czas trwania poszcz.okresów pomiarowych
k-liczba okresów pomiarowych
Suma czasów okresów pomiarowych w powyższych wzorach powinna wynosić 8h (480 min).
Współczynnik łącznego narażenia:
Jeżeli pracownik lub pracownicy narażeni są w czasie zmiany roboczej na więcej niż jedną substancję o podobnym charakterze działania toksycznego to współczynnik łącznego narażenia liczony ze wzoru:
Nie powinien przekraczać jedności!
BEZPIECZNE warunki pracy:
- jeżeli Cw lub (GG lub GGw)<NDS
Cw/GG/GGw <NDS
- najwyższe stężenie chwilowe jest mniejsze od NDSCH dla danej substancji;
-żaden z wyników oznaczeń próbek nie przekracza wartości NDSP dla danej substancji;
-współczynnik łącznego narażenia<1;
Aby warunki pracy uznać za bezpieczne wszystkie wymienione wymagania muszą być spełnione jednocześnie.
SZKODLIWE warunki pracy - eli stężenie ważone (Cw) lub wskaźniki narażenia (DG lub DGw) są większe od NDS dla danej substancji, a także
-gdy współczynnik łącznego narażenia jest większy od jedności.
Cw/DG/DGw >NDS
DOPUSZCZALNE warunki pracy:
DG<NDS<GG
Najwyższe dopuszczalne stężenie (NDS)-wartość średnia ważona stężenia, którego oddziaływanie na pracownika w ciągu 8 godz. dobowego i przeciętnego tygodniowego wymiaru czasu pracy, określonego w KP, przez okres jego aktywności zawodowej nie powinno spowodować ujemnych zmian w jego stanie zdrowia oraz w stanie zdrowia jego przyszłych pokoleń.
Najwyższe dopuszczalne stężenie chwilowe (NDSCh) - wartość średnia stężenia, które nie powinno spowodować ujemnych zmian w stanie zdrowia pracownika, jeżeli występuje w środowisku pracy nie dłużej niż 15 minut i nie częściej niż 2 razy w czasie zmiany roboczej, w odstępie czasu nie krótszym niż 1 godzina.
Najwyższe dopuszczalne stężenie pułapowe (NDSP) - wartość stężenia, która ze względu na zagrożenie zdrowia lub życia pracownika nie może być w środowisku pracy przekroczona w żadnym momencie.
METODY oznaczania substancji chemicznych.
a)chromatografia gazowa z zastosowaniem detektorów:
- płomieniowo-jonizacyjnego
- wychwytu elektronów
-cieplno-przewodnościowego
-płomieniowo- fotometryczny
-fotojonizacyjny
MS (do spektrometrii mas)
b) kolorymetria
c)spektrofotometria absorpcyjna w nadfiolecie;
d)spektrofotometria absorpcyjna w świetle widzialnym;
e) spektrofotometria absorpcyjna w podczerwieni;
f) wysokosprawna chromatografia cieczowa;
g)wagowa;
h)spektrometria atomowej absorpcji.
2
Wyszukiwarka
Podobne podstrony:
zagrozenia chemiczne - sciaga (1), BHP, BHP, wszop
zagrozenia chemiczne - sciaga (2), BHP, BHP, wszop
zagrozenia chemiczne-NDS, BHP, BHP, wszop
Zagrozenia chemicze-pytania (0 termin)[1].(1), BHP, BHP, wszop
zagrozenia chemiczne-ocena narazenia, BHP, BHP, wszop
zagrozenia chemiczne-wwa w papierosach, BHP, BHP, wszop
Zagrozenia chemicze-pytania (0 termin)[1].(1), BHP, BHP, wszop
Zagrożenia czynnikami chemicznymi i pyłami, BHP, Mechanika pojazdowa
bhp sciaga (3), Technologia chemiczna, Ergonomia BHP
sciaga bhp, Technologia chemiczna, Ergonomia BHP
zagroenia chemiczne, BHP, BHP, wszop
zagrozena biol.testy, BHP, BHP, wszop
Zagroenia chemiczne- rozporz, BHP, BHP, wszop
Zagroenia chemicze-pytania[1], BHP, BHP, wszop
istan Praca z subst. chemicznie niebezpiecznymi, BHP, Instrukcje-Stanowiskowe
Zagrożenia poslizgniecia i upadki, BHP, Mechanika pojazdowa
więcej podobnych podstron