Projektowanie nowej technologii:
1.Chemiczna koncepcja metody:
-Wybranie szeregu reakcji chemicznych prowadzących od surowców do zamierzonego produktu;
-obliczenia stechiometryczne;
-obliczenia termodynamiczne;
-próby laboratoryjne;
-zestawienie chemicznej koncepcji metody
2.Technologiczna koncepcja metody wg następujących zasad:
- zasada najlepszego wykorzystania surowców;
-zasada najlepszego wykorzystania energii;
-zasada najlepszego wykorzystania aparatury.
Stechiometria zajmuje się stosunkami masowymi w jakich reagują pierwiastki i związki chemiczne oraz podstawowymi prawami dot. składu ilościowego związków chemicznych;
Prawa te to:
-Prawo zachowania masy: suma mas substancji reagujących nie ulega zmianie.
-Prawo stosunków stałych (niezmienności składu zw. chemicznych): niezależnie od sposobu otrzymywania związku chem. jego skład jakościowy i ilościowy pozostaje taki sam. Masy pierw. tworzących dany związek są w nim w stałych ściśle określonych stosunkach charakteryst. dla danego związku.
-Prawo stosunków wielokrotnych;
-Prawo stosunków objętościowych Gay-Lussaca;
Obliczenia stechiometryczne wykonywane są przy pomocy wzorów i równań; wyznaczają teoretyczne zużycie surowców, przy założeniu 100% wydajności procesu. Powstające przy tym równania przedstaw. stosunek ilościowy substancji reagujących między sobą. Niezbędna tu jest znajomość ciężarów cząsteczkowych reagentów. Przebieg reakcji : po lewej stronie zapisujemy wzory i liczby wszystkich subst. wchodzących w reakcję(substraty) a po prawej: wzory i liczby cząsteczek substancji powstałych w wyniku reakcji (produkty).
H2 + Cl2 2HCl
substraty produkt
Jedna dwuatomowa cząsteczka wodoru reaguje z jedną dwuatomową cząsteczką chloru i otrzymujemy dwie cząsteczki chlorowodoru.
Jeżeli chodzi o przedstawienie ilościowe ww relacji to zamiast mówić o cząsteczkach mówimy o molach: 1 mol cząsteczek wodoru reaguje z 1 molem cząsteczek chloru i otrzymujemy 2 mole cząsteczek chlorowodoru HCl.
Współczynnik stechiometryczny(ν) jest to współcz. liczbowy przed wzorem poszczególnych substancji w reakcji chemicznej. Współczynniki Stachom. Dla substratów poprzedzamy znakiem „-„, natomiast dla produktu znakiem „+”
Suma wszystkich wyrazów stanowiących iloczyn współczynnika stechiometrycznego (z wzgl.. znaku) jakiejś substancji oraz odpowiadającej jej masy molowej jest równa zero.
![]()
gdzie M=masa molowa
Jeżeli znamy liczby moli cząsteczek substancji reagujących ze sobą oraz jeżeli wiemy jaka jest masa jednego mola każdej z tych substancji to możemy obliczyć masy reagujących ze sobą substancji oraz masy powstających produktów.
Mol jest jednostką liczności substancji, która zawiera tyle samo atomów jonów cząsteczek ile atomów węgla zawartych jest w 12 g izotopu węgla 12C.
Mol to liczba gramów substancji odpowiadająca masie atomowej.
Mol jest jednostką np. ilości substancji i oznacza, że 1 mol substancji zawiera tyle jej np. gramów ile wynika z obliczenia jej masy cząsteczkowej.
Masa cząsteczkowa jest sumą mas atomowych wchodzących w skład cząsteczki związku chemicznego.
1 mol materii zawiera liczbę Avogadra równą 6,022 x 1023 składników.
1 mol atomów zawiera liczbę Avogadra atomów.
1 mol cząsteczek zawiera 6,022 x 1023 cząsteczek. Np.
1 mol atomów wodoru zawiera 6,022 x 1023 atomów wodoru;
1 mol cząsteczek chloru zawiera 6,022 x 1023 cząsteczek Cl2; 1 mol żelaza zawiera 6,022 x 1023 atomów żelaza.
Objętość 1 mola gazu doskonałego w warunkach normalnych( p=101325 Pa, T=273 K) nosi nazwę objętości molowej i wynosi 22,414 dm3.
Stężenia :
Stężenie % (w % masowych) jest to liczba jednostek masowych substancji zawartych w 100 jednostkach masowych roztworu:
C%=( ms/mr ) x 100 % =ms/(ms+mrozp.) x 100%
Stężenie % objętościowe jest to liczba jednostek objętości substancji rozpuszczonej, zawartej w 100 jednostkach objętości roztworu:
C%= (Vs/Vr) x 100% = Vs/(Vs+Vrozp) x 100%
Stężenie molowe określa liczbę moli substancji rozpuszczonej, zawartej w 1 dm3 roztworu.
CM=(ns/Vr) = ms/(Ms x Vr)
w [mol/dm3]
ms - masa subst. rozpuszczonej
mr - masa roztworu
mrozp - masa rozpuszczalnika
Vs - objętość subst.rozpuszcz.
Vr - objętość roztworu
Vrozp - objętość rozpuszczaln.
ns - liczba moli subst.rozpuszczonej [mol]
Ms -masa molowa substancji rozpuszczonej [g/mol]
mr = ms + mrozp.
Podstawowe pojęcia termodynamiczne:
ENTALPIA (H). Jej definicja to:
H=U+pV gdzie :
U-energia wewnętrzna układu
p-ciśnienie; V-objętość.
Oznacza to, że ciepło dostarczone do układu pod działaniem stałego ciśnienia rozdziela się na przyrost energii wewnętrznej układu i na pracę wykonaną przez ten układ (pV). Entalpia jest funcją stanu ponieważ U,p,V zależą tylko od aktualnego stanu układu.
Zmiana entalpii ΔH pomiędzy stanem końcow. i początkow., nie zależy od drogi przemiany pomiędzy nimi. ΔH =ΔU+pΔV gdzie:
ΔU-zmiana energii wewnętrznej, p - ciśnienie,
ΔV-zmiana objętości układu podczas reakcji.
ENTROPIA (S) jest funkcją stanu, tzn. zależy tylko od stanu początkowego i końcowego danej przemiany. Zmiana entropii nie zależy od sposobu przejścia między tymi stanami. Entropia pozwala określić czy dany stan jest osiągalny w procesie samorzutnym. Procesy samorzutne to takie, które nie wymagają wykonania pracy aby zachodziły. Entropia wyraża liczbę sposobów podziału energii wewnętrznej pomiędzy poszczególne cząstki układu. W procesach samorzutnych entropia układu izolowanego rośnie:
ΔScałk.>0 gdzie ΔS jest całkowitą entropią układu i jego otoczenia.
Termodynamiczną definicją entropii jest wyrażenie:
dS=![]()
gdzie:
dqodwr. = energia przekazywana jako ciepło na drodze odwracalnej; T-temperatura.
Jeżeli mamy dwa stany: początkowy (p) i końcowy (k) to otrzymamy wyrażenie:
ΔS= 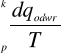
Tłumacząc to równanie: aby obliczyć różnicę entropii pomiędzy p i k, najpierw znajdujemy drogę odwracalną łączącą te stany, a następnie całkujemy ciepła dostarczone na każdym etapie drogi podzielone przez temperaturę w jakiej ono zostało dostarczone.
Przyczyny nie osiąg. 100% wydajności reakcji chem.:
-reakcja jest odwracalna i przebiega tylko do momentu osiągnięcia stanu równowagi, gdy jeszcze nie cała ilość substratów przereagowała;
- szybkość reakcji jest zbyt mała w związku z czym osiągnięcie pełnego przereagowania surowców wymagałoby długiego czasu;
-występowanie reakcji ubocznych a więc powstawanie produktów ubocznych i odpadowych;
- straty systematyczne, które zależa od przyjętej metody technologicznej;
- straty przypadkowe wynikające z niedokładności wykonania procesu, ewentualnych awarii.
Warunkiem uzyskania wysokiej wydajności procesu
(dla ogólnego zapisu reakcji:
Aa+bB+Cc+…⇔rR+sS+qQ…
jest:
- duża wartość stałej równowagi reakcji (Kp -w odniesieniu do ciśnienia; Kc- w odniesieniu do stężeń molowych; Kx - do ułamków molowych) w której biorą udział substraty A,B,C i produktu R,S,Q; a,b,c,r,s,q = ilość moli a jednocześnie współcz. stechiometryczne:
-a,-b,-c; r,s,q:
Kp=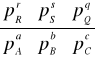
Wartość stałej równowagi możemy obliczyć gdy jest znana wartość potencjału termodynamicznego reakcji Δg
Δg=-RTlnKp
Δg=Δh-TΔS gdzie:
Δg-potencjał termodynamiczny
T-temperatura bezwzględna
R-stała gazowa
Δh-zmiana entalpii
Δs-zmiana entropii układu.
Δg= 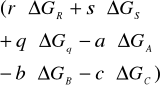
Δh= 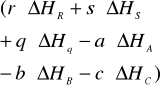
Δs=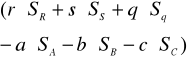
ΔG= potencjały termodynamiczne poszczególnych składników reakcji dostępne w tablicach.
ΔH=zmiana entalpii poszczególnych składników
S=entropia poszcz.składników
r,s,q,-a,-b,-c=współc.stechiom.
CEL obliczeń termodynamicznych: oprócz wstępnej oceny teoretycznej wydajności procesu, gdy występują jednocześnie reakcja główna i reakcje uboczne - określenie optymalnych (takich, w których wydajność reakcji głównej będzie jak największa) warunków przeprowadzania procesu.
Sporządza się tu wykres zależności potencjału termodynamicznego reakcji głównej i ubocznych zachodz. w procesie np. od temperatury. Wybiera się ten zakres temp. dla którego ujemna wartość potencjału termodynamicznego reakcji głównej jest najwyższa (pozostaje najdalej od temp. stanu równowagi), a dla reakcji ubocznych najmniejsza.
ZASADY TECHNOLOGICZNE są pomocne w dokonaniu wyboru najkorzystniejszego rozwiązania technologicznego:
- Zasada najlepszego wykorzystania surowców;
- Zasada najlepszego wykorzystania energii;
- Zasada najlepszego wykorzystania aparatury;
- Zasada umiaru technologicznego.
Z.NAJLEP.WYK.SUROWC.
Bardzo ważnym jest tu, przeprowadzony po badaniach w skali półtechnicznej, bilans materiałowy surowców, produktów głównych i ubocznych. Przedstawia on ilościowo jak wykorzystywane są materiały w rzeczywistych warunkach w procesie technologicznym. Dla zoptymalizowania stopnia wykorzystania materiałów stosujemy kilka technik:
-Technika przeciwprądu materiałowego stosowana jest w układach , w których występuje granica rozdziału faz. W stykających się fazach występuje składnik o różnych stężeniach. Ta różnica stężeń jest motorem do wymiany masy. Największe różnice stężeń otrzymuje się gdy fazy wymieniające masy przesuwają się w przeciwnych kierunkach. Wtedy szybkość wymiany mas jest największa. Zachodzący tu proces(technika przeciwprądu) polega na wyrównywaniu stężeń w wymijających się fazach jak również wyrównywanie się temperatur w wymijających się strumieniach.
-Max wykorzystanie produktów ubocznych: dążenie do otrzymania przydatnych produktów ubocznych i jak najmniejszej ilości odpadów;
- Indywidualne regulowanie szybkości procesów głównych i ubocznych: jeżeli obok reakcji głównej przebiegają reakcje uboczne(są tu zużywane surowce na produkty niepożądane) należy tak dobrać warunki , aby osiągnąć jak największą szybkość procesu głównego nie zwiększając przy tym szybkości procesów ubocznych.
- Regeneracja materiałów: należy tak dobrać ciąg produkcyjny aby w procesie następowała regeneracja surowca pomocniczego. Zregenerowany surowiec zawracany jest do procesu i używany do uzupełniania strat obiegu. Z regeneracji należy zrezygnować w przypadku gdy koszty regeneracji przewyższają koszt nowego surowca.
Z.NAJLEP.WYK.ENERGII: jeden z głównych czynników decydujących o opłacalności technologicznej. Wykonuje się tu bilans energetyczny, który oparty jest na obliczeniach stechiometr., termochemiczn. i termodynamiczn. z uwzględnieniem współczynnika wydajności,który określa nam stopień przereagowania substratów
Realizacja tej zasady polega na następujących technikach:
- Odzyskiwania ciepła: jeżeli w jednym miejscu procesu otrzymaliśmy materiał o wysokiej temp. który trzeba ochłodzić a w innym mamy materiał który trzeba podgrzać - wykorzystuje się ciepło materiały chłodzonego do ogrzania materiału o niższej temp. Przeprowadza się to poprzez bezpośrednie zetknięcie materiału chłodzonego z podgrzewanym lub w przeponowych wymiennikach ciepła.
- Technika przeciwprądu cieplnego
podobna do techniki przeciwprądu materiałowego. Przy przepływie (w przeciwnych kierunkach) materiałów wymieniających ciepło utrzymuje się stałą dużą różnicę temperatur między materiałem ogrzewanym i chłodzonym.
Ilość wymienionego ciepła przez jednostkę powierzchni w jednostce czasu jest wprost proporcjonalna do różnicy temperatur między fazami wymieniającymi ciepło.
2 wykresy ze str. 33
- Wielokrotne wykorzystanie ciepła w procesie: przykładem jest wyparka wielodziałowa gdzie opary z jednego działu ogrzewają przeponowo dział następny. Problemem jest spadek temperatury: ciepło odebrane z procesu jako ciepło odpadkowe jest zawarte w nośniku o temp. niższej od temp. procesu. Czynnikiem o niższej temp. nie można ogrzewać odbiornika ciepła, którego temp. jest wyższa. Tworzy się więc szereg odbiorników ciepła o coraz niższych temperaturach. Można też zastosować dodatkowy wkład energii.
Z.NAJLEP.WYK.APARATURY
Cel to wytworzenie produktu najmniejszym nakładem kosztów. W tym zawarte jest dążenie do obniżenia kosztu budowy aparatury. Aby zrealizować tę zasadę wykorzystuje się następujące techniki:
- Maksymalne oddalenie od stanu równowagi: procesy fizyczne i chemiczne przebiegają tym szybciej im stan układu jest bardziej oddalony od stanu równowagi. Szybkość przemiany chemicznej będzie tym większa im większe będzie stężenie substratów; Gdy o szybkości decyduje dyfuzja- powinno się utrzymywać duże różnice stężeń dyfundujących reagentów; Gdy o szybkości decyduje wymiana ciepła-należy utrzymywać duże różnice temperatur.
-Utrzymanie obiegu kołowego: jest stosowane w przypadku, gdy położenie stanu równowagi jest niekorzystne. Stosuje się tu przerwanie reakcji, gdy szybkość jest jeszcze duża, wprowadzenie mieszaniny reagentów z reaktora i wydzielenie produktu, następnie zawrócenie pozostałej mieszaniny substratów do reakcji.
-Utrzymanie maksymalnej temperatury: ponieważ szybkość reakcji jest tym większa im wyższa jest temperatura. Nie musimy utrzymywać wysokiej temp. gdy o sumarycznej szybkości procesu decyduje szybkość dyfuzji ponieważ szybkość dyfuzji ze wzrostem temperatury zwiększa się minimalnie.
-Maksymalne rozwinięcie powierzchni zetknięcia się faz: stosuje się wtedy gdy o sumarycznej szybkości procesu decyduje dyfuzja reagentów z jednej fazy do drugiej lub też wymiana ciepła między fazami.Ilości dyfundujących reagentów lub ilości wymienionego ciepła są proporcjonalne do wielkości powierzchni międzyfazowej przez którą odbywa się proces wymiany mas lub ciepła.(rozdrabnianie materiałów stałych przed procesem ługowania ciała stałego fazą ciekłą).
-Utrzymanie max prędkości ruchu faz względem siebie:ciało stałe (cukier) rozpuści się szybciej w wodzie gdy będziemy intensywnie mieszać zawiesinę.
-Ciągłość pracy: wynika z racjonalnej organizacji procesu.
BILANS MATERIAŁOWY: jest to zestawienie ilości wszystkich materiałów wprowadzonych do procesu oraz wszystkich otrzymanych produktów. Jest on podstawą do analizy procesu technologicznego. Wcześniej, na podst. równań stechiometrycznych (przy założeniu 100% wydajności procesu) sporządza się bilans teoretyczny. Bilans teoretyczny koryguje się przez wprowadzenie współczynników wydajności Q<1 ponieważ wydajności rzeczywiste są zawsze mniejsze od teoretycznych.
Rzeczywista wydajność procesu Wrze jest obliczana jako iloczyn wydajności teoretycznej Wteoret. obliczonej na podst. równań stechiometrycznych i współczynników wydajności:
Wrze=Wteoret. Qa Qb Qc Qs Qp
Qa - współcz.wydajn.wynikający z odwracalności reakcji obliczany metodami znanymi z termodynamiki;
Qb - współcz. wydajn. wynikający z powolności procesu,obliczany na podst.danych o kinetyce procesu;
Qc- współczynnik wydajn.związany z powstawaniem produktów ubocznych i odpadowych, obliczany na podstawie kinetyki reakcji głównej i procesów ubocznych;
Qs - straty systematyczne;
Qp - straty przypadkowe
Podział substancji ze względu na charakter chemiczny:
a) materia nieorganiczna:
-pierwiastki chemiczne
- związki chemiczne;
b)materia organiczna:
- związki chemiczne.
Podział substancji występ. w powietrzu ze względu na postać w warunkach otoczenia:
a) gazy
b) pary
c) aerozole:
- pyły
-mgły;
d) substancje smoliste.
WŁAŚCIWOŚCI FIZ.-CHEMICZNE substancji chemicznych.
- temperatura topnienia
- temperatura wrzenia
- prężność pary
- rozpuszczalność w wodzie
- współczynnik podziału
n-oktanol/woda
- temperatura zapłonu
- palność substancji stałych
- palność gazów
- samozapalność ciał stałych
i cieczy
Temperatura topnienia to temperatura przy której przy normalnym ciśnieniu atmosferycznym zachodzi zmiana fazowa ze stałej na ciekłą. Określa stan, w którym substancja zmienia swoją fizyczną postać ze stałej na ciekłą. Może być miarą czystości substancji, daje nam informacje o zanieczyszczeniach. Jest ona taka sama jak temp.krzepnięcia.
Wybór metody wyznaczania temp.topnienia zależy od postaci fizycznej subst. i od tego czy subst. łatwo da się sproszkować ,trudno czy wcale. Metody wyznaczania temp.topnienia to:
a) rurka kapilarna w ciekłej kąpieli
T=t+273,15
b) rurka kapilarna w bloku metalowym.
Im niższa temp. topnienia tym większe zagrożenie
Temperatura wrzenia jest to temp. przy której prężność pary nasyconej danej cieczy równa się atmosferycznemu ciśnieniu standardowemu 101,325 kPa.
Temp.wrzenia podaje się w K.
Temp.wrzenia wyznacza się metodą Siwoloboff`a.
Ciecz badaną umieszcza się w probówce przymocowanej do termometru. W probówce umieszcza się rurkę z przewężeniem zanurzoną w cieczy. Układ stopniowo podgrzewamy. W momencie osiągnięcia temp. wrzenia ciecz gwałtownie wnika do rurki z przewężeniem-wtedy zapisujemy temp. wrzenia.
Prężność pary jest to ciśnienie pary nasyconej nad stałą lub ciekłą substancją. Jedn. jest Pascal [Pa].
Logarytm prężności pary liczymy z wzoru Clapeyron`a:
log p=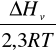
+ const
p-prężność pary w Pa
ΔHv -ciepło parowania w J mol-1
R-uniwersalna stała gazowa 8,314 J mol-1K-1
T-temperatura w K
Prężność pary jest informacją o możliwości ewent.przemian fazowych ciecz-gaz i ciało stałe-gaz. Prężność pary i rozpuszczalność w wodzie są niezbędne do obliczania lotności substancji z roztworów wodnych.
Prężność pary pomaga nam w przewidywaniu stężenia substancji w powietrzu.
Metody badania prężności pary:
- za pomocą IZOTENISKOPU:
A. Regulacja ciśnienia
B. Rurka o średnicy 8mm
C. Osuszony azot w systemie regulacji ciśnienia.
D. Pary próbki
E. Mała końcówka
F. Ciekła próbka
Metoda nie nadaje się do badania substancji wieloskładnikowych.
Bańkę z próbką ogrzewa się na małym płomieniu aż wydostające się pary próbki zajmą wystarczającą objętość przesuwając część próbki z górnej części bańki i ramienia manometru, tworząc przestrzeń wypełnioną parą, wolną od azotu. Gdy aparat zostanie napełniony, umieszcza się go w kąpieli o temperaturze regulowanej termostatem i ustala się ciśnienie azotu aż do osiągnięcia równowagi próbki. W stanie równowagi, ciśnienie azotu jest równe prężności pary substancji.
- metodą statyczną dla jedno i wieloskładnikowych substancji stałych i ciekłych w zakresie 10Pa do 105 Pa oraz od 1 do 10 Pa ale przy zachowaniu szczególnej uwagi.
Rozpuszczalność w wodzie jest to masowe stężenie nasycenia substancji w wodzie w funkcji temperatury. Podaje się ją w jednostkach masy substancji na objętość rozpuszczalnika (np. kg/m3, g/l). Substancje rozpuszczalne w wodzie łatwo przedostają się do organizmów ludzkich .
Metody pomiaru rozpuszczalności:
- metoda wymywania z kolumny,
- metoda z zastosowaniem kolby.
Współczynnik podziału (P) jest to stosunek równowagowych stężeń (ci) rozpuszczonej substancji w układzie dwufazowym składającym się z dwóch nie mieszających się rozpuszczalników. Dla wody i
n-oktanolu: Pow=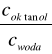
Współcz. podziału P jest wyrażany ilorazem dwóch stężeń i często przedstawia się go w postaci logarytmu dziesiętnego(log P)
Współczynnik (P) dla wody i n-oktanolu jako lipofilowego rozpuszczalnika bierze się pod uwagę przy opisywaniu zdolności transportu substancji ze środowiska wodnego do organizmów żywych.
Temperatura zapłonu jest to najniższa temperatura (przy ciśnieniu 101,325 kPa) przy której ciecz wyzwala pary, tak że w naczyńku badawczym powstaje palna mieszanina para/powietrze.
Jednostka: oC.
T= t+ 273,15
t: temp. w oC
T: temperatura w K.
Przy badaniach , ze względu na bezpieczeństwo stosuje się małe próbki, ok.2cm3.
Palność substancji stałych - badania przeprowadza się na substancjach w postaci proszku, granulek lub pasty.
Do substancji łatwo palnych zalicza się te, których prędkość palenia przekracza przyjętą granicę i te które w czasie palenia stwarzają wyjątkowo niebezpieczne warunki.
Czas palenia w [s].
Wstępne badanie skryningowe:
Badaną substancję formuje się w postaci nie przerwanej taśmy lub nasypanego proszku o dług.250mm, o szerokości 20mm i wysokości 10mm, na nie palnym podłożu, nie porowatym i o niskim przewodnictwie cieplnym. Na jednym końcu przykłada się płomień palnika gazowego aż próbka się zapali (max 2 min; dla proszku metal.5 min.) Jeżeli substancja na długości 200mm wypali się w czasie krótszym niż 4 minuty to jest to wskazaniem do prowadzenia dalszych badań; jeżeli w czasie ≥ 4 min. to substancji nie zaliczamy do łatwo palnej i nie prowadzimy dalszych badań.
Badanie szybkości spalania:
Do zapalenia ułożonej próbki używa się płomienia palnika gazowego. Gdy próbka spali się na długości 80mm to na następnych 100mm bada się prędkość spalania
Badanie powtarza się ok. 6 razy.
PALIWA są to substancje palne, których energia chemiczna podczas spalania zamienia się na ciepło.
Paliwa naturalne: węgiel kamienny, węgiel brunatny, torf, ropa naftowa, gaz ziemny;
Paliwa sztuczne: koks, półkoks, brykiety węglowe, produkty przerobu ropy naftowej, oleje smołowe, syntetyczne paliwa ciekłe, gazy generatorowe, gazy koksownicze, acetylen.
SPALANIEM nazywamy taki chemiczny proces łączenia się substancji palnej z utleniaczem, który przebiega z dużą szybkością, z wydzieleniem znacznych ilości ciepła, czemu towarzyszy płomień i gwałtowny wzrost temp. substancji reagujących. Cecha charakterystyczna spalania, która odróżnia spalanie od utleniania, to duża szybkość reakcji podczas której ciepło nie zdąży się rozproszyć.
Węgiel może być użytkowany:
a)spalanie
- ciepło, - para;
b) zgazowanie (generatory)
-smoła generatorowa
-gaz generatorowy,
-gaz wodny,
- gaz do syntezy.
c)uwodornianie:
-benzyna
-oleje napędowe
-oleje opałowe
-oleje smarowe;
d)koksownictwo: odgazowanie w
wysokich temperaturach:
-koks metalurgiczny
-smoła koksownicza
-benzol surowy,
-siarczan amonu
-gaz koksowniczy;
e)wytlewanie: odgazowanie w
niskich temperaturach:
-półkoks,
-prasmoła
- benzyna
-gaz wytlewny.
PIROLIZA - Koksowanie : jest procesem odgazowania węgla, polegającym na wygrzewaniu węgla w wysokiej temperaturze bez dostępu powietrza. Następuje tu rozkład substancji węglowych i wydzielenie z węgla części lotnych i smoły koksowniczej.
Zastosowanie koksu:
- koks wielkopiecowy: paliwo do wytworzenia ciepła, nawęglacz surówki, reduktor tlenków żelaza, zapewnia gazoprzepuszczalność materiałów wsadowych;
-koks odlewniczy: paliwo zapewniające nagrzanie, stopienie i przegrzanie ciekłego metalu;
-koks do wytopu metali nieżelaznych: do produkcji cynku, ołowiu, miedzi, niklu i kobaltu. Pełni funkcję paliwa, reduktora oraz zapewnia przewiewność wsadu;
- koksik do spiekania rud: uziarnienie poniżej 10mm, przy spalaniu koksiku uzyskuje się temp.1300-1500oC;
-koks opałowy: niska zawartość wilgoci i popiołu, niska temp. zapłonu, wysoka reakcyjność
Produktu koksowania węgla (z 1 tony węgla w %:
- koks 73%
- smoła 6 %
- benzol 2%
- gaz koksowniczy 13%
- inne 6%
Lotne produkty koks.węgla w zależności od temperatury:
-do 110oC para wodna, pył węglowy, subst.smoliste;
100-200oC = metan,ditlenek węgla, azot;
200-400oC= tlenek i ditlenek węgla, wyższe fenole;
400-550oC=smoły pierwotne, 60%metan, 20% wodór;
550-800oC=gaz z 50% wodoru, etan, etylen, acetylen, wwa, cyjanowodór, siarkowodór;
powyżej 800oC=acetylen, wodór , metan, azot, cyjanowodór.
POLIMERYZACJA jest to reakcja łączenia się cząsteczek monomeru, w której nie powstają produkty uboczne.
Polimeryzacja chlorku winylu:
H2C=CH
Cl
Polimeryzacja zachodzi poprzez rozwarcie podwójnego wiązania związku nienasyconego i połączenia się monomeru chlorku winylu w długie łańcuchy polimeru polichlorku winylu:
n H2C=CH [-CH2-CHCl-]n
Cl
Polichlorek winylu (PCW) otrzymuje się przez polimeryzację rodnikową chlorku winylu w masie, emulsji, zawiesinie lub roztworze.
Chlorek winylu otrzymuje się różnymi metodami:
- poprzez przyłączenie chlorowodoru do acetylenu:
HC≡CH+HClH2C=CH-Cl
- z etylenu i chloru:
H2C=CH2+Cl2Cl-CH2-CH2-Cl
Cl-CH2-CH2H2C=CH-Cl+HCl
-poprzez chlorowanie etylenu:
H2C=CH2+Cl2Cl-CH2-CH2-Cl
Cl-CH2-CH2-ClH2C-CH-Cl+HCl
HC≡CH+HClH2C=CHCl
W zależności od rodzaju centrów aktywnych zapoczątkowujących reakcję łańcuchową rozróżnia się polimeryzację:
a) rodnikową :
- termiczną
-fotochemiczną
-radiacyjną,
-chemiczną: nadtlenki,
wodoronadtlenki
Proces polimeryzacji;
- zwalniają regulatory,
- zahamowują inhibitory.
b) jonową.- centrami polimeryzacji są tu jony. W zależności od rodzaju katalizatorów i ładunku tworzących się jonów wyróżnia się polimeryzacją:
- kationową,
- anionową.
BILANS ZANIECZYSZCZEŃ w operacji technologicznej:
Surowce - produkty = emisja gazowa lub pyłowa do powietrza + emisja gazowa/pyłowa do środowiska pracy+odpady stałe +ścieki.
Na podstawie analizy technologii i zbilansowania zanieczyszczeń wykonuje się:
-listę potencjalnych substancji emitowanych na stanowiska pracy;
-sprawdzenie czy ustalono dla nich NDS, MDSCH i NDSP;
rozpoznanie właściwości toksycznych, działania kancerogennego i właściwości fizyko-chemicznych substancji;
-wybór substancji do pomiarów stężeń na stanowisku pracy.
METODY POBIERANIA PRÓBEK:
Dozymetria indywidualna:
wskaźnikiem narażenia, którego wartość nie powinna przekraczać NDS jest stężenie średnie ważone dla zmiany roboczej:
Cw=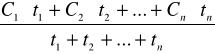
C1,C2..Cn - stężenia poszczeg.próbek [mg/m3]
t1 ,t2, tn- czas pobierania poszcz.próbek [h]
n-ilość próbek
Sposób pobierania próbek:
1.próbnik lub głowica w strefie oddychania;
2.czas pobierania próbki min.5min.
3.gdy wyniki są niższe od oznaczalności metody badawczej,w obliczeniach uwzględniamy ½ wartości stężenia które można oznaczyć;
4.gdy grupa liczy 6 na jednej zmianie to przeprowadzamy ocene narażenia dla wszystkich, jeżeli więcej niż 6 to badania przeprowadzamy dla co najmniej
6 osób;
5.w przypadku jednakowego narażenia-do badania wybieramy losowo;
6. stosując pompkę indywidualną z próbnikiem, próbki powietrza pobieramy w sposób ciągły przez co najmniej 75% czasu trwania zmiany, 1-5 próbek
7. stosując dozymetr pasywny umieszczamy go w strefie oddychania na czas co najmniej 75% zmiany roboczej
Pomiary stacjonarne:
1.pracownik na jednym stanowisku-próbki na tym stanowisku
2. grupa pracowników pracuje w tym samym pomieszczeniu, na tych samych stanowiskach-próbki w nie więcej niż 6 stanowiskach wybranych losowo;
3.pracownik obsługuje 2-3 stanowisk,-próbki pobiera się na każdym stanowisku w czasie przebywania pracownika;
4.pracownik obsługuje więcej niż 3 stanowiska lub wykonuje czynności w całym pomieszczeniu-punkty pomiarowe wybiera się losowo, w zależności od ilości osób i wielkości pomieszczenia - 1 punkt pomiarowy na 4 pracowników, jednak nie więcej niż 6 punktów w pomieszczeniu.
Ocena narażenia w pomiarach stacjonarnych:
Pracownik obsługuje stale jedno stanowisko przy jednorodnym procesie technologicznym:
1. logarytm średniej geometryczn.:
n-liczba próbek
2. logarytm geometrycznego odchylenia standardowego:
3. logarytm górnej granicy (GG) przedziału ufności dla średniej z wyników pomiarów
logGG=
t-wartość parametru rozkładu Studenta dla prawdopodobieństwa 0,95 i liczby swobody n-1 (z tablic)
4. Logarytm dolnej granicy:
log DG=
5.Obliczamy wskaźniki narażenia GG i DG przez odlogarytmowanie
odpowiednio logGG i logDG .
Pracownik obsługuje stale jedno stanowisko, przy procesie technologicznym składającym się z kilku etapów:
1. Obliczamy wszystko tak jak wyżej oddzielnie dla każdego etapu procesu.
2. obliczamy wskaźniki narażenia- górną(GGw) i dolną (DGw) granicę przedziału ufności dla stężenia średniego ważonego dla całej zminy roboczej:
GGw=
DGw=
3. Obliczamy średnią ważoną średnich geometrycznych (Xgw) dla całej zmiany roboczej:
Xgw=
T1,t2tk - czas trwania poszcz.okresów pomiarowych
k-liczba okresów pomiarowych
Suma czasów okresów pomiarowych w powyższych wzorach powinna wynosić 8h (480 min).
Współczynnik łącznego narażenia:
Jeżeli pracownik lub pracownicy narażeni są w czasie zmiany roboczej na więcej niż jedną substancję o podobnym charakterze działania toksycznego to współczynnik łącznego narażenia liczony ze wzoru:
Nie powinien przekraczać jedności!
BEZPIECZNE warunki pracy:
- jeżeli Cw lub (GG lub GGw)<NDS
Cw/GG/GGw <NDS
- najwyższe stężenie chwilowe jest mniejsze od NDSCH dla danej substancji;
-żaden z wyników oznaczeń próbek nie przekracza wartości NDSP dla danej substancji;
-współczynnik łącznego narażenia<1;
Aby warunki pracy uznać za bezpieczne wszystkie wymienione wymagania muszą być spełnione jednocześnie.
SZKODLIWE warunki pracy
- jeżeli stężenie ważone (Cw) lub wskaźniki narażenia (DG lub DGw) są większe od NDS dla danej substancji, a także
-gdy współczynnik łącznego narażenia jest większy od jedności.
Cw/DG/DGw >NDS
DOPUSZCZALNE warunki pracy:
DG<NDS<GG
Najwyższe dopuszczalne stężenie (NDS)-wartość średnia ważona stężenia, którego oddziaływanie na pracownika w ciągu 8 godz. dobowego i przeciętnego tygodniowego wymiaru czasu pracy, określonego w KP, przez okres jego aktywności zawodowej nie powinno spowodować ujemnych zmian w jego stanie zdrowia oraz w stanie zdrowia jego przyszłych pokoleń.
Najwyższe dopuszczalne stężenie chwilowe (NDSCh) - wartość średnia stężenia, które nie powinno spowodować ujemnych zmian w stanie zdrowia pracownika, jeżeli występuje w środowisku pracy nie dłużej niż 15 minut i nie częściej niż 2 razy w czasie zmiany roboczej, w odstępie czasu nie krótszym niż 1 godzina.
Najwyższe dopuszczalne stężenie pułapowe (NDSP) - wartość stężenia, która ze względu na zagrożenie zdrowia lub życia pracownika nie może być w środowisku pracy przekroczona w żadnym momencie.
METODY oznaczania substancji chemicznych.
a)chromatografia gazowa z zastosowaniem detektorów:
- płomieniowo-jonizacyjnego
- wychwytu elektronów
-cieplno-przewodnościowego
-płomieniowo- fotometryczny
-fotojonizacyjny
MS (do spektrometrii mas)
b) kolorymetria
c)spektrofotometria absorpcyjna w nadfiolecie;
d)spektrofotometria absorpcyjna w świetle widzialnym;
e) spektrofotometria absorpcyjna w podczerwieni;
f) wysokosprawna chromatografia cieczowa;
g)wagowa;
h)spektrometria atomowej absorpcji.
Metoda chromatografii gazowej
W metodzie tej składniki rozdzielanej mieszaniny dzielą się między dwie fazy, osiągając szereg następujących po sobie stanów równowagi rozpuszczania lub desorpcji, przemieszczają się w ośrodkach porowatych.
Faza nieruchoma(stały adsorbent) ma dużą powierzchnię i przez nią przepływa faza druga - ruchoma (ciecz lub gaz). W chromatografii gazowej fazą ruchomą jest gaz (zwany nośnym) - substancja ściśliwa, o niskiej lepkości i dużych wartościach współczynników dyfuzji. Analizowane składniki powinny być na tyle lotne aby mogły być przez gaz przenoszone. W chromatografii gazowej stosuje się metodę elucyjną polegającą na wprowadzeniu próbki do strumienia gazu nośnego na początku kolumny, w krótkim czasie. Rozdzielone składniki opuszczają kolumnę w strumieniu gazu nośnego. Stężenie każdej z substancji w gazie nośnym jest zawsze mniejsze niż w próbce wyjściowej.
Z chromatogramu pojedynczego składnika uzyskuje się parametry dzięki którym można obliczyć wszystkie wielkości niezbędne do interpretacji wyników.
Chromatografia gazowa służy do identyfikacji i ilościowego oznaczania składników mieszanin.
Wielkość piku na chromatografie jest proporcjonalna do ilości substancji we wprowadzonej próbce. Do oznaczania ilościowego stosuje się wysokość piku bądź jego powierzchnię.
Najważniejszymi elementami chromatografu jest kolumna i detektor. W kolumnie następuje rozdzielenie wprowadzonej mieszaniny. Detektor za pośrednictwem systemy rejestracyjnego uwidacznia skład wypływającego z kolumny gazu.
CECHY metod ANALITYCZNYCH:
1. Precyzja -stopień zgodności między niezależnymi wynikami badania, otrzymanymi w określonych warunkach.
2. Wykrywalność metody-określa najmniejsze stężenie substancji, przy którym jej obecność można wykryć jakościowo.
3. Oznaczalność -to najmniejsza wartość wielkości mierzonej, która może być efektywnie zmierzona.
4. Czułość metody -najmniejsza różnica stężeń czy zawartości substancji oznaczanej daną metodą, jaka może być z określonym prawdopodobieństwem stwierdzona.
5. Dokładność metody- stopień zgodności wyniku pomiaru z wartością rzeczywistą wielkości mierzonej.
9
Wyszukiwarka
Podobne podstrony:
zagrozenia chemiczne - sciaga (1), BHP, BHP, wszop
zagrozenia chemiczne - sciaga (3), BHP, BHP, wszop
zagrozenia chemiczne-NDS, BHP, BHP, wszop
Zagrozenia chemicze-pytania (0 termin)[1].(1), BHP, BHP, wszop
zagrozenia chemiczne-ocena narazenia, BHP, BHP, wszop
zagrozenia chemiczne-wwa w papierosach, BHP, BHP, wszop
Zagrozenia chemicze-pytania (0 termin)[1].(1), BHP, BHP, wszop
Zagrożenia czynnikami chemicznymi i pyłami, BHP, Mechanika pojazdowa
bhp sciaga (3), Technologia chemiczna, Ergonomia BHP
sciaga bhp, Technologia chemiczna, Ergonomia BHP
zagroenia chemiczne, BHP, BHP, wszop
zagrozena biol.testy, BHP, BHP, wszop
Zagroenia chemiczne- rozporz, BHP, BHP, wszop
Zagroenia chemicze-pytania[1], BHP, BHP, wszop
istan Praca z subst. chemicznie niebezpiecznymi, BHP, Instrukcje-Stanowiskowe
Zagrożenia poslizgniecia i upadki, BHP, Mechanika pojazdowa
więcej podobnych podstron