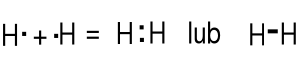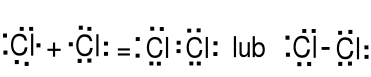WIĄZANIA CHEMICZNE
Atomy oprócz niektórych gazów szlachetnych łączą się ze sobą lub z innymi atomami. Mówimy, że istnieje między nimi wiązanie chemiczne.
Wiązanie chemiczne powstaje przede wszystkim na skutek zmian położenia elektronów walencyjnych.
Wiązanie chemiczne tworzy się gdy energia powstałej cząsteczki jest niższa niż suma energii atomów z których ta cząsteczka powstała, zatem gdy prowadzi to do uwolnienia energii.
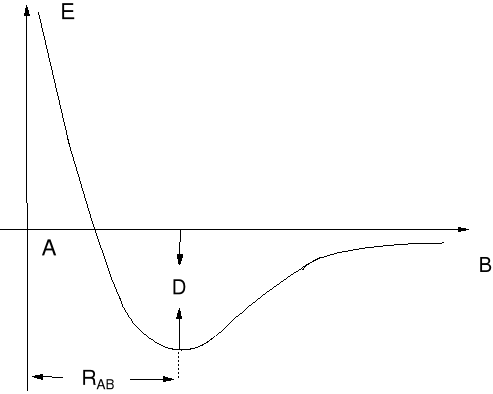
Zmiana energii układu przy tworzeniu się wiązania A—B.
RAB długość wiązania A—B (pm.)
DAB energia wiązania, energia którą trzeba zużyć do rozerwania wiązania chemicznego lub która będzie uwolniona przy powstaniu wiązania chemicznego w KJ · mol-1. |
|
Podział na rodzaje wiązań ma przede wszystkim znaczenie dydaktyczne, pozwalające na przewidywanie przebiegu reakcji i ocenę jej produktów. Podział wiązań między atomami na jonowe, kowalencyjne i metaliczne, przejścia między poszczególnymi typami wiązań są płynne.
Zasadniczo dzielimy wiązania na jonowe, kowalencyjne i metaliczne.
WIĄZANIA MIĘDZY ATOMAMI.
Wiązanie jonowe.
Wiązanie jonowe jest wynikiem przede wszystkim przyciągania się kationów i anionów. Nie ma wiązań 100 % jonowych. Zawsze jest pewien udział wiązania kowalencyjnego.
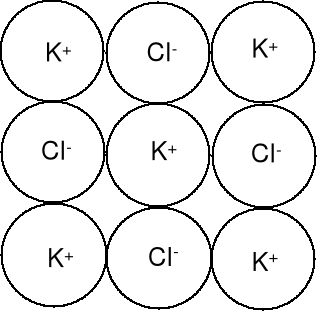
Kryształ chlorku potasu KCl.
Substancje jonowe tworzą uporządkowane struktury krystaliczne, mają wysokie temperatury topnienia (t.t.) i są kruche. Rozpuszczone we wodzie tworzą roztwory elektrolitów, stopione przewodzą prąd elektryczny. |
|
Wiązanie jonowe dobrze tłumaczy właściwości związków z bloku s (litowce i berylowce - niski potencjał jonizacji) z niemetalami bloku p (tlenowce i fluorowce - wysokie powinowactwo elektronowe). Jony mają konfiguracje elektronowe najbliższych gazów szlachetnych.
Wielkości promieni kationów i atomów (promień metaliczny), dla boru promień kowalencyjny (pojedyncze wiązanie).
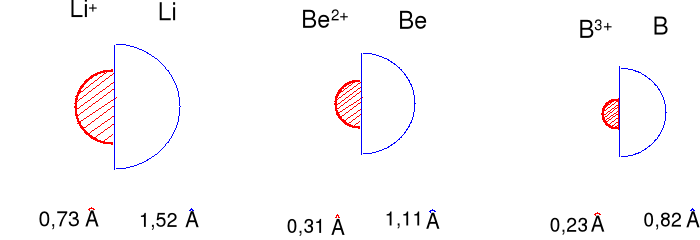
kationy są zdecydowanie mniejsze niż wyjściowe atomy, (dlaczego) ?
Wielkości promieni anionów w porównaniu do promieni atomów (promień kowalencyjny dla pojedynczego wiązania)
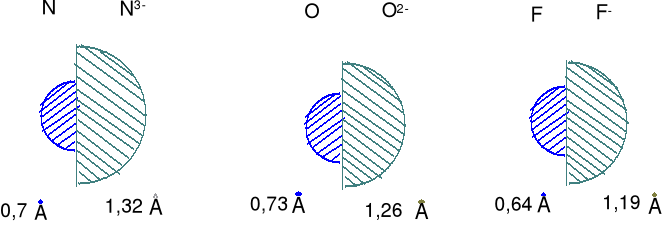
Aniony są zdecydowanie większe niż wyjściowe atomy, dlaczego ?
WZORY LEWISA ATOMÓW I JONÓW.
![]()
K 1s22s22p63s23p64s1 , jon potasu K+ 1s22s22p63s23p6, wz. L. K+
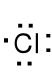
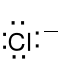
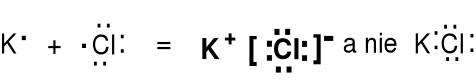
Cl 1s22s22p63s23p5 , jon chloru Cl- 1s22s22p63s23p6, wz. L.
![]()
Tl [Xe]6s24f145d106p1 = [Xe]4f145d10 6s26p1, wzór Lewisa
![]()
Tl+ [Xe]6s24f145d10 = [Xe]4f145d10 6s2, wzór Lewisa
Podaj wzór Lewisa azotku magnezu. χN (3.0) - χMg (1.3) = 1.7
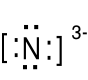
Mg: 1s22s22p63s2, jon magnezu Mg2+ 1s22s22p6, wzór Lewisa Mg2+
![]()
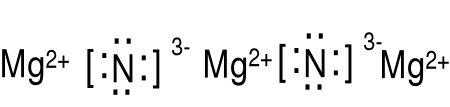
1s22s22p3, jon azotu N3- 1s22s22p6, wzór Lewisa
Wzory Lewisa metali przejściowych i kationów metali przejściowych
Fe 1s22s22p63s23p63d64s2 , jon Fe3+ 1s22s22p63s23p63d5,
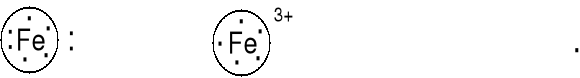
Przeważnie nie pisze się wzorów Lewisa dla metali przejściowych i ich kationów.
WIĄZANIE KOWALENCYJNE
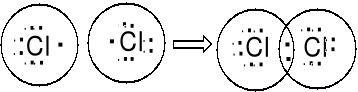
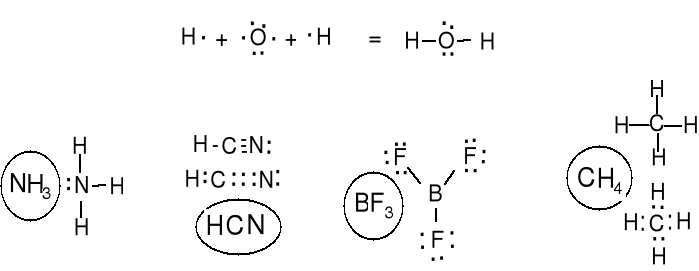
Niemetale także łączą się między sobą. H2, Cl2, S8, P4.
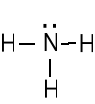
Atomy tworząc związki kowalencyjne łączą się przez uwspólnienie par elektronowych aby uzyskać konfiguracje elektronowe gazów szlachetnych. Atomy dążą do skompletowania oktetów przez uwspólnienie par elektronowych.
|
|
|
|
Wartościowość (walencyjność) jest to liczba wiązań kowalencyjnych które może stworzyć atom danego pierwiastka.
WZORY LEWISA CZĄSTECZEK KOWALENCYJNYCH
1. W cząsteczce z reguły atom najmniej elektroujemny jest atomem
centralnym
2. Atom wodoru tworzy tylko wiązania pojedyncze.
3. Terminalne fluorowce tworzą tylko wiązania pojedyncze.
4. W kwasach tlenowych atomy wodoru są połączone z atomami tlenu,
a te z kolei z atomem centralnym.
5. Najbardziej trwałe z kilku możliwych struktur są te, w których
ładunki formalne są najbardziej zbliżone do 0, gdyż to oznacza, że
niezbyt zmienił się rozkład elektronów w porównaniu do wolnych
atomów. Ładunki formalne to nie są stopnie utlenienia.
6. Atomy centralne z drugiego okresu dążą do stworzenia konfiguracji
oktetu. Nie ma rozszerzenia oktetu.
7. Dla atomów centralnych z 13 grupy układu okresowego, często
niemożliwe jest utworzenie oktetu. Powstałe związki posiadają tzw.
luki elektronowe. Są to kwasy Lewisa. Podobnie związki BeX2.
8. Atomy centralne trzeciego i dalszych okresów mogą otoczenie atomu
centralnego rozszerzać poza oktet. Orbitale d mogą brać udział w
tworzeniu wiązań chemicznych.
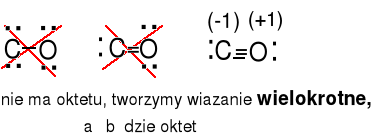
Przykłady.
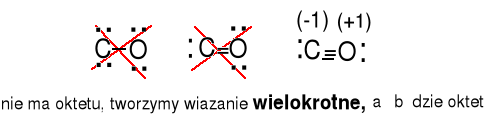
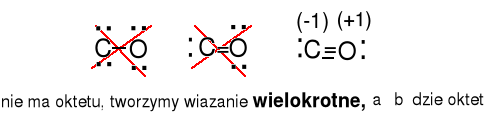
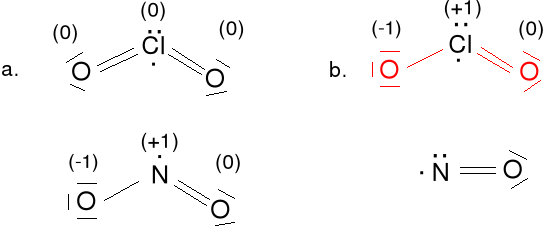
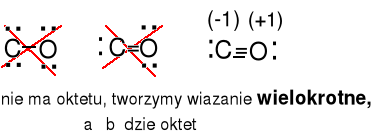
CO 4e + 6e = 10e
Ładunki formalne dla C 5e - 4e = 1e (-1) , dla O, 5e - 6e = -1e(+1)
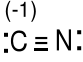
CN- 4e + 5e + 1e = 10e
Ładunki formalne dla C, 5e - 4e = 1e (-1) , dla N, 5e - 5e = 0e(0)
![]()
HCN 1e + 4e + 5e = 10e
Ładunki formalne dla C, 4e - 4e = 0e (0) , dla N, 5e - 5e = 0e(0)
dla H, 1e - 1e = 0e(0)
REZONANS, STRUKTURY REZONANSOWE
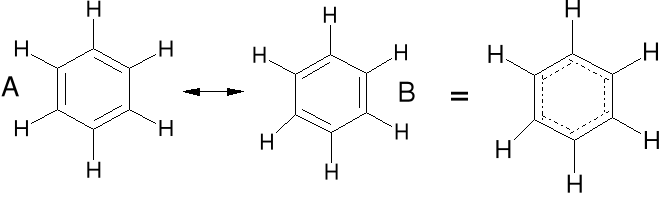
Struktury rezonansowe, są to struktury o tym samym ułożeniu atomów w cząsteczce, ale o różnym ułożeniu par elektronowych. Struktura rzeczywista (hybryda rezonansowa) jest pośrednia między strukturami rezonansowymi. Nie jest to przejście jednej struktury w drugą. Muł
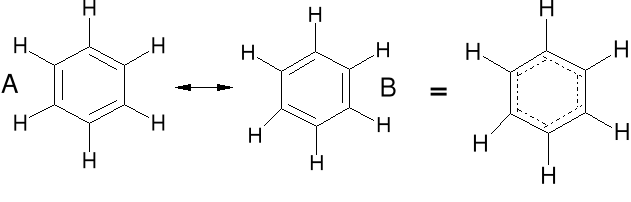
Benzen
C6H6
Benzen, wszystkie wiązania C-C są o tej samej długości.
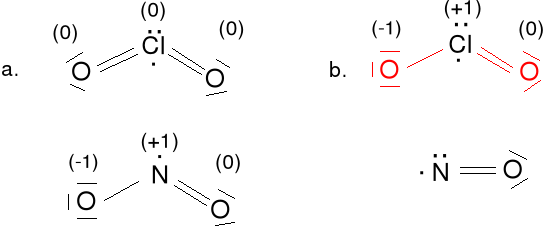
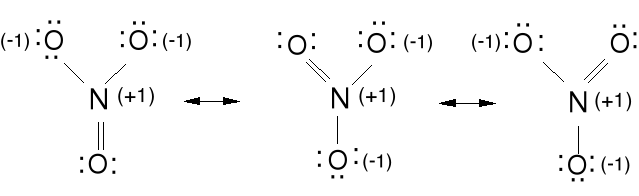
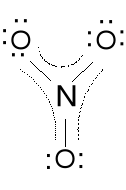
Anion azotanowy (V) NO3-.
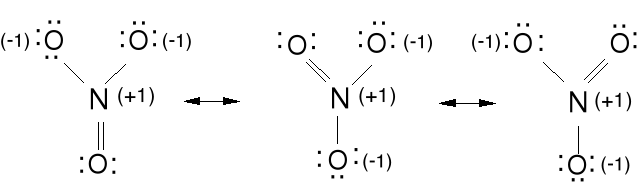
Ładunek formalny dla N; 4e - 5e = -1e (+1), dla O; 7e - 6e = 1e(-1)
Ładunek formalny wskazuje nam jak bardzo zmieniła się ilość
elektronów przy wytworzeniu związku chemicznego w porównaniu z
wolnym atomem. Ładunki formalne powinny być jak najmniejsze i
ładunek ujemny na bardziej elektroujemnym atomie.
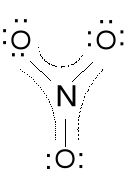
Wszystkie wiązania w NO3- są o tej samej długości, kąty ONO wynoszą 120 o, cząsteczka jest płaska. Wiązanie N-O nieco krótsze niż pojedyncze. Jest to delokalizacja tej pary elektronowej podwójnego wiązania
Istnienie wielu form mezomerycznych obniża
energię cząsteczki czy też jonu. Jon azotanowy
jest bardziej trwały niż kwas azotowy (V).
Ile jest form mezomerycznych (rezonansowych)
kwasu azotowego (V).
Zadanie domowe, zrób to samo dla kwasu
siarkowego (IV) i siarczanów (IV).
ROZSZERZENIE OKTETU
Możliwe dla trzeciego lub wyższych okresów. Stosujemy go gdy mamy za dużo przyłączonych atomów do atomu centralnego, lub ze względu na rozkład ładunków celowe jest wprowadzenie wiązań wielokrotnych, to oznacza niekiedy rozszerzenie oktetu.
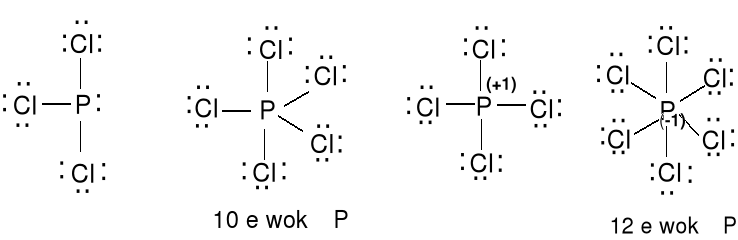
PCl3 + Cl2 = PCl5 PCl5 (gaz) [PCl4]+[PCl6]- (ciało stałe)
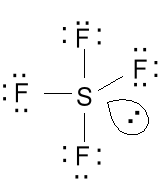
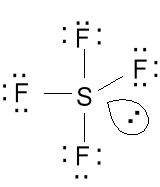
SF4 4 · 7e + 6e = 34e
10e wokół atomu S
4 wiązania + 1 para
elektronów.
Anion ortofosforanowy (V), PO43- 5e + 3e + 4 · 6e = 32e (a, b, c)
Kwas ortofosforowy(V) H3PO4 (d) i kwas pirofosforowy(V) H4P2O7 (e)
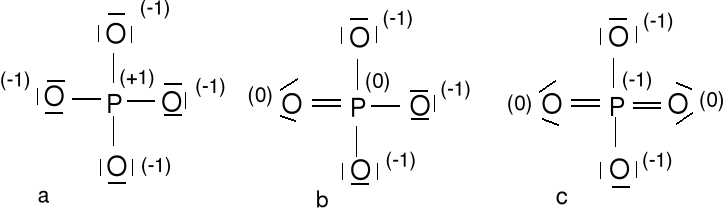
Ze względu na ładunki formalne najbardziej prawdopodobna jest struktura b. Są możliwe jeszcze 3 dodatkowe struktury rezonansowe pochodzące od struktury b. W strukturze c jest mało prawdopodobny ładunek formalny (-1) na atomie P o stosunkowo niskiej elektroujemności
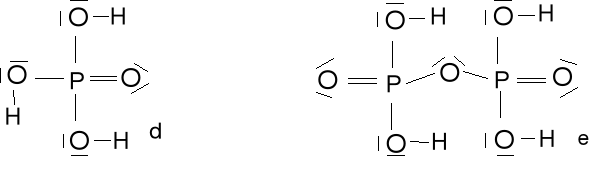
Kwas fosforowy(III) H3PO3 (f) i kwas fosforowy (I) H3PO2 (g) wyjątki

Tlenek siarki (IV), ditlenek siarki SO2; 18e
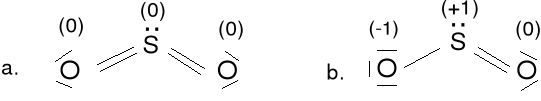
Struktura a jest bardziej prawdopodobna.
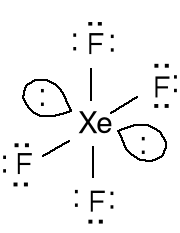
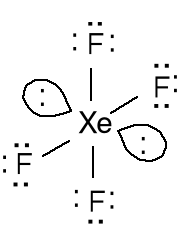
Tetrafluorek ksenonu
XeF4; 8e + 4 · 7e = 36e
12e wokół atomu Xe
4 wiązania + 2 pary
elektronów.
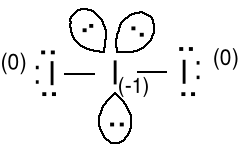
Anion I3- ; 1e + 3 · 7e = 22e
10e wokół atomu I
2 wiązania + 3 pary
elektronów.
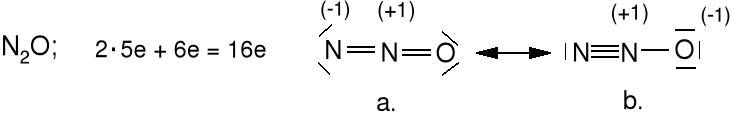
Struktura b wydaje się być bardziej prawdopodobna, gdyż formalny ładunek ujemny jest na bardziej elektroujemnym atomie tlenu. Właściwa struktura jest między a i b, symetria struktury a.
Anion azotanowy (III) (azotynowy) NO2-. 1e + 5e + 2 · 6e = 18e
Musi być spełniona reguła oktetu, 2 struktury rezonansowe.
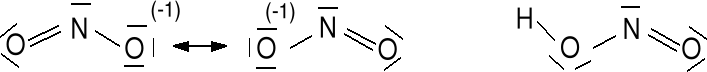
Jon siarkocyjankowy (rodankowy) SCN-.
Musi być spełniona reguła oktetu, 3 struktury rezonansowe.
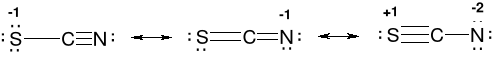
Najbardziej prawdopodobna jest struktura mezomeryczna druga,
Ładunek ujemny na najbardziej elektroujemnym atomie.
Jon chloranowy (V) i kwas chlorowy (V) .
ClO3- = 7e + 3·6e + 1e = 26e
HClO3 = 7e + 3·6e + 1e = 26e
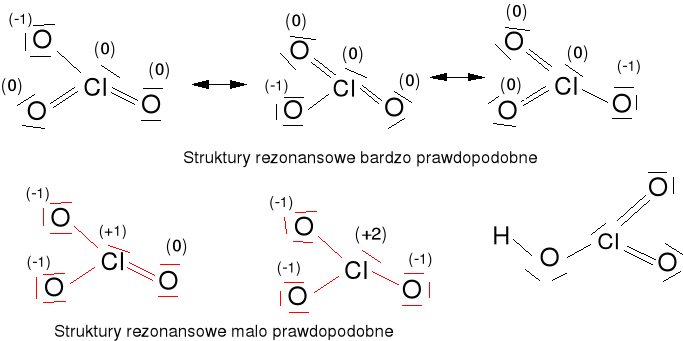
Cząsteczki z nieparzystą liczbą elektronów (rodniki)
Mało reaktywne rodniki NO, NO2, ClO2
Bardzo reaktywne rodniki CH3
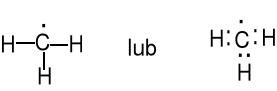
ZASADY LEWISA I KWASY LEWISA,
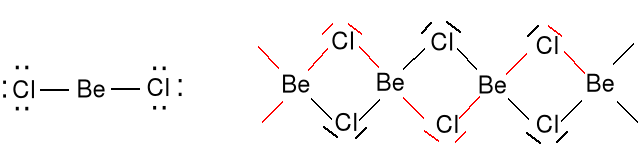
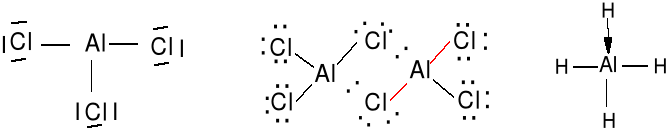
Dla niektórych monomerycznych związków boru, glinu i berylu nie możemy utworzyć oktetu elektronów.
BF3 3e + 3 · 7e = 24e NH3 5e + 3 · 1e = 8e
Luka elektronowa wolna para elektronowa
Kwas Lewisa jest Zasada Lewisa jest donorem
akceptorem pary elektronowej. pary elektronowej
![]()
AlCl3 (gaz) (AlCl3)2 AlH3 + H- = AlH4-
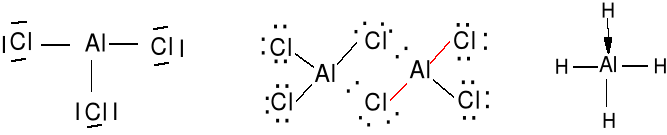
BeCl2 (gaz) (BeCl2)n w stanie stałym polimer
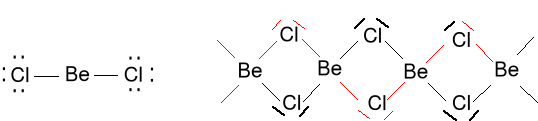
2e + 2 · 7e = 16e
Kationy lub metale bloku d są często efektywnymi kwasami Lewisa.
![]()
AgCl + 2NH3 = Ag(NH3)2Cl lub jonowo Ag+ + 2 NH3 = [Ag(NH3)2]+
![]()
Kationy metali bloku p są często efektywnymi kwasami Lewisa.
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
Jest to wiązanie kowalencyjne między pierwiastkami o różnej elektroujemności. Wytwarzają się cząstkowe ładunki elektryczne. Substancja posiada moment dipolowy μ = δ · r
r - odległość między środkami ładunków cząstkowych.
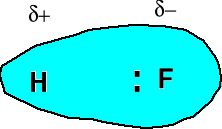
Jednostka w układzie SI = C · m
debaj 1 D = 3,336 · 10-30 C · m
Moment dipolowy -wektor skierowany od
ładunku ujemnego do dodatniego. Dodaje się jak wektory. Ładunek cząstkowy jest mniejszy od ładunku jednego elektronu, zatem nie można traktować wiązania spolaryzowanego jako pary jonów.
Pauling - wiązanie spolaryzowane jako hybryda rezonansowa
Strukt. kow. A——B ![]()
A+ B- Strukt. jon.
Rozróżnienie między wiązaniem polarnym a polarnością cząsteczki.
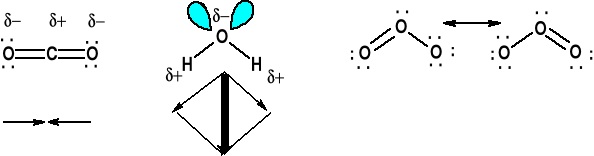
Dla cząsteczek typu AXn bez wolnych par elektronowych na atomie centralnym mamy cząsteczki niepolarne niezależnie od polarności A-X, AX2 (liniowy) AX3 (trygonalny), AX4 (tetraedryczny), AX5 (BPT), AX6 (oktaedryczny)
CCl4 - niepolarny, CHCl3, CH2Cl2 i CH3Cl - polarny
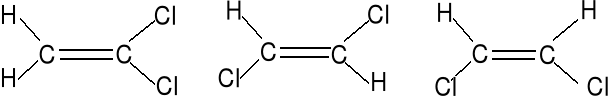
Trzy izomery C2H2Cl2, oceń polarność tych izomerów
TEORIA WIĄZAŃ WALENCYJNYCH (VB)
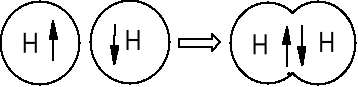
Powstawanie wiązań chemicznych jest wynikiem parowania się elektronów znajdujących się na orbitalach atomowych. Orbitale atomowe z pojedynczymi elektronami się nakładają.
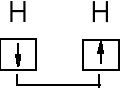
H2 H—H 1s + 1s
Wiązanie σ
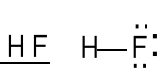
1s + 2pz (oś z zgodna z rozpatrywanym wiązaniem)
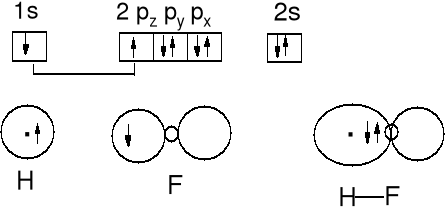
Wiązanie σ
Cząsteczka F2 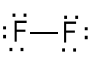
2pz + 2pz (oś z zgodna z osią wiązania)
Powstawanie wiązań chemicznych jest wynikiem parowania się elektronów znajdujących się na orbitalach atomowych powłok walencyjnych reagujących atomów. Jeżeli orbitale nakładają się czołowo tworzy się wiązanie σ, jeżeli nakładają się bocznie tworzy się wiązanie π.
HYBRYDYZACJA
Pojęcie hybrydyzacji powstało aby wytłumaczyć konfigurację elektronową określającą kształty cząsteczek. NATOMIAST kształt cząsteczek nie wynika z hybrydyzacji, wynika z oddziaływań elektrostatycznych opisywanych jakościowo np. teorią VSEPR. Hybrydyzacja to tylko pewien sposób opisania wiązań i geometrii w rozpatrywanej cząsteczce.
Rozpatrzmy tworzenie się BeCl2 Be + Cl2 → BeCl2
mieszanie jednego s i jednego p daje dwa orbitale sp.
Dwa orbitale px i py pozostają niezhybrydyzowane.
Rozmieszczenie przestrzenne chmury elektronowej jest takie samo dla dwóch jak w (a) orbitali sp albo dla nałożenia pz i s.
Promocja wymaga nakładu energii ale ponieważ tworzą się nowe wiązania to ta energia jest zwrócona z naddatkiem.
Cząsteczka jest liniowa. Dwa orbitale zhybrydyzowane sp są umieszczone pod kątem 180 °, każdy obsadzony przez jeden elektron.
Bor tworzy trwałe związki typu BX3 o kącie XBX 120 o (X = Cl, F, Br).
Mieszamy jeden orbital 2s i dwa orbitale 2p atomu boru. Powstają trzy orbitale leżące w płaszczyźnie. Jeden orbital typu p pozostaje niezhybrydyzowany.
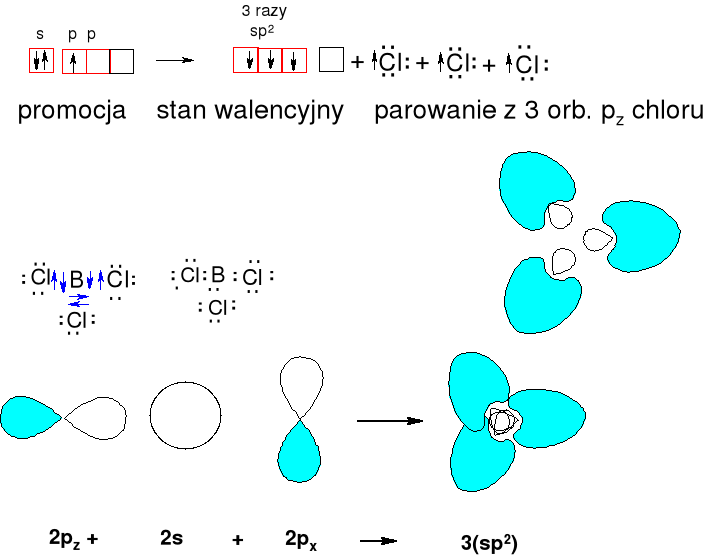
Podaj hybrydyzację azotu w anionie NO2-
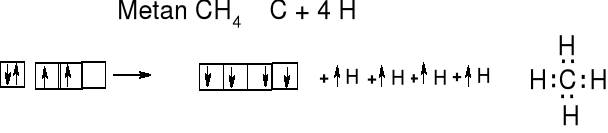
Po promocji węgiel ma 4 niesparowane elektrony. Kształt przestrzenny wiązań C—H w metanie wyobrażamy sobie jako wynik mieszania się jednego orbitalu s i trzech orbitali p. Otrzymujemy cztery zhybrydyzowane orbitale sp3. Jest to operacja matematyczna - cztery orbitale 2sp3 opisują przestrzenny rozkład chmury elektronowej dokładnie tak, jak zsumowanie jednego orbitalu 2s i trzech orbitali 2p (px, py i pz).
Atom węgla jest w
środku tetraedru,
kąt HCH = 109,5 o
Podaj hybrydyzację
azotu w kationie NH4+
i anionie NO43-.
Aldehyd mrówkowy H2C=O
Miesza się orbital 2s węgla z dwoma orbitalami 2p węgla. Otrzymujemy trzy hybrydy sp2. Tworzą one trzy wiązania σ, dwa z wodorem i jedno z tlenem. Jeden orbital p nie bierze udziału w hybrydyzacji i tworzy wiązanie o symetrii π z tlenem (σ + π = wiązanie podwójne). Wiązanie podwójne z tlenem także wymusza dla tlenu hybrydyzację sp2 i jeden niezhybrydyzowany p dla wiązania π z węglem.
Zastosuj podany model do wytłumaczenia budowy cząsteczki etenu C2H4.
Zastosuj podany model do wytłumaczenia budowy cząsteczki fosgenu COCl2. Podaj hybrydyzacje węgla i tlenu w tych cząsteczkach.
Acetonitryl CH3CN . ![]()
Miesza się orbital 2s węgla z orbitalem 2p węgla. Otrzymujemy dwie hybrydy sp. Tworzą one dwa wiązania σ, jedno z węglem grupy CH3 i jedno z azotem. Dwa orbitale p nie biorą udziału w hybrydyzacji i tworzą dwa wiązania o symetrii π z azotem (σ + 2 π = wiązanie potrójne). Wiązanie potrójne wymusza także dla azotu hybrydyzację sp i dwa niezhybrydyzowane orbitale p dla wiązań π z centralnym węglem.
Węgiel grupy CH3 tylko pojedyncze wiązania - hybrydyzacja sp3.
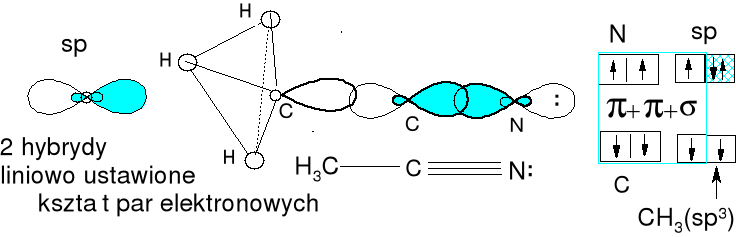
Zastosuj podany model do wytłumaczenia budowy cząsteczki etynu C2H2.
Zastosuj podany model do wytłumaczenia budowy cząsteczki N2O. Podaj hybrydyzacje węgla i tlenu i azotu w tych cząsteczkach. Jaka jest hybrydyzacja azotu w N2 i węgla oraz tlenu w CO2..
Pentachlorek fosforu - chlorek fosforu (V) PCl5.
Atom centralny jest z trzeciego okresu. Orbitale d są stosunkowo łatwo dostępne, mają dość niską energię i mogą wziąć udział w hybrydyzacji.
Miesza się orbital 3s z trzema orbitalami 3p i jednym 3d fosforu. Orbitale 3pz chloru nakładają się z orbitalami zhybrydyzowanymi fosforu (5 hybryd sp3d ) i otrzymujemy pięć wiązań σ P-Cl.
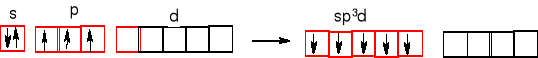
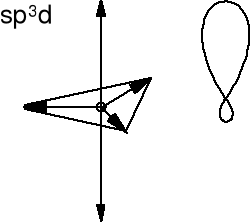
Długości wiązań P-Cl w płaszczyźnie podsta
wy bipiramidy (ekwatorialne) są krótsze niż
wzdłuż osi trójkrotnej cząsteczki (aksjalne).
Trzy hybrydy sp3d ekwatorialne są inne niż
dwie hybrydy sp3d aksjalne.
Zastosuj podany model do wytłumaczenia budowy cząsteczki BrF3. Jaka jest hybrydyzacja jodu w tej cząsteczce. Geometria atomu centralnego BPT = hybrydyzacja sp3d. Jaka jest hybrydyzacja centralnego jodu w anionie I3-.
Heksafluorek siarki - fluorek siarki (VI) SF6.
Atom centralny jest z trzeciego okresu. Orbitale d są stosunkowo łatwo
dostępne, mają dość niską energię i mogą wziąć udział w hybrydyzacji.
Miesza się orbital 3s z trzema orbitalami 3p i dwoma 3d siarki. Orbitale 2pz fluoru nakładają się z orbitalami zhybrydyzowanymi siarki (6 hybryd sp3d2) i otrzymujemy sześć wiązań σ S-F.
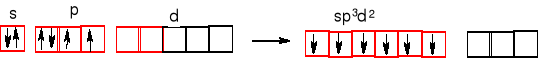
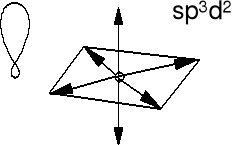
Hybrydy sp3d2 są identyczne, tylko
kierunek w przestrzeni jest inny
(patrz strzałki). Długości wiązań
w SF6 są identyczne.
Zastosuj podany model do wytłumaczenia budowy cząsteczki XeF4. Jaka jest hybrydyzacja atomu fosforu w anioniePF6-.Liczba przestrzenna 6 = geometria atomu centralnego oktaedr = hybrydyzacja sp3d2.
WIĄZANIE METALICZNE
Kryształy metali zbudowane są z jonów metali w sposób uporządkowany umieszczonych w przestrzeni oraz z bezładnie między nimi poruszających się elektronów. Jest to wszystko w równowadze.
Morze elektronów nadaje dobre
przewodnictwo elektryczne i
połysk metaliczny.
14
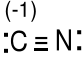
![]()
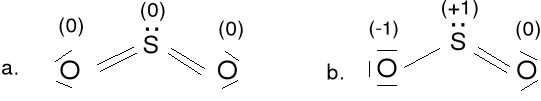
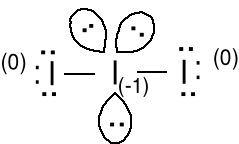
![]()
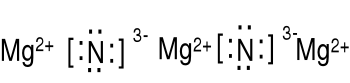
![]()
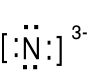
![]()
![]()
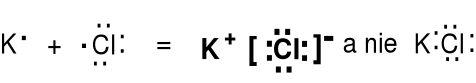
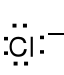
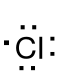
![]()
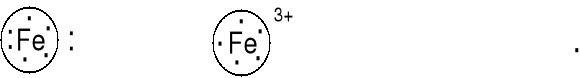
Wyszukiwarka
Podobne podstrony:
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron