KSZTAŁTY CZĄSTECZEK I JONÓW. METODA VSEPR
Jest to model odpychania się par elektronowych powłoki walencyjnej.
Wiązania chemiczne a przede wszystkim wolne pary elektronowe są obszarami o dużej gęstości elektronów (domeny elektronowe), odpychają się. Zatem przyjmują takie położenia wokół atomu centralnego, aby być daleko od siebie.
Rozpatrujemy cząsteczkę AXmEn. A-atom centralny, X - podstawniki przy atomie centralnym (m sztuk), E - wolne pary elektronowe przy atomie centralnym (n sztuk), traktujemy jak podstawnik.
m + n = liczba przestrzenna.
Procedura
Na podstawie wzoru chemicznego podaj wzór Lewisa. Ustal ile wolnych par elektronowych (n) i ile par od wiązań do podstawników (m) występuje w danej cząsteczce lub jonie. Wiązanie wielokrotne liczy się jak pojedyncze wiązanie. m + n określa geometrię par elektronowych i wiązań atomu centralnego (liczbę przestrzenną).
Zlokalizuj tak wiązania i wolne pary elektronowe aby minimalizować ich odpychanie. Odpychanie maleje w kolejności: wolna para -wolna para > wolna para-wiązanie chemiczne > wiązanie chemiczne - wiązanie chemiczne. Wiązanie wielokrotne ma nieco silniejsze działanie odpychające niż wiązanie pojedyncze. Pierwiastki bardziej elektroujemne silniej wiążą pary elektronowe (słabszy efekt sferyczny).
Przyjmij takie położenia wolnych par elektronowych aby były one możliwie daleko od siebie.
Określ kształt cząsteczki biorąc pod uwagę tylko atomy, a nie atomy i pary elektronowe.
Oceń odkształcenia wprowadzone przez duży przestrzenny efekt odpychający spowodowany przez obecność wolnych par elektronowych.
Cząsteczka typu AXE (m = 1, n = 1) liczba przestrzenna = 2
![]()
Jest to nałożenie się dwóch układów AXE
Rozważ położenie par elektronowych w cząsteczce N2
Cząsteczka typu AX2 (m = 2, n = 0) liczba przestrzenna = 2
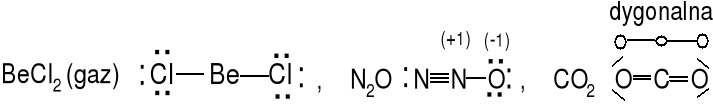
Geometria atomu centralnego dygonalna, kształt cząsteczki XAX liniowy. Określ kształt cząsteczek C2H2 i HCN, rozważ 2 izomery HCN i HNC
Cząsteczka typu AX2E, liczba przestrzenna = 3 (m + n = 3)
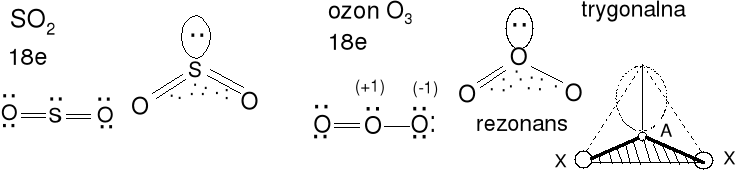
Geometria par elektronowych i wiązań atomu centralnego trygonalna
Kształt cząsteczki kątowy, rozpatrujemy tylko
atomy X-A-X. Kąt X-A-X nieco mniejszy niż 120 o
z powodu dużego efektu sterycznego wolnej pary elektronowej.
Określ kształt jonu NO2- i cząsteczki S2O (siarka jest atomem centralnym).
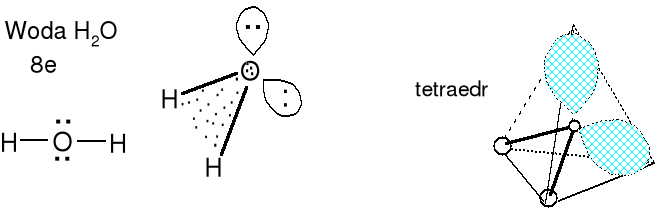
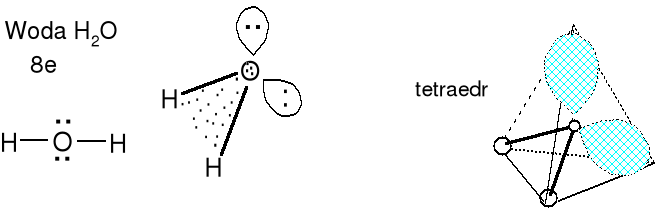
Cząsteczka typu AX2E2 liczba przestrzenna (m+n) = 4
Geometria wolnych par elektronowych i wiązań (poprawnie par elektronowych wiązań) atomu centralnego tetraedryczna. Kąt XAX nieco mniejszy niż 109,5 o (teoretyczny). Dla wody w stanie gazu 104,5 o. Kształt cząsteczki kątowy (H-O-H). Określ kształt jonu ClO2-
Określ kształt cząsteczki SF2.
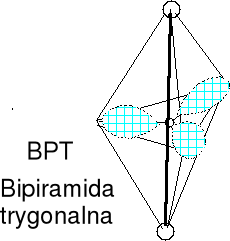
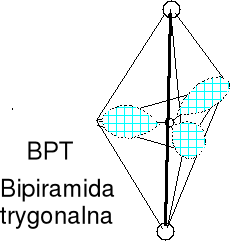
Cząsteczka typu AX2E3 liczba przestrzenna (m+n) = 5
XeF2 (22e) BrICl- (22e, atom centralny ?)
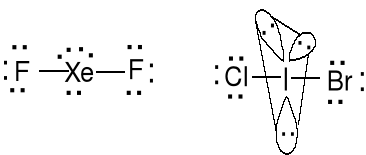
Geometria par elektronowych i wiązań atomu centralnego (BPT), bipiramida trygonalna. Cząsteczka liniowa, wolne pary w podstawie BPT (między nimi 120 o). Określ kształt anionu I3-
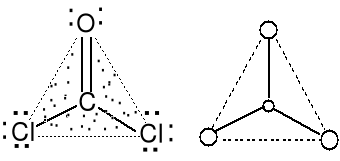
Cząsteczka typu AX3 liczba przestrzenna (m + n) =3
Geometria par elektronowych COCl2 (24e,fosgen) trygonalna
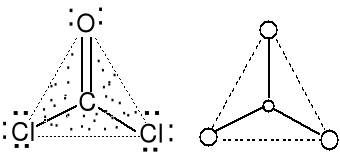
i wiązań atomu centralnego trygonalna.
Cząsteczki płaskie trójkątne
Określ kształt jonu CO32-
i cząsteczek C2H4 , H2CO i AlCl3
Cząsteczka typu AX3E, liczba przestrzenna (m + n) = 4
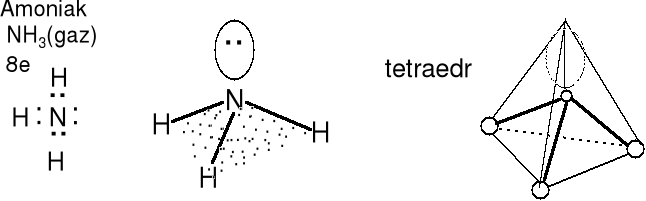
Geometria par elektronowych i wiązań atomu centralnego tetraedryczna. Cząsteczka piramidalna, rozpatrujemy tylko atomy H-H-H-N. Kąt H-N-H nieco mniejszy niż 109,5 o (teoretyczny) Określ kształt jonu SO32-
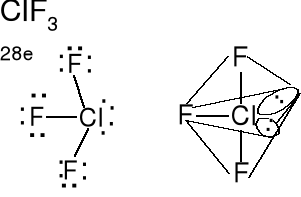
Cząsteczka typu AX3E2,liczba przestrzenna (m + n) = 5
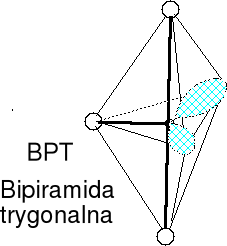
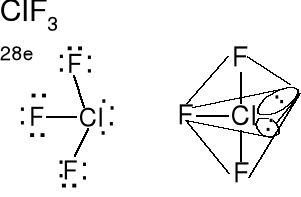
Geometria wolnych par elektronowych i wiązań atomu centralnego -bipiramida trygonalna. Wolne pary elektronowe w podstawie bipiramidy. Kształt cząsteczki płaski podobny do litery T. Kąty F-Cl-F nieco mniejsze od 90 o z powodu sterycznego (przestrzennego) oddziaływania wolnych par elektronowych. Określ kształt cząsteczki ICl3.
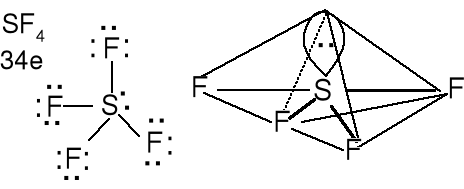
Cząsteczka typu AX4, liczba przestrzenna (m + n) = 4 (m + n = 4) tetraedr
Metan CH4 8e jon chloranowy (VII) ClO4- 32e
Geometria par elektronowych i wiązań atomu centralnego tetraedryczna. Kształt cząsteczki tetraedryczny. Kąt X-A-X 109,5 o. Określ kształt jonów PH4+, PO43-, SO42- i NO43-. Określ kształt cząsteczki SiCl4.
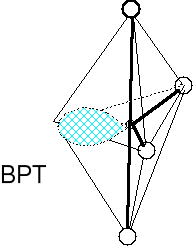
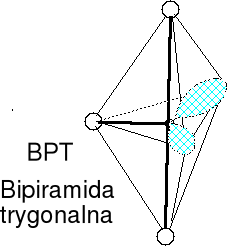
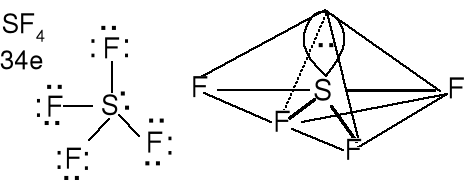
Cząsteczka typu AX4E, liczba przestrzenna (m + n) = 5
Geometria par elektronowych i wiązań atomu centralnego BPT
Wolna para elektronowa w podstawie piramidy. Cząsteczki o kształcie nieco wygiętej huśtawki.
Określ kształt cząsteczek TeCl4
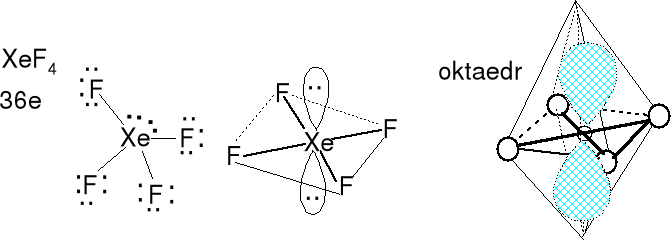
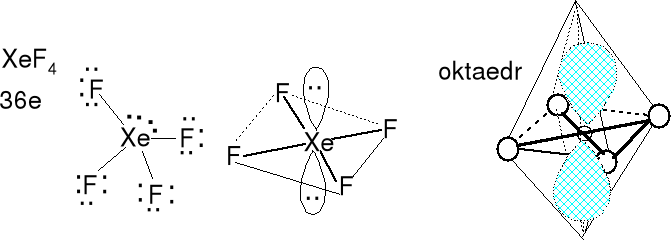
Cząsteczka typu AX4E2 liczba przestrzenna (m + n) = 6
Geometria par elektronowych (jedna) i wiązań atomu centralnego (pięć) - oktaedryczna. Kształt cząsteczki płaski kwadratowy. Rozpatrujemy tylko atomy Xe i F. Nie rozpatrujemy wolnych par elektronowych. Kąt między parami elektronowymi wynosi 180 o.
Określ kształt jonów ICl4-.
Cząsteczka typu AX5 liczba przestrzenna (m + n) = 5
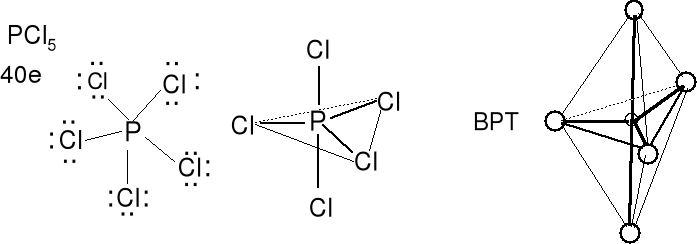
Geometria wolnych par elektronowych (tutaj brak) i wiązań atomu centralnego bipiramida trygonalna. Kształt cząsteczki BPT. Kąt Cl-P-Cl w płaszczyźnie podstawy 120 o. Długości wiązań ekwatorialnych i aksjalnych różne (przy tych samych podstawnikach). Określ kształt cząsteczki AsF5.
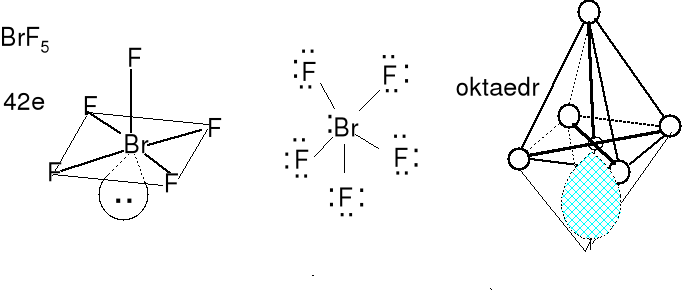
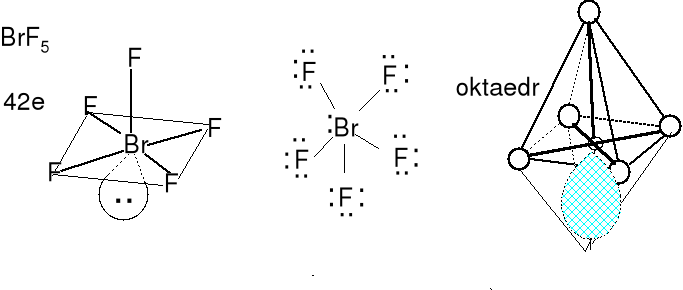
Cząsteczka typu AX5E, liczba przestrzenna (m + n) = 6
Geometria wolnych par elektronowych (jedna) i wiązań (pięć) atomu centralnego oktaedryczna. Cząsteczki o kształcie nieco zniekształconej piramidy o podstawie kwadratowej.
Określ kształt anionów SbF52-
Cząsteczka typu AX6, liczba przestrzenna (m + n) = 6
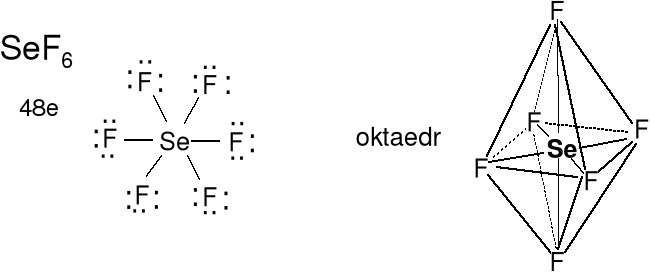
Geometria wolnych par elektronowych (brak) i wiązań (sześć) atomu centralnego i kształt cząsteczki oktaedryczny. Kąty FSeF 90 o lub 180 o. Określ kształt TeO66- i PF6-.
8
Wyszukiwarka
Podobne podstrony:
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron