![]()
1. STAN GAZOWY
![]()
1.1. GAZY I PARY
![]()
Powietrze jest mieszaniną par i gazów. W warunkach wchodzących w zakres rozpatrywanej tematyki gazami są np.: azot, tlen, argon, natomiast pary to np.: para wodna, ditlenek węgla. Większość zanieczyszczeń powietrza to także pary, jak np. ditlenek siarki, pary rozpuszczalników organicznych. Przy rozpatrywaniu zagadnień związanych z właściwościami powietrza oraz gazów odlotowych, gdzie pary występują w mieszaninie z gazami i są zwykle znacznie rozcieńczone, nie ma potrzeby rozróżniać, który ze składników jest gazem a który parą. Upraszczając zagadnienie, wszystkie składniki możemy traktować jako gazy.
Wiele substancji (pierwiastków, związków chemicznych) może występować w trzech stanach skupienia (trzech fazach). Przez odpowiednią zmianę parametrów możemy powodować ich przemiany fazowe. Obszary występowania poszczególnych stanów skupienia przedstawiono na przykładzie wody, stanowiącej (jako para wodna) istotny składnik atmosfery. Ilustruje to rysunek 1.1.
Rys. 1.1. Wykres równowag fazowych dla wody (TK - temperatura krytyczna)
Charakteryzując pokrótce trzy przedstawione na rysunku fazy można powiedzieć że:
ciała stałe cechują się określonym kształtem i granicą faz, a cząstki je tworzące (atomy, jony lub cząsteczki) są umiejscowione w siatce krystalicznej i wykonują ruchy drgające,
ciecze nie mają określonego kształtu, lecz przyjmują kształt naczynia, mają natomiast granicę faz, a cząstki, które je tworzą mogą zmieniać położenie względem siebie bez większych zmian odległości, o których decydują siły oddziaływania międzycząsteczkowego,
gazy oraz pary nie mają własnego kształtu ani granicy faz, przyjmują objętość naczynia, które wypełniają, a odległości między cząstkami są znaczne, stąd siły wzajemnego oddziaływania są znikome (na ogół wręcz pomijalne).
Jak widać z przedstawionego wcześniej rysunku z gazem mamy do czynienia wtedy, gdy temperatura jest wyższa od temperatury krytycznej, TK. Przykładowe wartości temperatury krytycznej wybranych składników i zanieczyszczeń powietrza przedstawiono w tabeli 1.1.
Tabela 1.1
Temperatury krytyczne wybranych składników powietrza
Substancja
|
Wzór chemiczny |
Temperatura krytyczna, TK [K] |
Azot |
N2 |
126 |
Tlen |
O2 |
154,3 |
Argon |
Ar |
150,7 |
Ditlenek siarki |
SO2 |
430,6 |
Ditlenek węgla |
CO2 |
304,2 |
Hel |
He |
5,1 |
Powietrze |
- |
132,4 |
Amoniak |
NH3 |
405,5 |
Woda |
H2O |
647,1 |
Z danych zawartych w tabeli wynika, że w temperaturze pokojowej, 293 K, spośród wymienionych substancji, będących składnikami powietrza, ditlenek siarki, ditlenek węgla, amoniak, para woda są parami, a pozostałe gazami. Często parę określa się wręcz jako gaz znajdujący się w temperaturze mniejszej od temperatury krytycznej, TK. W potocznym rozumieniu za parę, błędnie, uważa się obłoki mgły powstające w czasie kondensacji. Pary są równie przeźroczysta jak gazy.
Gazy i pary oraz ich mieszaniny, w warunkach tego samego przyciągania ziemskiego, są substancjami jednorodnymi i wywierają równomierne ciśnienie na ścianki naczynia, które zajmują. W skali całej atmosfery ziemskiej występuje jednak zróżnicowanie wartości ciśnienia oraz gęstości powietrza. Im większa odległość od powierzchni ziemi tym mniejsze wartości przyjmuje gęstość oraz ciśnienie.
1.2. PRAWA GAZU DOSKONAŁEGO
Stan określonej ilości gazu, wyrażonej liczbą kilomoli n (określanej mianem liczności), można opisać za pomocą trzech, ściśle ze sobą powiązanych parametrów:
ciśnienia (wywieranego na ścianki naczynia) p, wyrażonego w paskalach, Pa,
temperatury, wyrażonej w kelwinach, K,
objętości, wyrażonej w metrach sześciennych, m3.
Niekiedy stan gazu opisujemy tylko dwoma parametrami, przez podanie ciśnienia i temperatury. Wtedy opis dotyczy dowolniej (nieokreślonej) ilości gazu.
Wzajemną zmienność powiązanych ze sobą parametrów gazów możemy opisywać prostymi równaniami, przy upraszczającym założeniu, że mamy do czynienia z gazem doskonałym. Pod tym pojęciem rozumiemy gaz stanowiący zbiór punktów materialnych nie oddziałujących na siebie siłami przyciągania i odpychania, poruszających się ruchem prostoliniowym, ulegających zderzeniom idealnie sprężystym.
Prawo Avogadro
Jednakowe objętości różnych gazów, w tych samych warunkach (ciśnienia i temperatury) zawierają taką samą liczbę cząstek. W uzupełnieniu można dodać kilka informacji dodatkowych.
Jeden kilomol gazu zawiera 6,023 ∙ 1026 cząstek.
Jeden kilomol gazu przyjmuje objętość molową VM. Jest to wielkość zmienna, zależna od parametrów. W warunkach normalnych (WN) przyjmuje ona wartość (VM)WN = 22,415 m3/kmol.
Warunki normalne są umownie przyjętymi parametrami: ciśnienia, pN = 101325 Pa oraz temperatury, TN = 273,15 K
W praktyce podane wyżej wielkości stosuje się w obliczeniach z mniejszą dokładnością: (VM)WN = 22,4 m3, pN = 1,013 ∙ 105 Pa, TN = 273 K.
Z prawa Avogadra wynika praktyczna informacja - wykorzystywana w obliczeniach inżynierskich - że takie same ilości różnych gazów (wyrażone w kilomolach), w tych samych warunkach (temperatury i ciśnienia) przyjmują takie same objętości.
Prawo Boyla-Mariotte'a
W stałej temperaturze, dla określonej ilości gazu, iloczyn ciśnienia i objętości jest wielkością stałą. Matematyczny zapis prawa jest równaniem izotermy gazu.
p ∙ V = const (T = const) (1.1)
Prawa Gay-Lussaca
Dla określonej ilości gazu, pod stałym ciśnieniem stosunek objętości i temperatury jest wielkością stałą. Prawo opisuje równanie izobary.
![]()
(p = const) (1.2)
Dla określonej ilości gazu, przy zachowaniu stałej objętości, stosunek ciśnienia i temperatury jest wielkością stałą. Prawo opisuje równanie izochory.
![]()
(V = const) (1.3)
Równanie stanu gazu doskonałego
Przedstawione wyżej zależności można (dla określonej, dowolnej ilości gazu) ująć w jedno równanie:
![]()
(1.4)
Stany 1 oraz 2 są dowolne (w zakresie parametrów, w którym dana substancja występuje w postaci gazu). Można zatem napisać:
![]()
(1.5)
Wartość liczbowa iloczynu (const) zależy od ilości rozpatrywanego gazu, wyrażonej w kilomolach, czyli jego liczności (n). Dla jednego kilomola gazu (n = 1) przyjmuje ona wartość szczególną, oznaczaną symbolem R, określaną jako uniwersalna stała gazowa. Jej wartość wynosi:
![]()
[J/(kmol∙K)] (1.6)
Przez ![]()
określona jest objętość molowa gazu w temperaturze T i pod ciśnieniem p. W dalszej części pracy może ona być - w sytuacjach gdy przyczyni się to do lepszej czytelności zapisu - oznaczana symbolem![]()
, co informuje, że jej wartość zależy od wartości temperatury (T) oraz ciśnienia (p).
Z wymiaru stałej gazowej ![]()
wynika często formułowana jej definicja, iż jest to praca (wyrażona w dżulach [J]) jaką „wykona” 1 kilomol gazu podgrzany o 1 K, pod stałym ciśnieniem.
Równanie stanu gazu doskonałego, dla jednego kilomola gazu przyjmie postać:
p ∙ VM = R∙ T (1.7)
Po uwzględnieniu, że całkowita objętość rozpatrywanej ilości gazu jest równa:
V = VM ∙ n (1.8)
uzyskujemy równanie opisujące stan gazu, często używane w obliczeniach, nazywane równaniem Clapeyrona:
p ∙ V = n ∙ R ∙ T (1.9)
Prawo Daltona
Całkowite ciśnienie (p) wywierane przez mieszaninę gazów, nie reagujących ze sobą, jest równe sumie ciśnień jakie wywierałby każdy z gazów wchodzących w skład mieszaniny, gdyby sam został umieszczony w całej objętości zajmowanej przez mieszaninę, w tej samej temperaturze.
p = ∑pi (1.10)
Ciśnienie pojedynczego składnika mieszaniny (pi - ciśnienie parcjalne) zależy od jego ilości w mieszaninie, wyrażonej w kilomolach:
pi ∙ V = ni ∙ R ∙ T (1.11)
Ilość gazu całej mieszaniny wyrażona w kilomolach jest w tym wypadku równa:
n = ∑ni ( 1.12)
Wzór Clapeyrona, dla mieszaniny gazów, można zatem wyrazić następująco:
p ∙ V = ∑pi ∙ V = ∑ni ∙ R ∙ T = n ∙ R ∙ T (1.13)
Przedstawione wyżej wzory służą do opisu określonej ilości gazu wyrażonej w kilomolach. Ilość gazu możemy również określać jako masę wyrażoną w kilogramach, mi [kg]. Zamiana masy mi na liczbę kilomoli ni jest możliwa przy znajomości masy molowej rozpatrywanej substancji Mi [kg/kmol].
![]()
(1.14)
Stosując powyższą zależność możemy powiązać ciśnienie parcjalne rozpatrywanego składnika pi z jego masą mi zawartą w określonej objętości mieszaniny V:
![]()
(1.15)
W tabeli 1.2 podano masy molowe ważniejszych składników powietrza oraz typowych, gazowych zanieczyszczeń atmosfery.
Tabela 1.2
Masy molowe wybranych składników oraz zanieczyszczeń powietrza
Substancja |
Wzór chemiczny |
Masa molowa kg/kmol |
Azot |
N2 |
28,01 |
Tlen |
O2 |
32,00 |
Argon |
Ar |
39,95 |
Ditlenek siarki |
SO2 |
64,06 |
Ditlenek węgla |
CO2 |
44,01 |
Ditlenek azotu |
NO2 |
46,00 |
Tlenek azotu |
NO |
30,00 |
Woda |
H2O |
18,02 |
Tlenek węgla |
CO |
28,01 |
Amoniak |
NH3 |
17,03 |
Acetaldehyd |
CH3CHO |
44,05 |
Aceton |
CH3COCH3 |
58,08 |
Benzen |
C6H6 |
78,11 |
Butanol |
C4H9OH |
74,12 |
Chlor |
Cl |
35,45 |
Chlorowodór |
HCl |
36,46 |
Formaldehyd |
HCHO |
30,03 |
Ksylen |
C6H5 (CH3)2 |
107,17 |
Octan etylu |
CH3COOC2H5 |
88,10 |
Octan butylu |
CH3COOC4H9 |
116,16 |
Siarkowodór |
H2S |
34,02 |
Toluen |
C6H5CH3 |
92,13 |
W większości prezentowanych dalej obliczeń będą stosowane wartości mas molowych z dokładnością do jednego miejsca po przecinku.
Przedstawione wcześniej zależności (równania od 1.1 do 1.15) opisują zachowanie gazu doskonałego. Do opisu gazów rzeczywistych stosuje się bardziej złożone wzory, w których uwzględnia się dane empiryczne. Najczęściej stosowany jest wzór van der Waalsa.
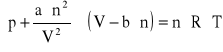
(1.16)
gdzie a oraz b są empirycznymi stałymi, charakterystycznymi dla danego gazu.
Powyższe równanie ma postać zbliżoną do równania Clapeyrona. Zawiera ono poprawkę na ciśnienie wynikające z sił oddziaływania między cząsteczkami gazu (a ∙ n2/V2) oraz poprawkę związaną z objętością własną cząstek gazu (b). Dla niezbyt wysokich wartości ciśnienia (poniżej 2 MPa) oraz dla temperatur wyższych od temperatury wrzenia substancji, wpływ obu poprawek jest pomijalnie mały a opis stanu gazu równaniem Clapeyrona jest wystarczająco dokładny dla obliczeń inżynierskich.
Powyższe równania dotyczą konkretnej ilości gazów w układzie statycznym, np. w zamkniętym naczyniu lub pomieszczeniu. W praktyce przemysłowej, np. w przypadku wydalania gazów do atmosfery mamy do czynienia z objętościowym strumieniem gazów, ![]()
[m3/s], któremu odpowiada odpowiedni strumień molowy, ![]()
[kmol/s]. Objętościowy strumień gazów to określona jego objętość V, przepływająca przez element instalacji lub wydalana do atmosfery przez emitor w określonym czasie τ [s].
![]()
(1.17)
Równanie stanu gazu można również zastosować do strumieni gazów. Wzory (1.4) oraz (1.9) przyjmą wtedy odpowiednio postacie:
![]()
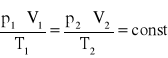
(1.18)
![]()
(1.19)
Dwa ostatnie wzory mają istotne znaczenie praktyczne. Służą do jednoznacznego określania wielkości strumienia emitowanych gazów. Wartość ![]()
zależy od parametrów gazów czyli od temperatury oraz ciśnienia (stąd za całkowicie poprawny zapis można uznać oznaczenie ![]()
), dlatego porównywanie różnych strumieni gazów ma sens wtedy gdy dokona się przeliczenia ich wartości na te same warunki odniesienia. Zwykle różne strumienie gazów, o różnych parametrach, pochodzące z różnych źródeł emisji lub z tego samego źródła ale w różnych fazach jego pracy, porównuje się po przeliczeniu na warunki normalne ![]()
.
Adaptując równanie (1.15) do opisu strumienia emitowanych gazów uzyskamy wzór pozwalający obliczać masowy strumień rozpatrywanego składnika mi, którym może być np. zanieczyszczenie gazów. Jest do tego potrzebna znajomość jego prężności parcjalnej pi.
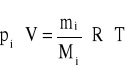
(1.20)
Do rozwiązania
Przykład 1.2
Określona ilość gazu zajmuje objętość ![]()
= 2,20 m3 w temperaturze ![]()
= 310 K i pod ciśnieniem ![]()
= 0,993 ∙ 105 Pa. Jaka będzie objętość tego gazu ![]()
w temperaturze ![]()
= 291 K i pod ciśnieniem ![]()
= 1,055 ∙ 105 Pa.
Przykład 1.6
Jaka ilość gazu, wyrażona w kilomolach, mieści się w zbiorniku o objętości ![]()
m3. Temperatura gazu jest równa ![]()
K a ciśnienie ![]()
Pa. Sprawdź jednostki.
Przykład 1.8
Jaka jest masa powietrza zawartego w pomieszczeniu o objętości V = 71,5 m3 jeśli temperatura wynosi T = 294 K a ciśnienie p = 1,006 ∙ 105 Pa? Masa molowa powietrza zawartego w tym pomieszczeniu jest równa Mp = 28,9 kg/kmol. Sprawdź jednostki.
Przykład 1.10
Ciśnienie parcjalne ditlenku węgla w powietrzu wynosi ![]()
= 38,5 Pa. Jaka jego masa, ![]()
, mieści się w jednym metrze sześciennym powietrza, V = 1,00 m3, jeśli temperatura jest równa T = 297 K.
Przykład 2.11
W temperaturze ![]()
K i pod ciśnieniem ![]()
Pa jeden metr sześcienny powietrza, V = 1,00 m3, zawiera 7,44 grama pary wodnej, ![]()
kg. Jaką ilość pary wodnej, ![]()
będzie zawierał jeden metr sześcienny tego powietrza gdy temperatura wzrośnie do ![]()
K a ciśnienie pozostanie niezmienione?
Przykład 1.14
Strumień objętościowy gazów odlotowych wyzwalany w procesie produkcyjnym wynosi ![]()
m3/s (tj. 18500 m3/h). Temperatura jest równa T1 = 330 K a ich ciśnienie p1 = 1,02 ∙ 105 Pa. Określ wielkość strumienia gazów w przeliczeniu na warunki normalne, ![]()
.
Przykład 1.16
Do atmosfery jest wydalany strumień objętościowy gazów odlotowych ![]()
6,19 m3/s (tj.22300 m3/h). Temperatura gazów wynosi T = 331 K a ciśnienie jest równe ![]()
Pa. Gazy zawierają pary toluenu. Ciśnienie parcjalne par toluenu wynosi ![]()
Pa. Oblicz strumień masowy toluenu, ![]()
wydalany do atmosfery z gazami odlotowymi.
para
gaz
ciecz (woda)
Ciśnienie ,N/m2
612,9
273,1
TK=647,1
ciało stałe (lód)
Punkt potrójny
Temperatura, K
Wyszukiwarka
Podobne podstrony:
Przedsiebi, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś pwsz kalis
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz kalisz rozporzadz, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, VI odzysk ciepla ob
W-14, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, Meteorologia materialy
W-10, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, Meteorologia materialy
OCHRONA POWIETRZA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, IV ochrona powietrza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
pwsz kalisz Metody oznaczania mikroorganizmów w powietrzu, inżynieria ochrony środowiska kalisz, a p
Wentylatory 2003, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś pwsz
obliczenia7, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Mechanika budowli, Mechanika budowli -
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
Instrukcja1-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
pwsz ioś kalisz Analiza-Pehametria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
GRUPA C, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś pwsz kalisz
pwsz ioś kalisz polarymetria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza chemi
Podsta~1-wykłady, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Ekonomia
tab rozbiorów najnowsza, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z i
więcej podobnych podstron