Ćwiczenia 1 i 2
Zakres realizowanej tematyki:
Chromatograficzny rozdział metodą chromatografii gazowej (GC) próby tłuszczu mlecznego. Analiza jakościowa składu kwasów tłuszczowych wybranych prób tłuszczu mlecznego z oraz próby własnej z wykorzystaniem GC. Ćwiczenia dotyczące interpretacji chromatogramów. Spektrofotometria UV-Vis i jej zastosowanie do badania zmian utlenienia lipidów.
Prowadzący Ćwiczenia: Dr hab. Jarosława Rutkowska, Mgr inż. Małgorzata Białek
Treści teoretyczne dotyczące chromatografii
Istota rozdziału chromatograficznego. Znaczenie chromatografii.
Chromatografia jest fizykochemiczną metodą rozdzielania, w której składniki rozdzielane ulegają podziałowi między dwie fazy: jedna jest nieruchoma (faza stacjonarna), a druga (faza ruchoma) porusza się w określonym kierunku. Różny podział składników mieszaniny pomiędzy obie fazy powoduje zróżnicowanie prędkości migracji i rozdzielenie składników (rys 1.)
Fazą stacjonarną może być ciało stałe, ciecz na nośniku lub żel, a fazą ruchomą - gaz, ciecz i gaz lub ciecz w stanie nadkrytycznym (fluid). Należy podkreślić, że pojęcie chromatografia dotyczy nie tylko rozdzielania mieszanin związku, ale również ich analizy jakościowej i ilościowej.
Rys 1. Mechanizm procesu chromatograficznego. Rozdzielane substancje charakteryzują się zróżnicowanymi współczynnikami retencji k
Metody chromatograficzne można sklasyfikować wg różnych kryteriów: np. stanu skupienia fazy ruchomej: chromatografia gazowa, chromatografia cieczowa,
i innych: stanu skupienia fazy stacjonarnej (np. chromatografia w układzie gaz - ciecz (ang. gas-liquid chromatography - GLC) itp, natury zjawisk będących podstawą procesu chromatografowania: chromatografię adsorpcyjną, podziałową, jonowymienną, żelową; technik eksperymentalnych: chromatografia kolumnowa i planarna.
2. Chromatografia gazowa (GC): parametry chromatograficzne w GC
Chromatografia gazowa jest jedną z najpowszechniej stosowanych w praktyce laboratoryjnej metod analizy instrumentalnej. Umożliwia ona jakościową i ilościową analizę substancji, które w warunkach chromatografowania mają postać gazów lub par. Szacuje się, że około 20% znanych związków chemicznych spełnia ten warunek i może być analizowane w ten sposób. Przyjmuje się, że są to substancje gazowe, ciekłe i stałe, których temperatura wrzenia nie przekracza 350-4000C.
Rozdzielenie składników analizowanych metodami chromatograficznymi mieszanin jest wynikiem różnego ich podziału między fazę ruchomą i nieruchomą układu chromatograficznego. Chromatografia gazowa to analityczna technika chromatograficzna, w której fazą nośną jest gaz (najczęściej hel, argon, coraz rzadziej wodór). W zależności od rodzaju fazy stacjonarnej wyróżniamy następujące rodzaje chromatografii gazowej:
chromatografię adsorpcyjną (fazą stacjonarną jest adsorbent). Rozdzielenie jest wynikiem różnej siły, z jaką adsorbowane są poszczególne składniki analizowanej mieszaniny,
chromatografię podziałową (fazą stacjonarną jest osadzona na nośniku ciecz, w której rozpuszczają się przepływające przez kolumnę anality). Podstawą rozdziału jest różna rozpuszczalność analitów w tej cieczy.
Faza ruchoma porusza się wewnątrz kolumny, natomiast faza stacjonarna jest osadzona na wewnętrznych ściankach kolumny. Związki chemiczne z większym powinowactwem do fazy stacjonarnej są selektywnie zatrzymywane przez nią i poruszają się wzdłuż kolumny szybciej i tym samym opuszczają kolumnę, czyli eluują z kolumny, jako pierwsze. Równowaga podziału pomiędzy fazy ma charakter dynamiczny, czyli cząsteczki substancji nieustannie przechodzą od fazy ruchomej do stacjonarnej i z powrotem.
3. Parametry chromatograficzne w chromatografii gazowej
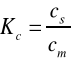
Podstawowym parametrem określającym podział substancji X pomiędzy dwie fazy jest stała podziału K, którą można wyrazić równaniem Nernsta:
Gdzie: cs - oznacza stężenie substancji X w fazie stacjonarnej,
cm - oznacza stężenie substancji X w fazie ruchomej.
Innym ważnym parametrem jest współczynnik retencji k, który jest miarą czasu, w jakim substancja X przebywa w fazie stacjonarnej, w stosunku do czasu, w którym przebywa ona w fazie ruchomej. Określa on, ile razy dłużej dana substancja jest zatrzymywana przez fazę stacjonarną niż potrzebowałaby na przejście przez kolumnę z prędkością poruszania się fazy ruchomej. Związki chemiczne charakteryzujące się różnymi współczynnikami retencji mogą zostać rozdzielone na kolumnie chromatograficznej (rys 1).
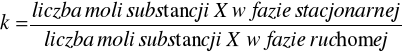
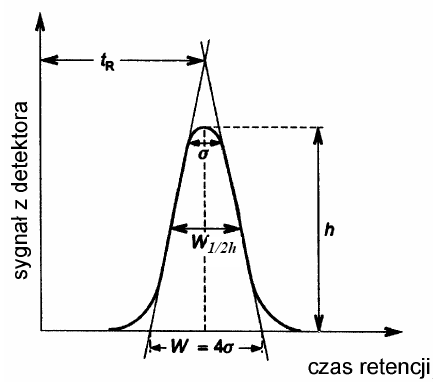
Efekt rozdziału chromatograficznego jest wykreślany w postaci chromatogramu, który przedstawia wykres wskazań sygnału uzyskanego w detektorze w funkcji czasu lub w funkcji objętości fazy ruchomej. Zapis stężenia pojedynczej substancji w funkcji czasu ma postać krzywej Gaussa i nosi nazwę piku (ang. peak czyli szczyt). Na chromatogramie możemy określić (rys 2):
czas retencji tR - czas mierzony od momentu wprowadzenia próbki na kolumnę do momentu pojawienia się na wyjściu z kolumny maksimum stężenia danego związku chemicznego czyli maksimum piku,
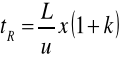
gdzie: L - długość kolumny chromatograficznej, u - średnia liniowa prędkość przepływu gazu nośnego, k - współczynnik retencji.
zerowy czas retencji tM (czas „martwy”) - czas przebywania w kolumnie substancji, która nie ma powinowactwa do fazy stacjonarnej np. metanu; czas zerowy jest równy czasowi przepływu fazy ruchomej przez kolumnę,
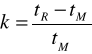
zredukowany czas retencji t'R - jest różnicą pomiędzy czasem retencji a zerowym czasem retencji: t'R = tR - tM,współczynnik retencji k
szerokość piku mierzoną u podstawy piku w lub szerokość piku mierzoną na określonej wysokości piku np. w połowie wysokości w1/2h
Rys 2. Chromatogram i sposób pomiaru podstawowych wielkości chromatograficznych
Sprawność kolumny chromatograficznej decyduje o tym, czy pik chromatograficzny jest ostry czy też rozmyty. Korzystne jest, aby rozmycie było ograniczone, aby piki były wąskie, gdyż wówczas będą lepiej rozdzielone. O sprawności kolumny decyduje liczba półek teoretycznych - im jest ich więcej tym kolumna jest sprawniejsza (rys 3). Półka teoretyczna jest to objętość kolumny, w której zostaje osiągnięty stan równowagi pomiędzy stężeniami substancji chromatografowanej w fazie ruchomej i w fazie stacjonarnej. Kolumna chromatograficzna składa się z N półek teoretycznych:
L = N x H
gdzie: L - długość kolumny chromatograficznej, H (lub inaczej WRPT) - wysokość równoważna półce teoretycznej, N - liczba półek teoretycznych.
Rys 3. Wpływ liczby półek teoretycznych (N) na kształt piku chromatograficznego
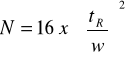
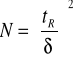
Liczbę półek teoretycznych można obliczyć korzystając z danych odczytanych z chromatogramu (rys 4) oraz wzorów:
gdzie: w - szerokość piku mierzona u podstawy, w 1/2h - szerokość piku mierzona w połowie wysokości piku, δ- odchylenie standardowe krzywej (szerokość piku na wysokości równej 0,882 wysokości). Wszystkie wielkości mierzone są w jednostkach czasu.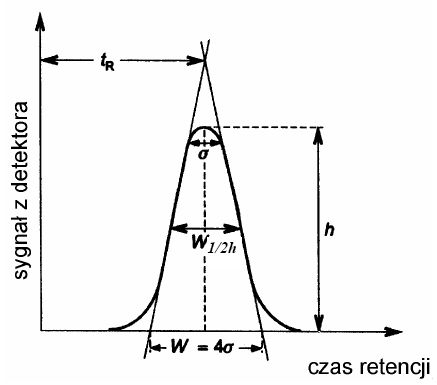
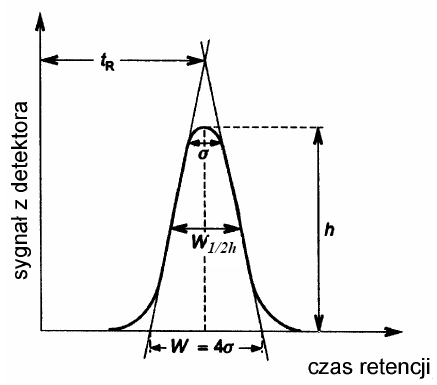
Rys 4. Obliczanie liczby półek teoretycznych kolumny
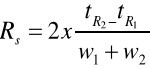
Miarą skuteczności rozdzielania składników mieszaniny jest wielkość nazwana rozdzielczością RS. Rozdzielenie pików chromatograficznych zależy zarówno od ich odległości, jak i od ich szerokości, tzn. od sprawności kolumny:
Gdzie: tR1 oraz tR2 są czasami retencji związków 1 oraz 2, w1 oraz w2 to szerokości pików mierzone przy podstawie. Formuła ta umożliwia praktyczny pomiar rozdzielczości przy zastosowaniu danych odczytanych z chromatogramu.
4. Budowa i sposób działania chromatografu gazowego
Schemat chromatografu gazowego przedstawiono na rys 5. Gaz nośny (faza ruchoma) doprowadzony z butli płynie przez regulator przepływu do dozownika, a następnie przez kolumnę i detektor, skąd jest usuwany na zewnątrz do atmosfery. Kolumna jest umieszczona w termostacie. Temperatura dozownika, detektora i kolumny jest odpowiednio regulowana.
Rys 5. Elementy chromatografu gazowego
Do dozownika wprowadza się próbkę, która po odparowaniu w dozowniku, miesza się ze strumieniem gazu nośnego i następnie jest przenoszona do kolumny. W kolumnie następuje rozdział chromatograficzny składników próbki, które opuszczają kolumnę wraz z gazem nośnym i trafiają do detektora. Składniki próbki są monitorowane w detektorze generując w nim sygnał elektryczny. Sygnały po wzmocnieniu we wzmacniaczu mogą być rejestrowane w komputerze lub rejestratorze.
W chromatografii gazowej fazę ruchomą stanowią gazy o małej gęstości, niskiej lepkości, w których współczynniki dyfuzji są duże. Najczęściej jest to: wodór, azot, argon lub hel. Rodzaj gazu nośnego ma niewielki wpływ na wynik rozdziału chromatograficznego. Zadaniem gazu jest transport próby przez dozownik, kolumnę i detektor. Przy wyborze gazu nośnego należy się kierować przede wszystkim rodzajem detektora, dostępnością i czystością gazu. Wymagana czystość gazów wynosi > 99,999%.
Dozownik jest elementem umożliwiającym wprowadzenie próbki w strumień gazu nośnego, który przenosi ją do kolumny. Próbka ciekła lub stała powinna w dozowniku odparować lub odsublimować w jak najkrótszym czasie i dlatego jego temperaturę ustawia się zwykle ok. 200C powyżej temperatury wrzenia najwyżej wrzącego składnika próbki. Dzięki temu unika się długiego wprowadzania próbki do kolumny, które może być powodem rozmycia i asymetrii pików oraz pogorszenia rozdziału. Z tego samego względu czas wprowadzania próbki do dozownika powinien być jak najkrótszy, a jej objętość możliwie mała. Zbyt wysoka temperatura może także spowodować termiczny rozkład analitów.
Klasyczne dozowanie próbki do typowej kolumny kapilarnej polega na wprowadzeniu cieczy (0,1 - 5 μl) za pomocą strzykawki do dozownika. Prawidłowy sposób odmierzenia danej objętości próbki w strzykawce przedstawia rys 6. W dozowniku następuje gwałtowne odparowanie próbki i po zmieszaniu z gazem nośnym próbka jest wprowadzana na kolumnę.
Rys 6. Mikrostrzykawka do odmierzania małych objętości cieczy
5. Estry Metylowe Kwasów Tłuszczowych
Przygotowanie próby tłuszczu mlecznego do analizy kwasów tłuszczowych metodą chromatografii gazowej wymaga przeprowadzenia procesu transestryfikacji. Estry nie są zdolne do tworzenia między sobą wiązań wodorowych i dlatego posiadają stosunkowo niskie temperatury wrzenia. Estry metylowe mają temperatury wrzenia niższe o ok. 60°C niż odpowiednie kwasy karboksylowe, a w przypadku estrów etylowych różnica ta wynosi ok. 40°C.
Transestryfikacja jest procesem polegającym na wymianie chemicznie związanej gliceryny w cząsteczce triacyloglicerolu na dodany alkohol metylowy lub etylowy w obecności katalizatora zasadowego lub kwasowego.
Rys. 7. Schemat reakcji transestryfikacji.
W wyniku procesu transestryfikacji tłuszczu zwierzęcego lub oleju roślinnego z zastosowaniem alkoholu metylowego powstają estry metylowe kwasów tłuszczowych (EMKT, FAME - Fatty Acid Methyl Ester). Reakcja transestryfikacji przebiega:
- w temperaturze otoczenia, jeśli stosuje się katalizator alkaliczny,
- w temperaturze ok. 100°C, jeżeli używa się katalizatora kwaśnego,
- w temperaturze powyżej 250°C, jeśli nie stosuje się katalizatora.
Najczęściej do otrzymania estrów metylowych i etylowych stosuje się katalizatory zasadowe KOH, NaOH, Na2CO3, CH3COONa. Transestryfikacja biegnie do chwili ustalenia się stanu równowagi zależnej od stosunku ilościowego związków biorących udział w procesie. Proces transestryfikacji olejów roślinnych można również prowadzić metodą enzymatyczną, stosując biokatalizatory w postaci enzymów.
W celu przyspieszenia estryfikacji ogrzewa się mieszaninę do wrzenia. Reakcję katalizują protony, dalsze przyspieszenie procesu można uzyskać dodając kwasu mineralnego, np. stężonego kwasu siarkowego. Kwas siarkowy pełni rolę katalizatora ponieważ dostarcza protonów, a również jako substancja higroskopijna wiąże wodę, która powstaje w środowisku reakcji. Metanol natomiast ze wszystkich alkoholi wykazuje największą szybkość estryfikacji. Estry mają gęstość mniejszą od wody oraz są substancjami trudno rozpuszczalnymi w wodzie, są natomiast dobrymi rozpuszczalnikami dla związków organicznych.
Rys. 8. Schemat procesu transestryfikacji.
Treści teoretyczne dotyczące spektrofotometrii
Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące w cząsteczkach, spowodowane absorpcją promieniowania elektromagnetycznego w zakresie:
nadfioletu (UV 200-380 nm),
widzialnym (VIS 380-750 nm),
lub podczerwieni (IR powyżej 750 nm).
Źródłem promieniowania mogą być lampy spektralne (np. deuterowe, wodorowe, rtęciowe, sodowe), laser lub lampy żarowe. Lampy spektralne i lasery dają widmo liniowe, natomiast lampy żarowe widmo ciągłe. W celu otrzymania określonej długości fali używa się odpowiednich monochromatorów. W monochromatorze znajduje się układ (pryzmat, siatka dyfrakcyjna lub filtry), który przez odpowiednie ustawienie na szczelinę wyjściową pozwala skierować wiązkę promieniowania o określonej długości fali. Ze szczeliny wyjściowej wiązka monochromatyczna wpada do pomieszczenia pomiarowego, w którym przechodzi przez odpowiednie naczynie (kuwetę) z roztworem zawierającym analizowany związek
Podstawę kolorymetrycznego oznaczania stężenia substancji w roztworze stanowi zależność między intensywnością zabarwienia roztworu, a stężeniem zawartej w nim substancji. Metoda ta służy do oznaczania stężenia substancji mających własną barwę. Barwa substancji zależy od selektywnej absorpcji określonej długości światła widzialnego i jest barwą dopełniającą do pochłoniętej. Na zabarwienie roztworu składają się fale elektromagnetyczne nie zaasorbowane przez analizowaną substancję, czyli promieniowanie przepuszczone.
Substancje bezbarwne można oznaczać ilościowo metodą kolorymetryczną lecz po przeprowadzeniu ich w barwne pochodne na drodze stechiometrycznych reakcji chemicznych, które powinny przebiegać szybko i do końca, powinny być powtarzalne i specyficzne oraz łatwe do przeprowadzenia. Specyficzność reakcji zwykle określa użyty odczynnik barwiący, który powinien reagować tylko z badaną substancją i nie powinien wchodzić w reakcję z żadną inną substancją obecną w roztworze. Powstała barwa powinna być: trwała, niewrażliwa na światło, niepodatna na zmiany pH i niezależna od zmian temperatury.
W zakresie światła widzialnego i ultrafioletu efekt absorpcji promieniowania występuje tylko w tych związkach, które posiadają ugrupowania atomów zawierające ruchliwe elektrony π, bądź wiązania wielokrotne. W przypadku związków absorbujących światło z zakresu widzialnego (związki barwne dla oka ludzkiego), w cząsteczce muszą występować określone ugrupowania atomów. Noszą one nazwę chromoforu. Chromofor - część cząsteczki, która jest bezpośrednio odpowiedzialna za absorpcję promieniowania zakresie 180-800 nm (w obrębie, której zachodzi zjawisko pochłonięcia energii). Przykładem grup chromoforowych są: grupa azowa, grupa nitrowa, pierścienie aromatyczne. Obok grup chromoforowych w cząsteczce mogą występować ugrupowania auksochromowe, do których zaliczamy między innymi grupę aminową czy hydroksylową. Są to podstawniki w cząsteczce, które same nie absorbują promieniowanie promieniowania, ale ich obecność powoduje wzrost intensywności zabarwienia (auksochromy przesuwają absorpcję w kierunku fal dłuższych (tzw. przesunięcie batochromowe).
Typowe chromofory:
>C=C< chromofor alkenowy
chromofor benzenowy
>C=O chromofor karbonylowy
-N=N- chromofor azowy
>C=S chromofor tiolowy
-N=O chromofor nitrozowy
Auksochromy - Na przykład grupy:
hydroksylowa
aminowa
sulfhydrylowa
Istnieją dwa podstawowe prawa absorpcji światła, które dotyczą zależności natężenia światła przechodzącego od natężenia światła padającego, oraz od stężenia warstwy absorbującej i jej grubości.
Prawo Lamberta i Beera - istnieje proporcjonalna zależność pomiędzy stężeniem, grubością warstwy absorbującej i absorbancją.
![]()
ε - molowy współczynnik absorpcji,
c - stężenie [mol/l],
l - grubość warstwy [cm].
Prawo addytywności - absorbancja jest wielkością addytywną tzn. absorbancja mieszaniny n składników jest równa sumie absorbancji poszczególnych składników
![]()
Graficznym zapisem zmian absorbancji od długości fali przechodzącej przez roztwór jest widmo absorpcji.
Spektrofotometria UV/VIS znalazła szerokie zastosowanie w analizie chemicznej. Jednym z zastosowań jest analiza ilościowa. W celu wyznaczenia zawartości (stężenia) dowolnego związku najlepiej zastosować metodę krzywej wzorcowej. W tym celu należy przygotować serię roztworów badanego związku o znanym stężeniu (roztwory wzorcowe). Następnie wyznaczyć analityczną długość fali dla roztworu o największym stężeniu (długość fali, przy której absorbancja jest największa) i przy tej długości fali dokonać pomiarów absorbancji roztworów wzorcowych oraz pomiaru absorbancji badanego roztworu (Ax). Na wykresie zależności absorbancji od stężenia wykreśla się prostą i odczytuje z niej stężenie badanego związku.
Metody spektrofotometryczne z zastosowaniem krzywej wzorcowej są metodami porównawczymi. Dokładność ich w dużej mierze zależy od dokładnego
i właściwego przygotowania roztworów wzorcowych, które służą do przygotowania serii wzorców.
Zagadnienia do przygotowania na kolokwium
Korzystając z załączonych materiałów:
Klasyfikacja metod chromatograficznych.
Istota rozdziału chromatograficznego
Równanie Nernsta.
Chromatogram i podstawowe wielkości chromatograficze.
Znaczenie sprawności kolumny chromatograficznej i pojęcie półki teoretycznej.
Co to jest rozdzielczość.
Budowa i sposób działania chromatografu gazowego.
Dlaczego należy przeprowadzić proces transestryfikacji tłuszczu analizując skład KT.
Pojęcie transestryfikacji (+ reakcja).
Rodzaje katalizatorów, a przebieg transestryfikacji.
Pojęcie spektrofotometrii.
Oznaczanie spektrofotometryczne substancji bezbarwnych.
Pojęcie chromoforu i auksochromu oraz przykłady.
Prawa absorpcji światła.
Analiza ilościowa w spektrofotometrii UV-Vis
Prawo Lamberta Beera.
Z ćwiczeń (notatek w trakcie ćwiczeń)
Co to jest analiza jakościowa chromatogramu
Analiza ilościowa w chromatografii gazowej (metoda wzorca wewnętrznego, metoda normalizacji wewnętrznej).
Prozdrowotna rola długołańcuchowych kwasów omega-3
Prozdrowotne kwasy tłuszczu mlecznego
9
Wyszukiwarka
Podobne podstrony:
Tematy-i-harmonogram-zajęć-z-Now.-Met.-A.-Ż.-2013-14-st.stacjon, Nowoczesne metody analizy żywności
Kalend.-Ćwiczeń-z-Now.-Met.-Anal.-Żywn.-13-14, Nowoczesne metody analizy żywności
Ćwiczenia 3 i 4 NMAŻ, Nowoczesne metody analizy żywności
Kalend.-Ćwiczeń-z-Now.-Met.-Anal.-Żywn.-13-14, Nowoczesne metody analizy żywności
sprawko tran, Nowoczesne metody analizy żywności
SPRAWOZDANIE 1 Nowoczesne metody analizy żywności
Sprawozdanie-1-chromtografia, Nowoczesne metody analizy żywności
Sprawozdanie-1, Nowoczesne metody analizy żywności
Nowoczesne Metody Analizy Żywności gr2
Nowoczesne metody analizy żywności
Nowoczesne metody analizy żywności
NOWOCZESNE METODY UTRWALANIA ŻYWNOŚCI
1 1 NOWOCZESNE METODY ANALIZY SUROWCÓW
Metody reologiczne w analizie żywności
Nowoczesne metody leczenia skolioz przy wykorzystaniu ćwiczeń w wodzie, Fizjoterapia
ANALIZA ZYWNOSCI Kolokwia, studia, Maja, Studia, II rok, IV semestr, Analiza Żywnosci, Analiza Cwicz
więcej podobnych podstron