Nr grupy 22 Nr zespołu 3 |
Nr ćwiczenia 6
|
Data: 14-04-2008
|
Grzywacz Joanna Góral Katarzyna Paśko Karolina |
TRÓJKĄT STĘŻEŃ GIBBSA |
Ocena : |
1. Wprowadzenie teoretyczne
Diagram Gibbsa, zwany też trójkątem Gibbsa - Roozebooma stosuje się do graficznego przedstawienia składu mieszanin maksymalnie trójskładnikowych.
Jest to trójkąt równoboczny, którego wierzchołki A, B, C odpowiadają 100% danego składnika. Każdy punkt leżący na boku odpowiada zawartości 2 składników (układ dwuskładnikowy). Każdy punkt wewnątrz trójkąta odpowiada zawartości 3 składników w układzie. Aby znaleźć zawartość dla dowolnego punktu przeprowadzamy przez niego 3 proste równoległe do boków trójkąta. Odległości miejsc przecięcia tych prostych z bokami od wierzchołka trójkąta wyznaczają udział procentowy składników A, B, C w mieszaninie. Odcinek równoległy do boku trójkąta zawiera punkty o jednakowym stężeniu danego składnika (wierzchołek naprzeciw tego boku). Odcinek przechodzący przez jeden z wierzchołków odpowiada stałemu stosunkowi stężeń dwu pozostałych składników. Jeżeli jest podany skład mieszaniny i chcemy znaleźć punkt na płaszczyźnie trójkąta - należy dane odłożyć na odpowiednich bokach trójkąta i przeprowadzić równoległe do boków - w miejscu ich przecięcia leży poszukiwany punkt.
Układ dwuskładnikowy i dwufazowy A-B po dodaniu pewnej ilości składnika C staje się jednofazowy; mieszanina staje się roztworem jednorodnym. Aby w założonej temperaturze określić stężenia, przy których tworzy się układ jednofazowy trójskładnikowy, miesza się A, B i C, jeżeli po osiągnięciu stanu równowagi uzyskamy układ wielofazowy - fazy rozdzielamy i określamy ich skład. Skład faz współistniejących ze sobą nanosimy na trójkąt Gibbsa i odpowiadające im punkty łączymy ze sobą odcinkami tzw. konodami. Krzywa binodalna powstaje po połączeniu punktów końcowych konod i wyznacza ona skład roztworów nasyconych. Punkt krytyczny odpowiada roztworowi nasyconemu, gdy dwie fazy mają identyczny skład. W miarę wzrostu temperatury rozpuszczalność cieczy z reguły rośnie i zmniejsza się zakres dwufazowy na trójkącie stężeń, aż do całkowitego zaniknięcia powyżej górnej temperatury krytycznej mieszalności. Istnieją też układy, w których dwie lub trzy pary składników wykazują ograniczoną rozpuszczalność.
Reguła faz określa liczbę stopni swobody układu zawierającego S składników i F faz. Odkrywcą tej reguły był twórca trójkąta stężeń J. Willard Gibbs, wyraża ją równanie:
![]()
S - liczba składników, F - liczba faz
Do ilościowego określenia składu fazy potrzebnych jest S-1 wyrazów stężeniowych. Ogólna liczba zmiennych stężeniowych wynosi F(S-1). Określa się ciśnienie i temperaturę, ogółem mamy F(S-1)+2, jeżeli uwzględnia się wszystkie fazy układu. Wyznacza się liczbę zmiennych określonych przez warunki równowagi układu. Składnik S1 rozdzielony jest między fazy F1 i F2. W stanie równowagi spełniona jest pewna zależność, którą w sposób uproszczony można przedstawić za pomocą wzoru:
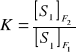
Jeżeli jest ustalone stężenie S1 w fazie F1 powyższe równanie określi jednoznacznie jego stężenie w fazie F2. Dla S składników zależności równowagowe określają jednoznacznie ogółem S(F-1) parametrów intensywnych. Liczba stopni swobody (tj. liczba parametrów intensywnych, które można zmieniać) będzie równa:
![]()
Jeżeli jakiś składnik nie występuje lub występuje w znikomo małej ilości w jednej z faz układu, to liczba parametrów intensywnych odpowiadających tej fazie będzie o jeden mniejsza.
Reguła faz dotyczy wszystkich układów, niezależnie od tego, czy ich fazy zawierają jednakowe liczby składników.
2. Cel ćwiczenia
Celem ćwiczenia jest określenie stężeń , w których następuje zwiększenie rozpuszczalności dwóch praktycznie nie mieszających się cieczy po dodaniu trzeciego składnika przy założonej temperaturze i wykreślenie izotermy rozpuszczalności na diagramie Gibbsa.
3. Zadane parametry
Na podstawie miareczkowania metanolem roztworu woda-chloroform wyznaczyć punkty na binodzie ograniczające zakres częściowej rozpuszczalności badanego układu trójskładnikowego w temperaturach 22oC i 30oC.
4. Sposób wykonania ćwiczenia
Przeprowadzono dwa miareczkowania w temperaturach 22oC i 30oC. Pierwsze miareczkowanie polegało na umieszczeniu w zlewce znanej objętości (12 cm3) chloroformu z początkową objętością wody destylowanej (0,5 cm3) i wymieszaniu aby wytworzyły się dwie fazy. Taki układ miareczkowano, podczas gwałtownego wytrząsania, metanolem aż do zaniku zmętnienia. Po czym dodawano kolejną porcję wody destylowanej (0,5 cm3) i znowu miareczkowano układ metanolem, aż do zaniku zmętnienia.
Drugie miareczkowanie przeprowadzono w sposób identyczny tylko w naczyniu termostatowanym wodą umożliwiającym utrzymanie odpowiedniej temperatury 30oC.
Wyniki pomiarów zanotowano w tabelach.
dH20=1 [g/cm3] M H20=18,02 [g/mol]
dCHCl3=1,48 [g/cm3] M CHCl3=119,38 [g/mol]
dCH3OH=0,79 [g/cm3] MCH3OH=32,04 [g/mol]
T=22oC
Lp. |
Objętość [cm3] |
% molowy (ułamek molowy) |
% wagowy (ułamek wagowy) |
||||||
|
woda |
chloroform |
metanol |
woda |
chloroform |
metanol |
woda |
chloroform |
metanol |
1 |
0,5 |
12 |
3,5 |
10,57 |
56,50 |
32,93 |
2,38 |
84,43 |
13,18 |
2 |
1 |
12 |
4,8 |
17,21 |
46,01 |
36,78 |
4,43 |
78,71 |
16,86 |
3 |
1,5 |
12 |
5,95 |
21,99 |
39,19 |
38,82 |
6,26 |
74,08 |
19,66 |
4 |
2 |
12 |
7 |
25,68 |
34,32 |
40 |
7,93 |
70,38 |
21,69 |
5 |
2,5 |
12 |
8 |
28,62 |
30,60 |
40,77 |
9,4 |
66,78 |
23,82 |
6 |
3 |
12 |
8,9 |
31,14 |
27,74 |
41,11 |
10,79 |
63,87 |
25,34 |
7 |
3,5 |
12 |
9,75 |
33,29 |
25,42 |
41,28 |
12,08 |
61,27 |
26,65 |
8 |
4 |
12 |
10,55 |
35,19 |
23,51 |
41,30 |
13,28 |
58,97 |
27,75 |
9 |
4,5 |
12 |
11,3 |
36,88 |
21,90 |
41,21 |
14,42 |
56,91 |
28,67 |
10 |
5 |
12 |
12,15 |
38,23 |
20,43 |
41,34 |
15,44 |
54,84 |
29,72 |
11 |
5,5 |
12 |
12,85 |
39,59 |
19,24 |
41,17 |
16,45 |
53,12 |
30,43 |
12 |
6 |
12 |
13,06 |
40,75 |
18,15 |
41,10 |
17,6 |
52,07 |
30,33 |
13 |
6,5 |
12 |
13,76 |
42,50 |
17,47 |
40,03 |
18,49 |
50,52 |
30,99 |
14 |
7 |
12 |
14,46 |
43,46 |
16,59 |
39,95 |
19,33 |
49,04 |
31,63 |
15 |
7,5 |
12 |
15,21 |
44,27 |
15,77 |
39,96 |
20,11 |
47,60 |
32,29 |
16 |
8 |
12 |
15,91 |
45,06 |
15,05 |
39,88 |
20,86 |
46,30 |
32,84 |
17 |
8,5 |
12 |
16,51 |
45,90 |
14,43 |
39,67 |
21,61 |
45,15 |
33,24 |
18 |
9 |
12 |
17,26 |
46,50 |
13,81 |
39,69 |
22,27 |
43,93 |
33,8 |
19 |
9,5 |
12 |
17,91 |
47,16 |
13,27 |
39,57 |
22,92 |
42,85 |
34,23 |
20 |
10 |
12 |
18,61 |
47,72 |
12,75 |
39,52 |
23,53 |
41,79 |
34,68 |
21 |
10,5 |
12 |
19,21 |
48,34 |
12,30 |
39,36 |
24,15 |
40,85 |
35,00 |
22 |
11 |
12 |
20,01 |
48,72 |
11,84 |
39,44 |
24,66 |
39,81 |
35,53 |
23 |
11,5 |
12 |
20,56 |
49,34 |
11,47 |
39,25 |
25,25 |
38,99 |
35,76 |
24 |
12 |
12 |
21,26 |
49,72 |
11,07 |
39,21 |
25,76 |
38,11 |
36,13 |
25 |
12,5 |
12 |
21,86 |
50,20 |
10,73 |
39,07 |
26,28 |
37,33 |
36,39 |
T=33oC
Lp. |
Objętość [cm3] |
% molowy (ułamek molowy) |
% wagowy (ułamek wagowy) |
||||||
|
woda |
chloroform |
metanol |
woda |
chloroform |
metanol |
woda |
chloroform |
metanol |
1 |
0,5 |
12 |
3,26 |
10,8 |
57,9 |
31,3 |
2,4 |
85,2 |
12,3 |
2 |
1,5 |
12 |
1,79 |
16,9 |
45,3 |
37,9 |
4,4 |
78,1 |
17,5 |
3 |
2 |
12 |
1,10 |
,21,7 |
38,8 |
39,5 |
6,2 |
73,6 |
20,1 |
4 |
2,5 |
12 |
1,00 |
25,5 |
34,1 |
40,4 |
7,9 |
69,9 |
22,2 |
5 |
3 |
12 |
1,05 |
28,3 |
30,4 |
41,3 |
9,3 |
66,4 |
24,2 |
6 |
3,5 |
12 |
0,90 |
30,9 |
27,6 |
41,6 |
10,7 |
63,5 |
25,7 |
7 |
4 |
12 |
0,85 |
33,0 |
25,3 |
41,7 |
12,0 |
61,0 |
27,0 |
8 |
4,5 |
12 |
0,80 |
34,9 |
23,4 |
41,7 |
13,2 |
58,7 |
28,1 |
9 |
5 |
12 |
0,85 |
36,5 |
21,7 |
41,8 |
14,3 |
56,5 |
29,2 |
10 |
5,5 |
12 |
0,75 |
38,0 |
20,4 |
41,7 |
15,4 |
54,6 |
30,0 |
11 |
6 |
12 |
0,80 |
39,2 |
19,1 |
41,7 |
16,3 |
52,8 |
30,9 |
12 |
6,5 |
12 |
0,70 |
40,4 |
18,1 |
41,5 |
17,3 |
51,2 |
31,5 |
13 |
7 |
12 |
0,70 |
41,5 |
17,1 |
41,3 |
18,2 |
49,7 |
32,1 |
14 |
7,5 |
12 |
0,70 |
42,5 |
16,3 |
41,2 |
19,0 |
48,3 |
32,7 |
15 |
8 |
12 |
0,75 |
43,4 |
15,5 |
41,1 |
19,8 |
46,9 |
33,4 |
16 |
8,5 |
12 |
0,75 |
44,1 |
14,8 |
41,1 |
20,5 |
45,5 |
33,9 |
17 |
9 |
12 |
0,70 |
44,9 |
14,2 |
41,0 |
21,2 |
44,3 |
34,4 |
18 |
9,5 |
12 |
0,65 |
45,6 |
13,6 |
40,8 |
21,9 |
43,3 |
34,8 |
19 |
10 |
12 |
0,70 |
46,3 |
13,1 |
40,7 |
22,6 |
42,2 |
35,3 |
20 |
10,5 |
12 |
1,10 |
46,5 |
12,5 |
41,0 |
23,0 |
40,9 |
36,2 |
5.Wnioski
Dodawany do układu dwóch nie mieszających się cieczy (wody i chloroformu) metanol zwiększa ich wzajemna rozpuszczalność. Wraz ze wzrostem stężenia wody coraz trudniej osiągnąć roztwór jednofazowy, a łatwiej dwufazowy. Wykres rozpuszczalności cieczy powinien wzrastać wraz ze wzrostem temperatury. Niestety w doświadczeniu wykonanym przez nasz zespół tego faktu nie udało się zaobserwować, prawdopodobnie jest to związane z błędem spowodowanym z trudnością uchwycenia końcowego punktu miareczkowania.
Wyszukiwarka
Podobne podstrony:
Nernst, II rok, chemia fizyczna
sprawozdanie nr 2 (2), II rok, chemia fizyczna
Ćw7.2 treść raportu, z góry, II rok, CHEMIA FIZYCZNA, CHEMIA FIZYCZNA
spr z jodu(2), II rok, chemia fizyczna
Wymagania egz.Chemia Fizyczna, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, CHEMIA FIZYCZ
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
sprawozdanie nr 1, II rok, chemia fizyczna
napięcie nasze, II rok, chemia fizyczna
SPRAWOZDANIE Z CHEMII FIZYCZNEJ, II rok, chemia fizyczna
Nernst, II rok, chemia fizyczna
chemia fizyczna - zestawy pytan, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, r
Zagadnienia - ogólnie, I ROK, II SEMESTR, Chemia Fizyczna
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
test II, TiR UAM II ROK, Geografia fizyczna Polski
test I, TiR UAM II ROK, Geografia fizyczna Polski
więcej podobnych podstron