Robert Maniura
Sprawozdanie z ćwiczenia nr B-12: Wyznaczanie objętości nadmiarowych.
1. Wstęp teoretyczny:
Wśród parametrów opisujących stan układu (p, V, T) oraz funkcji termodynamicznych (U, H, S, F, G) można wyróżnić dwie grupy zmiennych. Zmienne przedstawiające intensywne właściwości układu nie zależą od masy zawartej w układzie: są to ciśnienie (p) i temperatura (T). Wielkości należące do drugiej grupy zmiennych (V, U, H, S, F i G) opisują ekstensywne właściwości układu, zależąc od wielkości masy zawartej w układzie. Zmienne intensywne są funkcjami jednorodnymi rzędu zerowego, zaś zmienne ekstensywne są jednorodnymi funkcjami rzędu pierwszego. Homogeniczna funkcja f rzędu n spełnia tzw. teoremat Eulera, według którego:
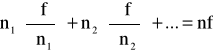
Niech Y oznacza dowolną ekstensywną funkcję termodynamiczną (U, H, S, F, G lub V). W najogólniejszym przypadku będzie ona zależeć od parametrów zewnętrznych (p, T) oraz liczby moli składników (ni):
![]()
Różniczka zupełna tej funkcji ma postać:
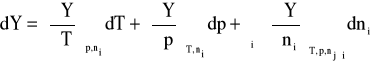
Dla układu dwuskładnikowego, złożonego z rozpuszczalnika i substancji rozpuszczonej, w ustalonych warunkach zewnętrznych (T, p = const) równanie to upraszcza się do postaci:
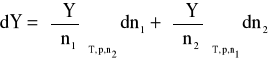
Pochodną cząstkową ekstensywnej funkcji termodynamicznej Y względem liczby moli składnika i przy ustalonych warunkach zewnętrznych oraz liczbach moli pozostałych składników nazywamy cząstkową wielkością molową danego składnika i oznaczamy przez ![]()
.
Cząstkowe molowe funkcje termodynamiczne (![]()
) opisują właściwości substancji w roztworze. Bardzo często interesują nas jednak nie same wartości cząstkowe molowych funkcji termodynamicznych, a jedynie ich zmiany w procesie tworzenia roztworu (mieszaniny) z czystych składników. Zmiany funkcji termodynamicznych w procesie mieszania noszą nazwę termodynamicznych funkcji mieszania, a oznaczać je będziemy przez YM. Z definicji:
![]()
gdzie: ![]()
jest wartścią funkcji termodynamicznej dla roztworu złożonego z n1 moli rozpuszczalnika i n2 moli substancji rozpuszczonej, zaś Y0 jest sumą właściwości termodynamicznej składników przed zmieszaniem: ![]()
w równaniu tym ![]()
i ![]()
są wartościami ekstensywnej funkcji termodynamicznej czystych składników. Termodynamiczne funkcje mieszania odnoszą zatem właściwości roztworów do właściwości czystych składników.
Bardzo interesujące jest odniesienie właściwości roztworów rzeczywistych do właściwości roztworów doskonałych (idealnych).
Właściwości roztworów rzeczywistych porównuje się z właściwościami roztworów doskonałych przez wprowadzenie termodynamicznych funkcji nadmiaru YE:
![]()
w tym równaniu ![]()
, zaś ![]()
Opracowanie wyników:
Gęstości roztworów wyznaczone metodą piknometryczną:
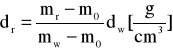
gdzie: d - gęstość roztworu [g/cm3]; mr - masa piknometru wypełnionego roztworem [g]; mw - masa piknometru wypełnionego wodą [g]; m0 - masa pustego piknometru [g]; dw - gęstość wody w temperaturze pomiaru [g/cm3]- w 20 °C wynosi 0,99821 g/cm3
Gęstość roztworów można obliczyć teoretyczne z następującej zależności:
![]()
gdzie: xi = xA
Lp. |
Masa suchego piknometru [g] |
Masa piknometru z wodą [g] |
Masa piknometru z roztworem [g] |
Skład mieszaniny od ułamka molowego alkoholu |
Gęstość wyznaczona metodą piknometryczną [g/cm3] |
Gęstość teoretycznie [g/cm3] |
Błąd procentowy gęstości [%] |
1 |
7,99912 |
12,32925 |
12,32925 (H2O) |
0 |
0,99821 |
0,99100 |
0,73 |
2 |
6,27017 |
12,7107 |
12,20043 |
0,2 |
0,91912 |
0,92016 |
0,11 |
3 |
6,91007 |
10,8999 |
10,39902 |
0,4 |
0,87290 |
0,86728 |
0,65 |
4 |
6,7391 |
11,04926 |
10,33938 |
0,6 |
0,83381 |
0,83235 |
0,17 |
5 |
7,68948 |
11,64908 |
10,89916 |
0,8 |
0,80916 |
0,81539 |
0,76 |
6 |
7,99912 |
12,32925 |
11,39921 (propanol-1) |
1 |
0,78381 |
0,81638 |
3,99 |
Z danych zawartych w tabeli wyznaczam wykres zależności gęstości roztworu od ułamka molowego alkoholu.
Objętości roztworów, masy substancji, liczby moli oraz objętości molowe roztworów w poszczególnych roztworach.
Objętości roztworów obliczyć można z następującej zależności:
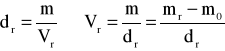
Masy substancji zawartych w roztworach obliczyć można z następujących zależności:
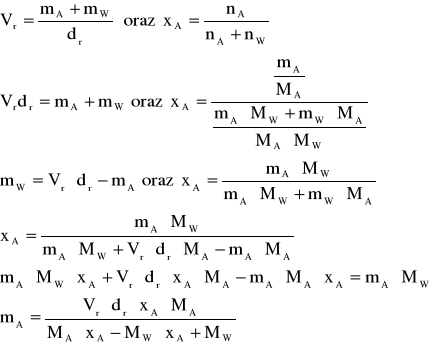
Liczbę moli oblicza się z zależności:
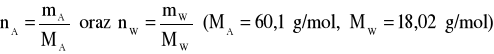
Objętości molowe roztworów wyznaczamy z zależności:
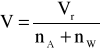
Lp. |
Skład mieszaniny od ułamka molowego alkoholu |
Gęstość dr [g/cm3] |
Masa roztworu (mr - m0) [g] |
Objętość roztworu Vr [cm3] |
Masa alkoholu mA [g] |
Masa wody mW [g] |
Liczba moli alkoholu nA [mol] |
Liczba moli wody nW [mol] |
Objętość molowa roztworu V [cm3/mol] |
1 |
0 |
0,99821 (H2O) |
4,33013 |
4,33789 |
0,00000 |
4,33013 |
0,00000 |
0,24030 |
18,05231 |
2 |
0,2 |
0,91912 |
5,93026 |
6,45208 |
2,69639 |
3,23387 |
0,04487 |
0,17946 |
28,76217 |
3 |
0,4 |
0,87290 |
3,48895 |
3,99698 |
2,40659 |
1,08236 |
0,04004 |
0,06006 |
39,92689 |
4 |
0,6 |
0,83381 |
3,60028 |
4,31789 |
3,00051 |
0,59977 |
0,04993 |
0,03328 |
51,89219 |
5 |
0,8 |
0,80916 |
3,20968 |
3,96670 |
2,98586 |
0,22382 |
0,04968 |
0,01242 |
63,87395 |
6 |
1 |
0,78381 (propanol-1) |
3,40009 |
4,33789 |
3,40009 |
0,00000 |
0,05657 |
0,00000 |
76,67664 |
Z danych zawartych w tabeli wyznaczam wykres zależności objętości molowej roztworu od ułamka molowego alkoholu.
Objętości cząstkowe molowe i objętości nadmiarowe roztworów.
Objętości cząstkowe molowe ![]()
dla roztworów wyznaczam metodą graficzną z wykorzystaniem wykresu zależności objętości molowych roztworów od ułamka molowego. Metoda graficzna polega na przeprowadzeniu stycznych do krzywej w punktach wyznaczonych przez skład roztworów (zależne od ułamka molowego alkoholu).
Objętości nadmiarowe wyznaczone z zależności:
![]()
gdzie: V - objętość molowa roztworów; ![]()
- objętości cząstkowe czystych substancji w odpowiednim roztworze; xi - ułamek molowy substancji w roztworach.
Objętości nadmiarowe mogą być również teoretycznie wyznaczone z zależności:
![]()
gdzie: A0 = -5,8380; A1 = -15,2786; A2 = -22,4778; A3 = -10,8; x1 = xA; x2 = xW.
Lp. |
Skład mieszaniny od ułamka molowego alkoholu |
Objętość molowa cząstkowa alkoholu |
Objętość molowa cząstkowa wody |
Objętość molowa roztworu [cm3/mol] |
Objętość nadmiarowa wyznaczona [cm3/mol] |
Objętość nadmiarowa teoretyczna [cm3/mol] |
Błąd procentowy objętości nadmiarowej [%] |
1 |
0 |
76,37017 |
18,05231 |
18,05231 |
0 |
0 |
0 |
2 |
0,2 |
76,42234 |
17,55766 |
28,76217 |
-0,56842 |
-0,5751987 |
1,18 |
3 |
0,4 |
76,47404 |
16,60601 |
39,92689 |
-0,62634 |
-0,6316339 |
0,84 |
4 |
0,6 |
76,56511 |
16,35596 |
51,89219 |
-0,58926 |
-0,5832115 |
1,04 |
5 |
0,8 |
76,60345 |
14,89362 |
63,87395 |
-0,38753 |
-0,3954099 |
1,99 |
6 |
1 |
76,67664 |
12,2186 |
76,67664 |
0 |
0 |
0 |
Z danych zawartych w tabeli wyznaczam wykres zależności objętości nadmiarowej roztworu od ułamka molowego alkoholu.
Błąd procentowy gęstości propanolu-1:
Gęstość propanolu-1 (wyznaczona) |
Gęstość propanolu-1 (tablicowa) |
Błąd procentowy |
0,78381 |
0,7995 |
1,96 % |
Wnioski:
Przebieg zależności cząstkowych objętości molowych od składu w układzie podwójnym woda - propanol-1 jest typowy. Cząstkowa objętość molowa wody i propanolu-1 nie ulega znacznym zmianom. Objętości nadmiarowe przyjmują wartości ujemne z czego wynika, iż objętość roztworów podczas mieszania zmniejsza się.
Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”.
Lucjan Sobczyk, Adolf Kisza, Kazimierz Gatner, Aleksander Koll „Eksperymentalna chemia fizyczna”
Witold Mizerski „Tablice chemiczne”.
4
Wyszukiwarka
Podobne podstrony:
Wyznaczanie współczynników aktywności, Studia, Politechnika
Wyznacznie objętości nadmiarowych
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
308. Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Pol
potencjal wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Wyznaczanie
309. Wyznaczanie sprawności świetlnej żarówki za pomocą fotometru, studia, studia Politechnika Pozna
Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Politech
Wyznaczanie masy cząsteczkowej metodą ebuliometryczną, Studia, Politechnika
Wyznaczanie masy cząsteczkowej związków wielkocząsteczkowych, Studia, Politechnika
Próbka 5 moli gazu zajmuje objętość 2, Studia, Politechnika
Wyznaczanie SEM metodą kompensacji, Politechnika Lubelska, Studia, Semestr 6, sem VI, Laborka
Wyznaczanie rzędu reakcji metodą graficzną, Studia, Politechnika
Wyznaczanie potencjału zerowego ładunku rtęci w różnych elek, Studia, Politechnika
Wyznaczanie potencjału desorpcji związków powierzchniowo akt, Studia, Politechnika
108. Wyznaczanie modułu Younga metodą ugięcia, studia, studia Politechnika Poznańska - BMiZ - Mechat
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
więcej podobnych podstron