Robert Maniura
Sprawozdanie z ćwiczenia nr 29: Wyznaczanie potencjału desorpcji związków powierzchniowo aktywnych.
Wstęp teoretyczny:
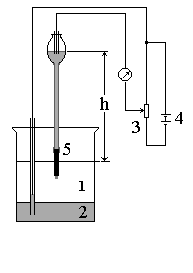
Czas trwania kropli rtęci t1 jest okresem między oderwaniem się dwóch kolejnych kropli rtęci określanym w sekundach. Charakteryzuje on częstość odrywania się kropli rtęci u wylotu kapilary. Pomiar czasu trwania kropli rtęci można wykonać za pomocą przyrządu pokazanego na schemacie rysunek 1: 1. elektrolit podstawowy; 2. elektroda odniesienia np. warstwa rtęci, lub inna elektroda porównawcza; 3. opornica suwakowa; 4. źródło napięcia; 5. kroplowa elektroda rtęciowa (KER);
Szybkość powstawania kropel elektrody rtęciowej nie jest stała i zależy:
od wysokości słupa rtęci h, średnicy i długości kapilary;
od ośrodka, w którym jest zanurzona kapilara - jeżeli wylot kapilary zanurzony jest w cieczy, to liczba kropli w jednostce czasu jest większa niż w powietrzu ze względu za mniejsze napięcie powierzchniowe na granicy faz rtęć- ciecz;
od napięcia powierzchniowego rtęci, które z kolei zależy:
od doprowadzonego do elektrod napięcia;
Wydajność kapilary nie zależy od potencjału elektrody. Wielkość kropli i czas jej trwania zmienia się ze zmianą potencjału elektrody, ponieważ napięcie powierzchniowe rtęci zmienia się charakterystycznie ze wzrostem przyłożonego napięcia przechodząc przez maksimum wartości. Zależność czasu trwania kropli od potencjału elektrody jest związana ze zmianami napięcia powierzchniowego. Zmiany napięcia powierzchniowego w zależności od doprowadzonego potencjału są spowodowane przez powstawanie podwójnej warstwie elektrycznej granicy faz metal - roztwór. Budowę podwójnej warstwy można przedstawić rysunkiem 2.
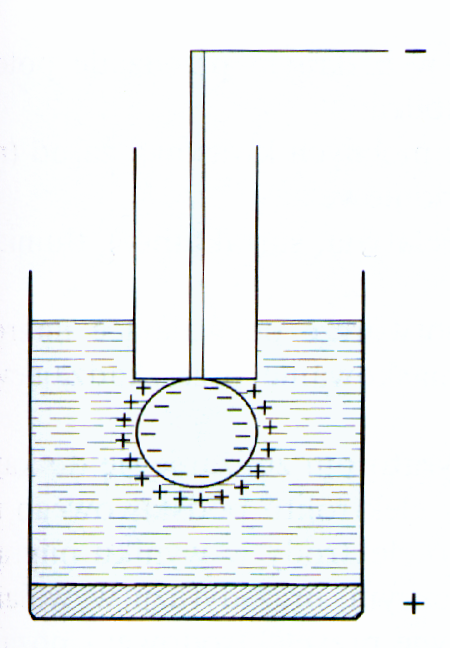
Do chwili osiągnięcia maksymalnej wartości rtęć jest naładowana dodatnio, a po osiągnięciu maksimum ujemnie. W maksimum krzywej osiąga punkt izoelektryczny, nie istnieje podwójna warstwa elektryczna. Odbudowa warstwy elektrycznej przyczynia się do spadku napięcia powierzchniowego. Potencjał przy którym rtęć nie jest naładowana nosi nazwę potencjału zerowego ładunku rtęci lub potencjału maksimum elektrokapilarnego. Gdy znika podwójna warstwa elektryczna, tworzą się wtedy największe krople rtęci (t1 osiąga maksimum). Ponieważ czas trwania kropli jest wprost proporcjonalny do napięcia powierzchniowego, krzywa napięcia powierzchniowego po dobraniu odpowiedniej skali jest jednocześnie krzywą zależności czasu trwania kropli w badanym roztworze w zależności od doprowadzonego potencjału.
Opracowanie wyników:
Dla poszczególnych roztworów dokonano pomiaru czasu trwania 10 kropli rtęci w zakresie napięcia od 0,0 V do -2,0 V co 0,1 V. Na podstawie otrzymanych wyników obliczam czas trwania kropli rtęci:
Dla roztworu 0,1 M KCl
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
0,0 |
2'41” |
16,1” |
-1,1 |
1'38” |
9,8” |
-0,1 |
3'10” |
19” |
-1,2 |
1'36” |
9,6” |
-0,2 |
3'20” |
20” |
-1,3 |
1'32” |
9,2” |
-0,3 |
3'45” |
22,5” |
-1,4 |
1'30” |
9” |
-0,4 |
4'00” |
24” |
-1,5 |
1'27” |
8,7” |
-0,5 |
4'20” |
26” |
-1,6 |
1'24” |
8,4” |
-0,6 |
4'40” |
28” |
-1,7 |
1'19” |
7,9” |
-0,7 |
2'20” |
14” |
-1,8 |
1'12” |
7,2” |
-0,8 |
1'45” |
10,5” |
-1,9 |
1'08” |
6,8” |
-0,9 |
1'43” |
10,3” |
-2,0 |
1'04” |
6,4” |
-1,0 |
1'40” |
10” |
|
|
|
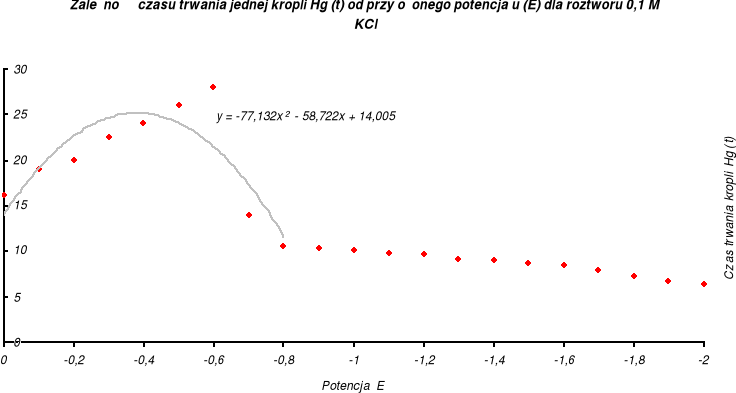
Z danych zawartych w tabeli wyznaczam wykres zależności czasu trwania kropli rtęci od przyłożonego potencjału dla roztworu 0,1 M KCl:
Dla roztworu 0,1 M KCl z 1% tritonem X-100
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
0,0 |
2'00” |
12” |
-1,1 |
1'39” |
9,9” |
-0,1 |
2'03” |
12,3” |
-1,2 |
1'32” |
9,2” |
-0,2 |
2'05” |
12,5” |
-1,3 |
1'30” |
9” |
-0,3 |
2'50” |
17” |
-1,4 |
1'25” |
8,5” |
-0,4 |
2'50” |
17” |
-1,5 |
1'15” |
7,5” |
-0,5 |
2'49” |
16,9” |
-1,6 |
1'12” |
7,2” |
-0,6 |
2'26” |
14,6” |
-1,7 |
1'10” |
7” |
-0,7 |
2'00” |
12” |
-1,8 |
1'08” |
6,8” |
-0,8 |
1'56” |
11,6” |
-1,9 |
1'05” |
6,5” |
-0,9 |
1'48” |
10,8” |
-2,0 |
0'58” |
5,8” |
-1,0 |
1'40” |
10” |
|
|
|
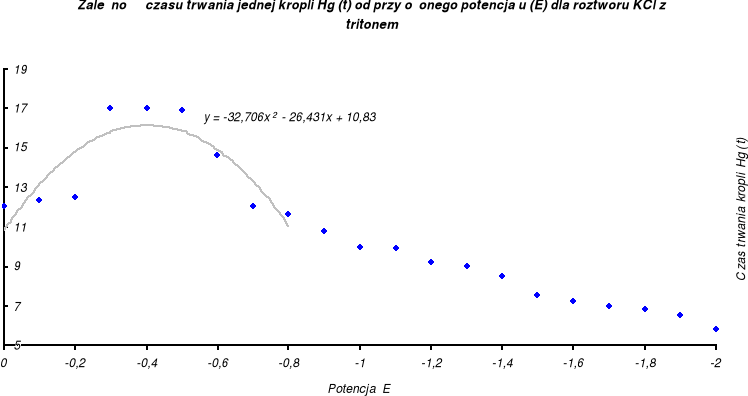
Z danych zawartych w tabeli wyznaczam wykres zależności czasu trwania kropli rtęci od przyłożonego potencjału dla roztworu 0,1 M KCl z 1% tritonem X-100:
Dla roztworu 0,1 M KCl z 1% alfenolem-8
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
Potencjał [V] |
Czas trwania 10 kropel Hg |
Czas trwania 1 kropeli Hg [s] |
0,0 |
1'25” |
8,5” |
-1,1 |
1'24” |
8,4” |
-0,1 |
1'35” |
9,5” |
-1,2 |
1'22” |
8,2” |
-0,2 |
1'38” |
9,8” |
-1,3 |
1'21” |
8,1” |
-0,3 |
1'45” |
10,5” |
-1,4 |
1'17” |
7,7” |
-0,4 |
1'48” |
10,8” |
-1,5 |
1'15” |
7,5” |
-0,5 |
1'35” |
9,5” |
-1,6 |
1'13” |
7,3” |
-0,6 |
1'35” |
9,5” |
-1,7 |
1'05” |
6,5” |
-0,7 |
1'32” |
9,2” |
-1,8 |
0'58” |
5,8” |
-0,8 |
1'30” |
9” |
-1,9 |
0'57” |
5,7” |
-0,9 |
1'29” |
8,9” |
-2,0 |
0'54” |
5,4” |
-1,0 |
1'27” |
8,7” |
|
|
|
Z danych zawartych w tabeli wyznaczam wykres zależności czasu trwania kropli rtęci od przyłożonego potencjału dla roztworu 0,1 M KCl z 1% alfenolem-8:
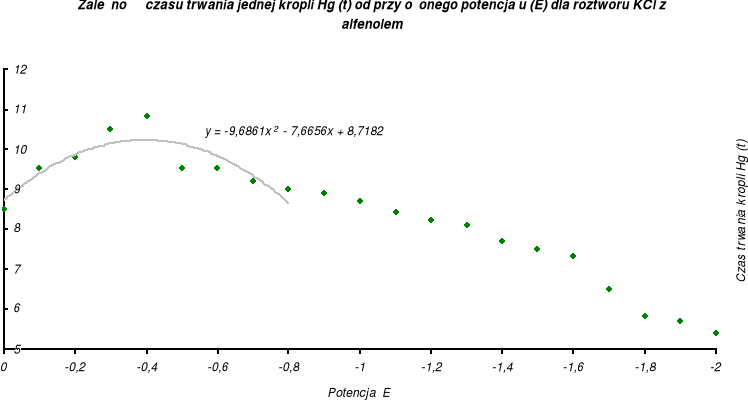
Aby wyznaczyć potencjał desorpcji (E) badanych roztworów wykorzystam równania krzywych z wykresu. Obliczam z równań krzywych pierwsze pochodne i przyrównuję je do zera, obliczając w ten sposób x (maksimum równania krzywej), a zarazem potencjał desorpcji roztworów.
Roztwór |
Równanie krzywej z wykresu |
Pierwsza pochodna równania krzywej |
Przyrównanie pochodnej do zera i obliczenie x
|
Potencjał desorpcji roztworów (z równania krzywej) E |
Potencjał desorpcji roztworów (z wykresu) E |
Błąd procentowy |
0,1 M KCl |
y = -77,132 x2 - 58,722 x + 14,005 |
y' = -154,264 x - 58,722 |
x = -0,3806 |
- 0,38 |
- 0,50 |
31,58 % |
0,1 M KCl + 1% tritonem X-100 |
y = -32,706 x2 - 26,431 x + 10,83 |
y' = -65,412 x - 26,431 |
x = -0,4040 |
- 0,40 |
- 0,40 |
0 % |
0,1 M KCl + 1% alfenolem-8 |
y = -9,6861 x2 - 7,6656 x + 8,7182 |
y' = -19,3722 x - 7,6656 |
x = -0,3957 |
- 0,40 |
- 0,40 |
0 % |
Wnioski.
Na podstawie powyższych wykresów możemy wyznaczyć potencjał desorpcji. Odczytujemy go wprost jako współrzędną odciętą punktu, w którym krzywe osiągają maksimum. Wartość tego potencjału wynosi ok. -0,40 [V] dla tritonu X-100 oraz -0,40 [V] dla alfenolu-8.
4
Wyszukiwarka
Podobne podstrony:
Wyznaczanie potencjału desorpcji związków powirzchniowo akty
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
potencjal wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Wyznaczanie
Wyznaczanie masy cząsteczkowej związków wielkocząsteczkowych, Studia, Politechnika
Wyznaczanie potencjału zerowego ładunku rtęci w różnych elek, Studia, Politechnika
Wyznaczanie bezwzgl dnej aktywno ci promieniowania b v2, Politechnika Lubelska, Studia, Studia, mate
308. Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Pol
309. Wyznaczanie sprawności świetlnej żarówki za pomocą fotometru, studia, studia Politechnika Pozna
Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Politech
Wyznaczanie masy cząsteczkowej metodą ebuliometryczną, Studia, Politechnika
Napięcie powierzchniowe, Studia, Politechnika
Wyznaczanie objętości nadmiarowych, Studia, Politechnika
Wyznaczanie długości fal świetlnych przepuszczanych przez fil, Politechnika Lubelska, Studia, semest
Wyznaczanie rzędu reakcji metodą graficzną, Studia, Politechnika
Wyznaczanie zależności współczynnika załamania światła od stę, Politechnika Lubelska, Studia, semest
Potencjał standardowy elektrody, Studia, Politechnika
108. Wyznaczanie modułu Younga metodą ugięcia, studia, studia Politechnika Poznańska - BMiZ - Mechat
więcej podobnych podstron