CHEMIA
Stężenia roztworów -
- alkalimetria
Wydział: Górnictwo i Geologia Łukasz Piętowski
Kierunek: Inżynieria Bezpieczeństwa Katarzyna Pokora
Semestr II Magdalena Szczybyło
Sekcja VIII
WSTĘP TEORETYCZNY:
Dział analizy miareczkowej nazywany alkacymetrią polega na wykorzystaniu reakcji kwas - zasada i obejmuje dwie grupy metod: alkalimetrię i acydymetrię. Jest znanych kilka teorii tłumaczących istotę pojęcia kwasu i zasady oraz reakcji zachodzących między tymi związkami. Podstawowymi reakcjami w alkacymetrii są reakcje dysocjacji, zobojętniania i hydrolizy.
Teoria Arrheniusa
Kwasy jako związki, które w roztworach wodnych dysocjują z utworzeniem jonów H+, a zasady - jako substancje, które w wyniku dysocjacji tworzą jony OH-.
Moc powstałego kwasu lub zasady określa stała dysocjacji lub rzadziej stopień dysocjacji. Stała dysocjacji jest stosunkiem iloczynu stężeń jonów, na które dysocjuje dany elektrolit, do stężenia cząsteczek niezdysocjowanych w warunkach równowagi. Stopień dysocjacji jest to stosunek liczby cząsteczek zdysocjowanych do ogólnej liczby cząsteczek danego elektrolitu przed dysocjacją. Stopień dysocjacji jest więc liczbą ułamkową (α <1), która określa, jaka część ogólnej liczby cząsteczek elektrolitu przy danym jego stężeniu uległa rozpadowi na jony.
Drugą podstawową reakcją w alkacymetrii jest reakcja zobojętniania, w której z kwasu i zasady powstaje woda i sól.
Reakcją odwrotną do reakcji zobojętniania jest reakcja hydrolizy, która według teorii Arrheniusa przebiega między wodą a solami słabych kwasów i mocnych zasad, solami mocnych kwasów i słabych zasad lub solami słabych kwasów i słabych zasad:
![]()
![]()
Alkalimetria, metoda oznaczania zawartości kwasów w roztworach za pomocą miareczkowania roztworami zasad o znanym stężeniu.
Analiza miareczkowa jest klasyczną metodą analizy ilościowej. Polega ona na pomiarze objętości roztworu o znanym stężeniu (tzw. roztworu mianowanego) zużytego do całkowitego przereagowania z substancją badaną.
Substancje te reagują ze sobą wg ściśle określonej reakcji chemicznej w ilościach równoważnikowych.
Podstawowym zagadnieniem w analizie miareczkowej jest określenie punktu równoważnikowego, tj punktu, w którym przereagowały ze sobą jednakowe ilości równoważników roztworu mianowanego i substancji badanej.
Do określenia tego punktu stosuje się wskaźniki, które zmieniają swoją barwę w obecności niewielkiego nadmiaru odczynnika miareczkującego. Zmiana pH roztworu jest gwałtowna w bezpośrednim sąsiedztwie punktu równoważnikowego.
PRZEBIEG ĆWICZENIA:
Oznaczenie stężenia i ilości kwasu siarkowego
Wykonać trzy równoległe oznaczania. Do kolby stożkowej o pojemności 20 cm3 odmierzyć dokładnie pipetą 10 cm3 badanego roztworu H2SO4. Próbkę rozcieńczyć ok. 50 cm3 wody destylowanej i dodać 3 ÷ 5 kropli oranżu metylowego. Tak przygotowaną próbkę miareczkowa 0,1 mol roztworem NaOH do zmiany barwy wskaźnika z różowej na pomarańczowo-cebulkową. Napisać równanie reakcji. Do obliczeń przyjąć średnią arytmetyczną objętość zużytej zasady z trzech oznaczeń. Obliczyć stężenie molowe badanego roztworu kwasu siarkowego oraz ilość miligramów kwasu siarkowego w badanej próbce.
Objętości zużytego wodorotlenku sodu do miareczkowania 3 równoległych próbek:
V1 = 21,7 cm3
V2 = 19,7 cm3
V3 = 19,5 cm3
![]()
![]()
![]()
![]()
2NaOH + H2SO4 = Na2SO4 + H2O
2 mol NaOH - 1 mol H2SO4
![]()
![]()
![]()
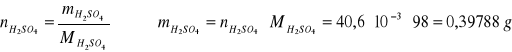
![]()
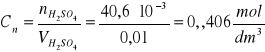
Oznaczenie stężenia i ilości kwasu ortofosforowego
Kwas ortofosforowy H3PO4 jest kwasem trójzasadowym i jego zobojętnianie przebiega trójstopniowo. W obecności oranżu motylowego zachodzi reakcja:
H3PO4 + NaOH ![]()
NaH2PO4 + H2O
w wyniku, której zobojętniony zostaje pierwszy stopień dysocjacji kwasu.
Wobec fenoloftaleiny natomiast zachodzi reakcja:
H3PO4 + 2NaOH![]()
Na2HPO4 + 2H2O
w wyniku, której zobojętniają się dwa równoważniki kwasu fosforowego.
Wykonać dwa równolegle oznaczenia. Do kolby stożkowej o pojemności 200 cm3 dodać 2,5 cm3 badanego roztworu kwasu fosforowego. Próbkę rozcieńczyć ok. 50 cm3 wody destylowanej i dodać 3 ÷ 5 kropli oranżu metylowego. Roztwór badany miareczkować 0,1 mol roztworem NaOH do zmiany barwy wskaźnika z różowej na pomarańczowo-cebulkową.
Objętość zużytego roztworu zasady oznaczyć przez V1. Następnie do częściowo zobojętnionego roztworu dodać 4÷6 kropli fenoloftaleiny i miareczkować dalej 0,1 mol NaOH do zmiany barwy z żółtej na pomarańczową. Objętość zużytego roztworu zasady oznaczyć przez V2.
Objętości zużytego wodorotlenku sodu do podwójnego miareczkowania dwóch równoległych próbek:
V1a = 22,7 cm3
V1b = 17,5 cm3 ![]()
V2a = 29,3 cm3
V2b = 40,1 cm3 ![]()
Stężenie i masę kwasu ortofosforowego obliczam na podstawie reakcji zachodzącej podczas pierwszego miareczkowania.
![]()
![]()
NaOH + H3PO4 = NaH2PO4 + H2O
2 NaOH - 1 mol H3PO4
![]()
![]()
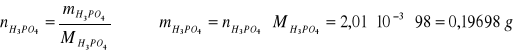
![]()
![]()
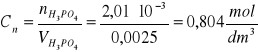
![]()
ZADANIA:
Ile gramów sody Na2CO3 potrzeba do sporządzenia 3 dm3 0,5 molowego roztworu.
Dane: Szukane:
Vr = 3 dm3 ms = ?
Cm = 0,5 mol/dm3
Do wzoru ![]()
podstawiam ![]()
![]()
![]()
![]()
ODP: Do sporządzenia 3 dm3 0,5 molowego roztworu potrzeba Na2CO3.
3. Obliczyć stężenie molowe 20% - roztworu HNO3. Gęstość roztworu wynosi 1,12 g/cm3.
dane: szukane:
Cp= 20% Cm =?
dr =1,12 g/cm3
Rozwiązanie:
![]()
(1) ![]()
(2)
Do wzoru (1) podstawiam: ![]()
i ![]()
:
![]()
(3)
Ze wzoru (2) wyznaczam ![]()
i podstawiam do równania (3):
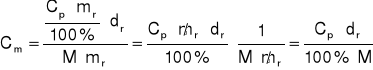
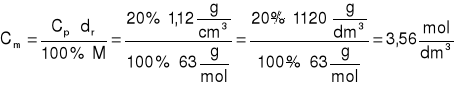
ODP: Stężenie molowe roztworu wynosi 3,56.
4. Jaką ilością wody należy rozcieńczy 100 cm3 20 % H2SO4 o gęstości 1,14 g cm-3 aby otrzymać 5 % roztwór?
Dane: Szukane:
V = 100 cm3 mwody = ?
d = 1,14 g/cm3
Cp = 20%
![]()
5 g kwasu - 15 g wody
114 g kwasu - x g
![]()
ODP: Należy dolać 342 cm3 wody.
5. Do 1 dm3 wody wlano 500 cm3 32 % HNO3 o gęstości 1,2 g/cm3. Obliczyć stężenie procentowe otrzymanego roztworu.
![]()
32 g substancji - 100 g roztworu
x g - 600 g roztworu
![]()
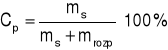
![]()
ODP: Stężenie procentowe otrzymanego roztworu wynosi 12%.
8
![]()
20%
5%
0%
15 g wody
5 g kwasu
Wyszukiwarka
Podobne podstrony:
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Korozja metali, STUDIA
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Klasyfikacja połączeń nieorganicznych - wersja 2, STUDIA
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Klasyfikacja połączeń nieorganicznych - wersja 2, STUDIA
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
CHEMIA LABORATORIUM SPRAWOZDANIE Działanie podstawowych zasad i kwasów na metale wersja 2
Chemia laboratorium sprawozdanie, Studia, chemia, laborki
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Pomiar przewodności elektrolitycznej, STUDIA
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Właściwości fizykochemiczne węgla, STUDIA
CHEMIA LABORATORIUM SPRAWOZDANIE Pomiar przewodności elektrolitycznej wersja 2
Chemia 13.1, Semestr 1, Chemia laboratorium, sprawozdania
FIZYKA - LABORATORIUM - SPRAWOZDANIE - Analiza widmowa - wersja 3, STUDIA
CHEMIA LABORATORIUM NR5-dok, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
sprawozdanie - Entalpia zobojętniania, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, L
Chemia VI, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana, Chemia -
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
cemm, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
więcej podobnych podstron