Sole (otrzymywanie)
Grupa II
ZADANIA NA OCENĘ DOPUSZCZAJĄCĄ
Podaj nazwy kwasu i wodorotlenku, z których w reakcji zobojętniania można otrzymać sól o wzorze Fe(NO3)3 .
....................................................................................................................................................................
....................................................................................................................................................................
(2 pkt)
Podaj wzór tlenku metalu oraz wzór kwasu, z których można otrzymać sól o wzorze CaS.
....................................................................................................................................................................
(2 pkt)
Spośród wymienionych metod otrzymywania soli wybierz taką, której nie można zastosować do otrzymania siarczku sodu:
kwas + metal,
kwas + tlenek metalu,
tlenek metalu + tlenek niemetalu,
sól + sól.
(1 pkt)
Produktami reakcji: ZnO + H2SO4 są (zaznacz jedną poprawną odpowiedź):
siarczan(IV) cynku i wodór,
siarczan(IV) cynku i woda,
siarczan(VI) cynku i wodór,
siarczan(VI) cynku i woda.
(1 pkt)
Która z podanych reakcji może posłużyć jako źródło otrzymywania wodoru na skalę laboratoryjną (zaznacz jedną poprawną odpowiedź):
magnez + chlor,
magnez + kwas solny,
tlenek magnezu + kwas siarkowy(VI),
wodorotlenek magnezu + kwas siarkowy(VI).
(1 pkt)
Uzupełnij równania reakcji o brakujące współczynniki i reagenty:
K2O + ………….→ K2S + H2O
Ca(OH)2 + CO2 → ………… + ………….
…. FeSO4 + …. K3PO4 → Fe3(PO4)2 + …………..
…. NaOH + ZnSO4 → …………. + …………..
(4 pkt)
Uzupełnij równania reakcji o brakujące współczynniki i reagenty:
…… + S → Na2S
PbO + 2 HCl → …….+ ………
Mg(OH)2 + …….. → MgSO4 + …………..
(2 pkt)
ZADANIA NA OCENĘ DOSTATECZNĄ
Zapisz równania reakcji przebiegających według schematu:
Na
Na2O NaCl NaOH
Na2CO3
(4 pkt)
Tlenek sodu rozpuszczono w wodzie, a powstały produkt poddano działaniu kwasu fosforowego(V). Napisz równania reakcji, które zaszły.
(2 pkt)
Zapisz w formie cząsteczkowej oraz skróconej jonowej równanie reakcji między wapniem i kwasem chlorowodorowym (solnym).
(2 pkt)
Przedstaw w formie skróconej jonowej równania reakcji:
Mg + 2 HCl → MgCl2 + H2
Ca(OH)2 + 2HCl → CaCl2 + H2O
(2 pkt)
ZADANIA NA OCENĘ DOBRĄ I BARDZO DOBRĄ
Przeprowadzono cztery doświadczenia:
NaOH FeO MgCl2 Zn
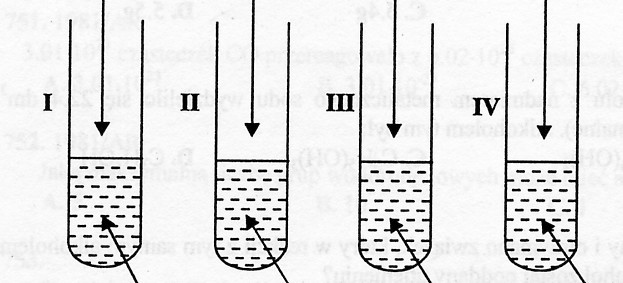
roztwór roztwór roztwór roztwór
H3PO4 H2SO4 K2CO3 H2SO4
Zapisz w formie skróconej jonowej równania zachodzących reakcji chemicznych.
(4 pkt)
Do roztworu azotanu(V) wapnia dodano roztwór siarczanu(VI) potasu, co spowodowało wytrącenie nierozpuszczalnego w wodzie siarczanu(VI) wapnia. Żaden z substratów nie został użyty do tej reakcji w nadmiarze. Jakie jony zawierał roztwór po reakcji?
(1 pkt)
Mangan (Mn) z tlenem tworzy ważny związek, jakim jest tlenek manganu (IV). Tlenek ten wykorzystywany jest do otrzymywania na skalę laboratoryjną chloru (reaguje on z kwasem solnym, tworząc chlorek manganu(II), chlor cząsteczkowy i wodę).
Zapisz równanie tej reakcji.
....................................................................................................................................................................
(1 pkt)
Uzupełnij opis ilustrujący doświadczenie - w oznaczonym prostokątem miejscu wpisz obserwowane spostrzeżenia z przebiegu reakcji oraz zapisz równania dwóch zachodzących reakcji.
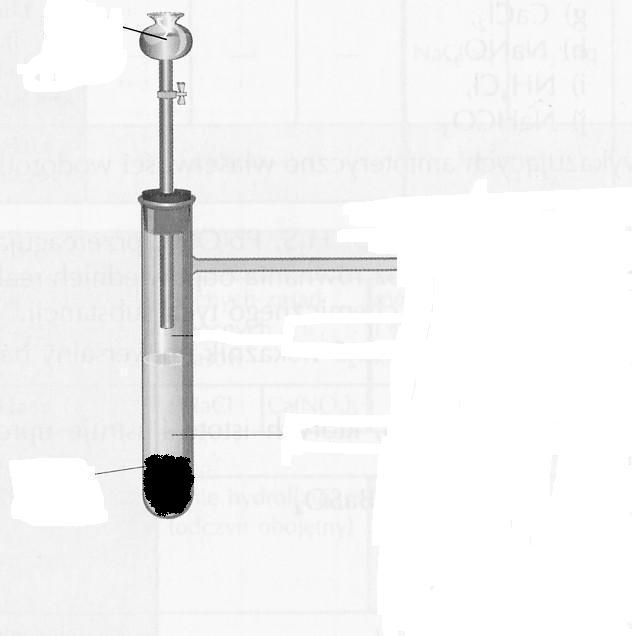
roztwór HCl
![]()
zapalona zapałka umieszczona
przy wylocie probówki
SPOSTRZEŻENIA:
opiłki glinu
Równania reakcji:
..........................................................................................................................................................................
..........................................................................................................................................................................
(3 pkt)
Mając do dyspozycji wyłącznie: sód, węgiel, tlen i wodę, napisz równania reakcji, w których otrzymasz siarczan(IV) magnezu.
....................................................................................................................................................................
....................................................................................................................................................................
....................................................................................................................................................................
....................................................................................................................................................................
(4 pkt)
ZADANIA NA OCENĘ CELUJĄCĄ
W 18 g wody rozpuszczono 1,2 g siarczanu(VI) magnezu. Ile cząsteczek wody przypada na każdą jedną cząsteczkę soli w tak sporządzonym roztworze? (W obliczeniach wykorzystaj zależność
1 u = 1,66 . 10-24 g).
(5 pkt)
W temperaturze 200°C saletra amonowa NH4NO3 rozkłada się, tworząc N2O i H2O.
Napisz równanie tej reakcji.
Oblicz liczbę cząsteczek powstałych gazowych produktów reakcji, jeżeli rozkładowi uległo
2,656 g saletry amonowej (w obliczeniach wykorzystaj zależność 1 u = 1,66 . 10-24 g).
(5 pkt)
III
II
IV
I
Wyszukiwarka
Podobne podstrony:
sole spodoby otrzymywania, Chemia, Gimnazjum, kl2, Sole
4 sole, Studia, Chemia, chemia7
19311-tlenki i kwasy sole i wodorotlenki, chemia
Aldehydy - otrzymywanie, Chemia(1)
19298-kwasy tlenki zasady sole zadania, chemia
sole gim, Chemia, Gimnazjum, kl2, Sole
kartk sole, sprawdziany, chemia
SOLE OTRZYMYWANIE
chemia, OTRZYM~1, SOLE:
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
metody otrzymywania plynow 1, Kosmetologia, Chemia
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
chemia sole
OTRZYMYWANIE PIANEK POLIURETANOWYCH - OCENA CHŁONNOŚCI WODY (3), CHEMIA, Otrzymywanie pianki poliure
Chemia związków wanadu Synteza i analiza chemiczna otrzymanych izopoliwanadów
Chemia nowej ery 2 Kartkówki z doświadczeń Reakcje otrzymywania soli
praktyczny z soli, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
otrzymywanie olejków eterycznych, chemia kosmetyczna
więcej podobnych podstron