Tomasz Seliwiorstow
Wydział Biotechnologii i Nauk o Żywności
Kierunek: biotechnologia
Grupa B2
Ćwiczenie nr 53
Tytuł ćwiczenia : Miareczkowanie pehametryczne
Data wykonania ćwiczenia....................
Data oddania sprawozdania..................
Data zwrotu sprawozdania....................
Data ponownego oddania sprawozdania..............
Wstęp:
Miareczkowanie pehametryczne polega na pomiarze pH miareczkowanego roztworu po dodaniu kolejnych porcji titranta (odczynnika miareczkującego). pH jest to ujemny logarytm z aktywności jonów wodorowych, aH+: pH = - log aH,
Wykres zależności pH roztworu miareczkowanego od ilości dodanego titranta nosi nazwę krzywej miareczkowania pehametrycznego.
Miareczkowanie mocnego kwasu mocna zasadą, np. kwasu solnego ługiem sodowym:
HCI(aq) + NaOH(aq) = NaCI (aq) + H2O(c)
Początkowo zmiany pH roztworu miareczkowanego są. małe. W miarę dodawania roztworu ługu stopniowo ubywa jonów wodorowych, H*, które są zastępowane jonami Na*. W pobliżu punktu stechiometrycznego następuje gwałtowna zmiana pH. W tym punkcie stężenie jonów wodorowych jest takie jak w czystej wodzie, a odpowiadające temu stężeniu pH = 7. Po przekroczeniu punktu równoważnikowego dodatek zasady prowadzi do dalszego wzrostu pH roztworu, ze względu na przyrost stężenia jonów OH".
Miareczkowanie słabego kwasu mocna zasadą
W czasie miareczkowania słabego kwasu, np. kwasu octowego mocną zasadą, np. NaOH stężenie jonów H+ w roztworze zależy od stopnia dysocjacji tego kwasu. Dodanie titranta przeprowadza część kwasu w sól (czyli według teorii Bronsteda sprzężoną z nim zasadę) zgodnie z reakcją:
CH3COOH(aq) + OH-(aq) = CH3COO-(aq) + H20
W każdym punkcie miareczkowania ustala się stan równowagi opisanej stałą równowagi Ka:
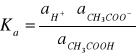
Jeśli pominiemy niewielki ubytek stężenia CH3COOH spowodowany jego dysocjacją oraz założymy, że aktywność niezdysocjowanego kwasu, aCH3COOH, jest równa jego stężeniu w roztworze, [kwas], a ponadto, że współczynnik aktywności jonów octanowych w roztworze jest zbliżony do 1, to możemy napisać, że aktywność, aCH3COO, jest w przybliżeniu równa stężeniu jonów octanowych w roztworze, [sól]. Stąd mamy:
![]()
![]()
Logarytmując ostatnie równanie i zmieniając znak po obu stronach dochodzimy do równania Hendersona-Haselbacha
![]()
![]()
W połowie drogi miareczkowania, gdy zobojętniona jest połowa wyjściowej ilości kwasu, stężenia kwasu i zasady są sobie równe, wtedy pH ≈ pKa. W punkcie równoważnikowym ilość dodanej zasady odpowiada wyjściowej ilości kwasu. W punkcie tym roztwór ma odczyn zasadowy. Dodanie następnych porcji zasady powoduje dalszy wzrost pH roztworu badanego. Położenie punktu równoważnikowego wyznacza się określając punkt przegięcia na krzywej miareczkowania, w którym przyrost pH jest najszybszy. Dokładniej punkt ten można wyznaczyć rysując krzywą pochodną
![]()
której maksimum określa równowagową objętość dodanego ługu, (VNaOH)równ-
Zasada pomiaru pH. Do pomiarów pH wykorzystuje się ogniwo zbudowane z elektrody pomiarowej, którą jest elektroda szklana i elektrody odniesienia, którą jest elektroda kalomelową. Elektrody zanurzone są w roztworze badanym o nieznanym stężeniu jonów wodorowych. Potencjał elektrody szklanej wyrażony wzorem:
![]()
jest liniową funkcją aktywności jonów wodorowych, a potencjał elektrody odniesienia jest stały, niezależny od pH roztworu. Siła elektromotoryczna takiego ogniwa wynosi:
![]()
ponieważ w temperaturze 25°C iloraz 2,3 ![]()
= 0,059, jeśli przyjmiemy ponadto, że: ![]()
; to: ![]()
Zgodnie z powyższym równaniem E jest liniową funkcją pH. Zmiana pH o jednostkę wywoła zmianę SEM tego ogniwa o 0,059 V. Przyrządy używane do pomiarów pH nazywane pehametrami są bezpośrednio wyskałowane w jednostkach pH. Ze względu na to, że parametr A we wzorze na potencjał elektrody szklanej zależy od jej budowy, a także zmienia się w czasie, konieczne jest kalibrowanie pehametru przy pomocy roztworów-buforowych, do tego celu może być stosowany np. 0,05 M kwaśny ftalan potasu, który w temp. 25°C ma pH = 4,00.
Tabela wyników
Mocny kwas |
|
VNaOH [ml] |
pH |
0 |
1,86 |
0,5 |
1,87 |
1 |
1,92 |
1,5 |
1,95 |
2 |
2,00 |
2,5 |
2,08 |
3 |
2,16 |
3,5 |
2,28 |
4 |
2,45 |
4,5 |
2,63 |
4,7 |
3,38 |
4,9 |
3,42 |
5,0 |
3,46 |
5,2 |
6,67 |
5,3 |
8,79 |
5,4 |
9,86 |
5,5 |
10,26 |
5,6 |
10,50 |
5,7 |
10,70 |
5,8 |
10,88 |
5,9 |
10,96 |
6,0 |
11,13 |
6,1 |
11,20 |
6,3 |
11,25 |
6,5 |
11,39 |
6,7 |
11,41 |
7,0 |
11,48 |
7,5 |
11,55 |
8,0 |
11,62 |
8,5 |
11,68 |
9,0 |
11,72 |
9,5 |
11,76 |
10,0 |
11,80 |
10,5 |
11,81 |
11,0 |
11,82 |
11,5 |
11,83 |
12,0 |
11,85 |
12,5 |
11,87 |
Słaby kwas |
|
VNaOH [ml] |
pH |
0 |
1,90 |
0,5 |
1,92 |
1 |
1,95 |
1,5 |
1,99 |
2 |
2,03 |
2,5 |
2,08 |
3 |
2,13 |
3,5 |
2,20 |
3,7 |
2,23 |
3,9 |
2,26 |
4,1 |
2,30 |
4,3 |
2,34 |
4,5 |
2,37 |
4,7 |
2,41 |
4,9 |
2,47 |
5,1 |
2,53 |
5,3 |
2,60 |
5,6 |
2,73 |
5,8 |
2,83 |
6 |
2,99 |
6,2 |
3,37 |
6,4 |
3,56 |
6,6 |
3,95 |
6,8 |
4,16 |
7 |
4,31 |
7,2 |
4,43 |
7,4 |
4,52 |
7,6 |
4,61 |
7,8 |
4,68 |
8,1 |
4,75 |
8,6 |
4,88 |
9,1 |
5,00 |
9,6 |
5,13 |
10,1 |
5,23 |
10,6 |
5,36 |
11,1 |
5,48 |
11,6 |
5,60 |
12,1 |
5,75 |
12,6 |
5,96 |
13,1 |
6,33 |
13,5 |
6,75 |
13,7 |
8,27 |
13,8 |
9,32 |
13,9 |
10,09 |
14,0 |
10,30 |
14,2 |
10,63 |
14,4 |
10,83 |
14,9 |
11,11 |
15,4 |
11,31 |
15,9 |
11,39 |
16,4 |
11,47 |
Wykres zmiany pH od objętości zasady
Wykres pochodnej krzywej miareczkowania od objętości dodanej zasady
Obliczam liczbę moli mocnego kwasu i stężenie molowe roztworu wyjściowego
Wykres zmiany pH podczas miareczkowania mocnego i słabego kwasu od objętości zasady
Wykres pochodnej krzywej miareczkowania od objętości dodanej zasady
Obliczam liczbę moli obu kwasów oraz stężenie molowe wyjściowe roztworów kwasów
Uwagi i wnioski
Metodą miareczkowania pehametrycznego wyznaczyć można zarówno stężenie pojedynczego kwasu, jak również stężenie kwasów słabego i mocnego w mieszaninie W przypadku miareczkowania mieszaniny słabego i mocnego kwasu konieczne jest dodanie acetonu, ze względu na istnienie zjawiska rozdziału słabego kwasu organicznego między fazę wody i acetonu. Ma to na celu częściowy rozdział mieszaniny kwasów, w wyniku, czego można wyznaczyć dwa punkty równoważnikowe
0
2
4
6
8
10
12
0,5
2
3,5
4,1
4,7
5,3
6
6,6
7,2
7,8
9,1
10,6
12,1
13,5
13,9
14,4
Serie1
Wyszukiwarka
Podobne podstrony:
konspekt 53(1), BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
53, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konsp15, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 45miki, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ch.f.44, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
hasz, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
SPRAWOZDANIE 54, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Cwiczenie 5, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawko 77, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ćwiczenie 45 kula, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron