Kucaba Janusz 26.11.2005r.
I TD
Sprawozdanie z ćw. nr 5
Wyznaczanie wartości 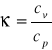
dla powietrza metodą
Clementa i Desormesa.
I. Zagadnienia do samodzielnego opracowania.
1. Ciepło właściwe gazu . Definicja Cp i Cv .
Gazami nazywamy substancje charakteryzujące się dużą ściśliwością oraz dużą rozprężliwością .
Ciepłem właściwym lub pojemnością cieplną wlaściwą nazywamy stosunek ilości ciepła Q pobranego do masy m ukladu oraz do zmiany temperatury wywołanej pobraniem ciepła .
c=Q/m⋅ΔT [J/kg⋅K]
C=Q/n⋅ΔT [J/mol⋅ K]
Między C i c zachodzi związek : C=m⋅c
Rozróżnia się ciepło właściwe przy stałym ciśnieniu cp oraz przy stałej objętości cv
Dla gazów zachodzi związek :
Cp - Cv=R
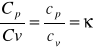
adiabatyczny .
2. Równanie Poissona - proces adiabatyczny .
Jeśli dQ=0 , to I zas. termodyn. przyjmuje postać:
dU=dW
dW=-p⋅dV
p=R⋅T/V
Z powyższego otrzymujemy :
-R⋅dV/Cv ⋅V=dT/T
R=Cp - Cv , κ=Cp/Cv
-(κ-1)dV/V = dT/T
Po scałkowaniu otrzymujemy :
-(κ-1)⋅[ lnV2-lnV1 ] = [ lnT2-lnT1 ]
Stąd :
V2κ-1 ⋅T2=V1κ-1 ⋅T1 lub Vκ-1 ⋅ T= const
Wówczas :
pκ-1/T κ= const lub p⋅Vκ= const
3. Przemiany : izotermiczna , izochoryczna , izobaryczna .
a) gdy T= const zachodzący proces nazywa się izotermicznym ; zależność ciśnienia od objętości podaje prawo Boyle'a i Mariotte'a : p⋅V= const
b) gdy p= const zachodzący proces nazywa się izobarycznym ; zależność objętości od temperatury podaje prawo Gay-Lussaca : V/T= const
c) gdy V= const zachodzący proces nazywa się izochorycznym ; zależność ciśnienia od temperatury podaje prawo Charlsa : p/T= const
Opis ćwiczenia.
W pomieszczeniu w którym panuje stała temperatura pokojowa T0=const. i ciśnienie atmosferyczne p0=const.
znajduje się zamknięta butla B z powietrzem
o objętości V. Jest ona połączona z manometrem i pompką poprzez rurki z kurkami.
Ciśnienie p gazu w butli niech będzie nieco wyższe od ciśnienia p0 przy czym p1=po+h1, gdzie h1 jest ciśnieniem hydrostatycznym wywieranym przez różnicę poziomów cieczy manometrycznej. Masa gazu w butli będzie równa m. Jeżeli otworzymy kran k1 i zamkniemy go z chwilą zrównania się ciśnienia gazu z ciśnieniem atmosferycznym, to powietrze rozpręży się adiabatycznie. Podczas szybkiego rozprężania się gazu nie pobiera on ciepła z otoczenia i sam oziębi się do temperatury T2. Objętość masy gazu będzie teraz V1<V2 ponieważ część gazu opuści butlę. Po zamknięciu kurka gaz zaczyna się ogrzewać do temperatury otoczenia, a jego ciśnienie wzrasta. Manometr wykazuje nadwyżkę ciśnienia.
Wykonanie ćwiczenia.
Przyrządy: butla szklana, pompka tłocząca, manometr.
Kolejność czynności:
Zamknąć kurek k1 i zagęszczać w butli powietrze za pomocą pompki do momentu, gdy różnica poziomów cieczy manometrycznej wyniesie kilka podziałek.
Odczekać kilka minut, by różnica poziomów w manometrze ustaliła się, odczytać ją i oznaczyć h1.
Otworzyć kurek k1 aby ciśnienie w butli wyrównało się z ciśnieniem atmosferycznym.
Odczekać kilka minut, aż wskazania manometru ustalą się. Zapisać nadwyżkę ciśnienia h2. Obliczyć wartość κ.
W celu osiągnięcia lepszej dokładności należy pomiary wykonać kilkakrotnie (w naszym przypadku 6 pomiarów), za każdym razem ponawiając sprężenie gazu.
Przeprowadzić obliczenia błędów metodą różniczkową.
IV. Tabela pomiarowa.
Lp. |
h1 |
h2 |
h1-h2 |
κ |
κ ± Δκ |
|
[ mm ] |
[ mm ] |
[ mm ] |
[ - ] |
[ - ] |
1 |
9 |
2 |
7 |
1,28 |
1,28±0.04 |
2 |
16 |
3 |
13 |
1,23 |
1,23±0,02 |
3 |
14 |
3 |
11 |
1,27 |
1,27±0,03 |
4 |
16 |
3 |
13 |
1,23 |
1,23±0,02 |
5 |
17 |
3 |
15 |
1,21 |
1,21±0,02 |
6 |
18 |
3 |
15 |
1,2 |
1,2±0,02 |
7 |
15 |
3 |
12 |
1,25 |
1,25±0,03 |
8 |
16 |
3 |
13 |
1,23 |
1,23±0,02 |
Obliczenia.
1. Obliczam różnicę wysokości h1-h2
2. Obliczam wartość współczynnika ![]()
![]()
![]()
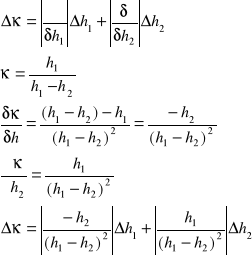
![]()
5. Wnioski:
Korzystając ze wzoru ![]()
otrzymaliśmy wartość wykładnika adiabatycznego . Jego wartość średnia wyniosła 1.24 , natomiast błąd z pomiarów wynosi 0.025 .
Rzeczywista wartość κ dla powietrza wynosi 1.4 . Wartość ta nie mieści się w granicach otrzymanego przez nas błędu. Najprawdopodobniej było to spowodowane nieszczelnością układu( zaworu ): po zagęszczeniu powietrza w butli i odczekaniu kilkunastu minut ciśnienie w butli zrównało się niemal z ciśnieniem atmosferycznym. .
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
SiS strona tytulowa spr, Prz inf 2013, I Semestr Informatyka, Fizyka, Wykłady-Fizyka, Sygnały i Syst
Tabela pomiarowa, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare
tabele 1B+, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b
ćw 23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, Fizyka Dam
Ćwiczenie nr 44 prawie dobre ale juz teraz lux, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA
ćw 1 obliczenia, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
obliczenia ćw23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Ćwiczenie nr 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Wstęp teoretyczny ćw 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium
pierwsza strona sprawozdania własne, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki,
pierwsza strona sprawozdania, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laborat
Ćwiczenie 47, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DUZO, laboratorium
sprawko1bwstę pteoretyczny, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laborator
spr.23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, Fizyka Da
więcej podobnych podstron