35. omówić pojęcie e mocy
kwasów i zasad;
Moc kwasu- ilościowa miara
jego chemicznej siły działania. Miarą tej mocy jest zazwyczaj minus logarytm dziesiętny ze stałej dysocjacji kwasu w danych warunkach, oznaczany skrótem pKa-
pKa=-log10[Ka]
Gdzie Ka to stała dysocjacja kwasu.Czym pKa jest mniejsze tym moc kwasu jest większa.
Np. dla kwasu solnego w wodzie:
HCL+H2O->H30++Cl-
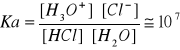
A zatem pKa kwasu solnego w wodzie wynosi-7Moc kwasów w tych samych warunkach zewnętrznych zależy od ich struktury chemicznej. W przypadku prostych kwasów nieorganicznych, zarówno w
tych zawierających tlen w swojej strukturze np. H2SO4 jak i beztlenowych
( np. HCL) moc kwasu wzrasta wraz ze spadkiem elektroujemności centralnego
atomu w reszcie kwasowej.
W przypadku kwasów organicznych zależności te są bardziej złożone. Moc zasad- ilościowa miara jej chemicznej siły działania. Miarą tej mocy jest zazwyczaj
minus logarytm dziesiętny ze stałej dysocjacji zasad w danych warunkach oznaczany skrótem pKb- pKb=-log10[Kb]
Gdzie Kb stała dysocjacji zasad. Im pKb jest mniejsza tym moc zasady jest większa
Np. dla NaOH
NaOH->Na+OH-
Kb=[Na+][OH-]/[NaOH]>1014 , pKb< -14
Kb mocnych zasad (NaOH, KOH itp.) w wodzie jest na tyle duża ze nie da się
ich zmierzyć żadnymi znanymi metodami,
dlatego trudno jest porównać ich moc i przyjmuje się ze wszystkie silne zasady
posiadają mniej więcej jednakową moc. Dopiero w przypadku słabszych zasad jest sens porównywać ich moc, relacja miedzy ich
mocą i struktura chemiczną jest złożona.
36.Podać sposoby wyrażania stężeń - obliczenia;
Stężenie % to udział związków chemicznych w
mieszaninach i roztworach wyrażanych w procentach. Stężenie %roztworu Cp jest
określone liczbą jednostek
masowych (mg, g, kg, Mg) substancji rozpuszczonej zawartych w 100 jednostkach
masowych(mg, g, kg,Mg) roztworu.
![]()
Np. Oblicz stężenie %roztworu otrzymanego
ze zmieszania 20 soli NaCl i140g wody.
Rozwiązanie; Masa roztworu jest sumom masy substancji rozpuszczanej i masy rozpuszczalnika:
20g+140g=160g wiec: w 160g roztworu znajduje się20g NaCl, a w 100g roztworu
znajduje się x g cukru
X=20*100/160=12,5g
W 100g roztworu znajduje się 12,5g NaCl a wiec roztwór jest 12,5%.
Stężenie molowe -roztwór związków chemicznych to liczba moli danego związku
jaką zawiera 1 dm3 danego roztworu. Stężenie molowe jest równe stosunkowi
liczb moli n substancji rozpuszczanej do objętości roztworu. Jednostką stężenia
molowego w układzie SL jest mol/dm3. określenie roztworu jako n- molowy oznacza ze jego stężenie molowe wynosi n mol/dm3. stężenie molowe zależy od tem. gdyż obiętosc roztworu zmienia się wraz z tem.
Wzór:
![]()
Cm= stężenie molowe [mol/dm3]
n= liczba moli związku chemicznego [mol]
Vr = objetość roztworu [dcm3]
ms = masa substancji rozpuszczanej [g]
M = masa molowa substancji rozpuszczanej [mol/dcm3]
38. omówić 1 i 2 zasadę
termodynamiki dla układu
chemicznego;
1-zasada termodynamiki-to
zasada zachowania energii czyli ze energia nie może pojawic się znikąd; U=Q=W
Istnieją różne sformułowania
tej zasady, zależy od sytuacji:
1)Sformułowanie najbardziej ogólne: Energia wewnętrzna układu zamkniętego nie zmienia się, niezależnie od przemian zachodzących w tym układzie.2)sformułowanie dla procesów-mechanicznych: Zmiana energii wewnętrznej jest równa sumie pracy
wykonanej przez układ bądź nad układem i ciepła dostarczanego lub oddanego przez układ.
Zasada zachowania energii-w układzie zamkniętym suma składników wszystkich rodzajów energii całości
(suma energii wszystkich jego czesci) układ jest stała nie zmienia się w czasie.
2-zasada termodynamiki-stwierdza ze w układzie termodynamicznie izolowanym, istnieje funkcja stanu zwana entropią S,
której zmiana ![]()
S w procesie adiabatycznym
spełnia nierówności ![]()
przy czym równość zachodzi
wtedy i tylko w tedy gdy proces jest odwracalny. Można to wyrazić tez tak:
w układzie termodynamicznie izolowanym w dowolnym procesie entropia nigdy nie maleje. Gdy p,= const kierunek samorzutnej
przemiany jest kierunkiem zmniejszającej się entalpii swobodnej
Gdy p,T=const entlapia swobodna
![]()
Gdy V,T=const energia swobodna
![]()
39.Przedstawic prawa termochemii-
Hessa i Kirchoffa
Prawo Hessa- zwane tez prawem stałej sumy ciepła, sformułowane w 1840r.
Przez Germana Henri Hessa mówi ze; Ciepło reakcji chemicznej przebiegającej w
stałej objętości lub pod stałym ciśnieniem nie zależy od tego jaką drogą przebiega
reakcja, a jedynie od stanu początkowego i końcowego. Oznacza to ze ciepło reakcji
nie zależy od tego czy produkty otrzymano
z substratów bezpośrednio czy poprzez dowolne etapy pośrednie. Jeżeli w trakcie
reakcji nie występuje praca użyteczna wówczas ciepło przemiany będzie zależało
jedynie od stanupoczątkowego i końcowego. Prawo Hessa jest konsekwencją prawa
zachowania energii w reakcjach chemicznych.
Prawo Hessa pozwala w pośredni sposób wyznaczyć wielkości termodynamiczne,
których nie da się zmierzyć doświadczalnie np. ciepła tworzenia węglowodorów,
na podstawie łatwych do zmierzenia ciepeł spalania.
Prawo Kirchhoffa- określa zależność standardowej
entalpii reakcji od tem. przy stałym ciśnieniu:
ΔHor(T2) =ΔHro(T1) +∫T1T2 ΔrCropm(T)dT
ΔHor(Ti) - standardowa entalpia reakcji w tem TI
ΔrCop,m(T) -zależność zmiany w trakcie reakcji standardowych molowych pojemności cieplnych od tem. Zostało ono sformułowane przez G. Kirchhoffa, wynika z samej definicji molowych
pojemności cieplnych pod stałym ciśnieniem:
![]()
Uproszczona postać prawa G. Kirchhoffa
Przy założeniu ze pojemności cieplne reagentów
i ciepła molowe reagentów nie zależą od tem.
prawo to można uprościć do postaci:
ΔHor(T2)= ΔHor(T1)+(T2-T1)* ΔrCop,m(T1)
Założenie upraszczające sprawdza się, gdy różnica obu tem. jest niewielka oraz gdy w
danym zakresie tem. nie występuje dla żadnego z reagentów przemiana fazowa.
40.Podac sposoby wyrażania ciepła procesu chemicznego przy p=const.
Ciepło- jest to cześć energii wewnętrznej układu, której źródłem jest energia kinetyczna ruchu cząsteczekprzekazywanie energii chaotycznie poruszających się cząsteczek konieczna różnica tem.
P=const Qp=Cp x ၄T
V=const Qv=Cv x ၄T
Cp,Cv - ciepła molowe
Dla reakcji 2H2(g)+O2(g)=2H2O(I)
Ciepło procesów izobarycznych jest równa zmianie entalpii.
41.Wyjaśnic pojęcie potencjału termodynamicznego;
Są to wielkości fizyczne związane z układem termodynamicznym mające wymiar energii. Nazywane są potencjałami ponieważ są odpowiednikami energii potencjalnej w mechanice. Cztery najczęściej używane potencjały termodynamiczne określone są dla złożonych stałych nie zmieniających się par parametrów przemiany termodynamicznej(S,V) lub(T,V)lub (S,P)lub (T,P)
Gdzie T- tem., S= entropia, P= ciśnienie, V= objętość, Ni-liczba cząsteczek typu i.
W układach w których liczba cząsteczek poszczególnych typów nie zmienia się parametr ten jest ignorowany.
Entalpia-oznaczana jako H lub X jest określeniem lub opisem potencjału termodynamicznego układu, który może być używany do obliczeń użytecznej pracy możliwej do otrzymania z zamkniętego układu termodynamicznego przy sałym ciśnieniu.
43.Omówić reakcje utleniania i redukcji-bilansowanie.
Utlenianie-to reakcja chemiczna w której jakiś atom lub ich grupa przechodzi z niższego na wyższy stopień utleniania. Nazwa ta ma charakter bardzo umowny, gdyż w praktyce każdej reakcji utleniania musi towarzyszyć jakaś reakcja redukcji. Łącznie takie procesy nazywa się reakcjami redoks. W praktyce daną reakcje nazywa się utlenianiem, gdy struktura głównego substratu i głównego produktu różnią się tylko tym ze jedna niewielka grupa lub pojedynczy atom zwiększył w jej wyniku swój stopień utleniania kosztem redukcji prostego związku zwanego w tym przypadku sierodkiem utleniającym np.:
CH3CH2OH+O2->CH3COOH+H2O
Redukcja-to proces w trakcie którego atom lub ich grupa przechodzi z wyższego na niższy stopień utleniania. Każdej redukcji musi towarzyszyć utlenianie. Taki proces nazywa się reakcjami redoks. W praktyce daną reakcję nazywamy reakcją redukcji , gdy struktura głównego substratu i produktu różnią się tylko tym ze jedna niewielka grupa lub pojedynczy atom zmniejszył w jej wyniku swój stopień utleniania, kosztem utleniania , zwykle nieorganicznego, prostego związku zwanego w tym przypadku środkiem redukcyjnym. Np. w reakcji
Stopnie utleniania:0 +1 +6 -2 +1+6-2 +4-2
2Ag+H2SO4-> Ag2 SO4+SO2+H2O
Redukcja z +6 stopnia utleniania na +4 podlega siarka, a w reakcji HCHO(aldehyd mrówkowy) +ALH3(wodorek glinu, środek redukujący)-AL.(OCH3)3(metanolan glinu) właściwa reakcja utleniania i redukcji.
AL(OCH3)3(metanolan glinu)+3H2O-3CH3OH(alkohol metylowy) +AL.(OH)3 redukcja zobojętniania kwasu zasadą redukcji podlega węgiel ( C) który przechodzi z 0 do -2 stopnia utleniania,jednocześnie utlenianiu podlega wodór(H) z -1do +1 stopnia utleniania .Silnymi środkami redukcyjnymi są wodorki metali alkalicznych, wodoroslany, wodoroborany, wodorosiarczki i ich kombinacje.
44.Wyjasnic pojęcie potencjału standardowego elektrody
Jest to potencjał elektrody po między katodą i anodą lub względem elektrolitu(potencjał jednostkowy). Podstawą każdego ogniwa galwanicznego jest zawsze reakcja redoks, którą można rozbić na połówkowe reakcje utleniania(utraty elektronów przez anodę) i reakcje redukcji( przyjmowanie elektronów na katodzie). Przepływ prądu w ogniwie jest spowodowany różnicą potencjałów na katodzie i anodzie. Potencjał jednej elektrody jest nazywany jej potencjałem elektrochemicznym. Absolutny potencjał elektrochemiczny jest niemożliwy do zmierzenia gdyz aby zbadać prąd generowany potencjalnie przez jedną elektrodę trzeba ją zestawić z inną elektrodą w ogniwo. Z tego względu powstało pojęcie sztandarowego potencjału elektrochemicznego. Potencjał ten mierzy się względem standardowej elektrody wodorowej, dla której umownie przyjęto ze jej standardowy potencjał wynosi 0. Potencjał elektrochemiczny ten zmienia się z tem. i ciśnieniem dlatego pomiar potencjału standardowego przeprowadza się w warunkach standardowych.
Równanie Nersta- podstawowa zależność elektrochemiczna wyrażająca potencjał elektrody(E) względem jej potencjału standardowego(E0)
Ogólna postać równania:![]()
Lub dla tem. 298K i rozcięczonych roztworów, przy założeniu, że współczynnik aktywności jonów jest równy1:![]()
.R- stała gazowa równa8.314 JxK-1 mol-1
.T- tem. wyrażana w kalwinach.z-liczba elektronów wymienianych w reakcji połówkowej.a-aktywność molowa indywiduów chemicznych biorących udział w reakcji elektrodowej.F- stała Faradaya równa 96485 Cxmol-1[red]-stężenie molowe formyzredukowanej[ox]-stężenie molowe formy utlenianej
45. Wyjaśnic przydatność szeregu napięciowego do określenia właściwości produktu.Szereg napięciowy metali (inaczej szereg elektro chemiczny, szereg aktywności metali) to zestawienie pierwiastków chemicznych o własnościach metalicznych, według ich potencjału standardowego Eo .
Punktem odniesieni dla tego zestawienia jest elektroda wodorowa, której potencjał standardowy przyjmuje się umownie za 0. Praktyczne znaczenie szeregu napięciowego metali wynika z faktu, ze metal bardziej aktywny wypiera (poza niektórymi wyjątkami) metal mniej aktywny z roztworu jego soli, zaś dobrą miarą aktywności chemicznej metali jest ich potencjał standardowy. Szereg ważniejszych metali uporządkowany w kierunku wzrostu potencjału i zarazem spadku aktywności do tworzenia kationów: Li K Na Ca Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Cu Ag Hg Au
Wnioski wynikające z szeregu napięciowego metali . Każdy metal o niższym potencjale normalnym wypiera z roztworu soli metal o wyższym potencjale. Reguła ta nie dotyczy litowców i berylowców, które nie wypierają innych metali z wodnych roztworów, gdyż pierwszeństwo ma reakcja z wodą prowadząca do otrzymania wodorotlenków. Jedynie magnez i beryl, które reagują z woda na gorąco mogą wypierac w temperaturze pokojowej inne metale z roztworu. Glin nie wydziela z roztworów zawierających jony Fe+2 , Zn+2 ,Pb+2 i Cu+2 metali, ponieważ ulega pasywacji - pokrywa się warstewką ochronną swojego tlenku. Metale o ujemnych potencjałach normalnych mogą wypierać wodór. Metale te są metalami aktywnymi, nazywane czasami nie szlachetnymi. Reakcja przebiega tym mniej energicznie im bliższy zera jest potencjał normalny metali. Metale o dodatnich potencjałach normalnych nie wypierają wodoru z kwasów. Metale te nazywane są metlami szlachetnymi. Metale szlachetne reagują z kwasami tlenowymi z wykorzystaniem ich właściwości utleniających. Im bardziej ujemny potencjał normalny metalu, tym większa jest jego zdolność ulegania reakcji utlenienia. Im bardziej dodatni potencjał metalu , tym większa jest jego zdolność do redukcji. Metale o ujemnym potencjale : -są aktywne chemicznie - są silnymi reduktorami - łatwo się utleniają - łatwo oddają elektrony. Metale o dodatnim potencjale : - są bierne chemicznie - są utleniaczami - łatwo się redukują - trudno je utlenić.Znając położenie pierwiastka w szeregu napięciowym można przewidzieć, który z nich jest bardziej aktywny chemicznie a tym samym przewidywać kierunek reakcji samorzutnych tzn. które : - mogą wypierać wodór z rozcięczonych roztworów kwasów - są odporne na działanie rozcięczonych roztworów kwasów - mogą wypierać srebro z rozcięczonego Ag N O3
46. Wyjaśnić przydatność szeregu potencjału redoks do określania właściwości pierwiastków .
Położenie pierwiastka wskazuje na zdolność utleniania atomów lub redukowania atomów innych pierwiastków w szeregu napięciowym.
W szeregu potencjałów elektro chemicznych : Li najsilniejszy reduktor (sam najłatwiej utlenia się i przechodzi w jony) F najsilniejszy utleniacz (atomy lub jony najłatwiej przyjmują elektrony czyli redukują się ) 48. Przedstawić działanie ogniwa stężeniowego:O.S. oprócz ogniw galwanicznych w których energia elektryczna powstaje na skutek reakcji chemicznych na elektrodach , istnieją jeszcze ogniwa stężeniowe w których siła elektromotoryczna powstaje na skutek różnicy stężeń (aktywności ) roztworów przy elektrodach. Przykładem ogniwa stężeniowego może być ogniwo zbudowane z 2 elektrod srebrowych znużonych w roztworach azotanu srebra o różnych stężeniach c1 i c2 (c1<c2) można przedstawić schematem: (-)Ag I Ag NO3(c1)IIAgNO3(c2)IAg(+)W czasie pracy ogniwa na anodzie zachodzi utlenianie metalicznego srebra w myśl reakcji. Anoda : (-)Ag<=>Ag++e Katoda: (+)Ag++e<=>Ag Siła elektro motoryczna opisanego ogniwa stężeniowego będzie wyrażona równaniem :
E=0,059Lg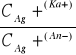
50 Podać prawa i omówić przebieg elekto lizy wodnego roztworu kwasu, zasady lub soli.Elektoliza wodnych roztworów kwasów zasad i soli :
Wydzielanie kationów gdy potencjał redukcji będzie wyższy od potencjału wydzielania wodoru (z uwzględnieniem wartości nadnapięć i pH roztworów - poniżej glinu wydziela się wodór.) Wydzielanie anionów gdy potencjał utleniania będzie niższy od potencjału wydzielania tlenu- dla większości kwasów: H2SO4, HNO3, H2CO3 , H3PO4 , z wyjątkiem HCL(+1,36V) potencjał utleniania ich anionów jest wyższy od potencjału wydzielania tlenu.51. Scharaktryzować tlenową w roztworach o różnych pH.elektrodę wodorową i Standardowa elektroda wodorowa. We wszystkich ogniwach mierzona pomiędzy elektrodami SEM pochodzi z 2 źródeł : potencjału anody i potencjału katody. Jeżeli jeden z nich będzie znany , to drugi można obliczyć na podstawie zwykłego odejmowania. Standardowa elektroda wodorowa składa się z płytki platynowej pokrytej warstewka czerni platynowej, która posiada właściwość absorbowania gazowego roztworu. Nasycona gazowym wodorem płytka platynowa nie bierze bezpośredniego udziału w reakcji elektrodowej, ale zachowuje się tak, jak by była elektrodą wykonaną z samego wodoru. Płytka ta zanurzona jest w roztworze mocnego kwasu o jednostkowej aktywności jonów wodorowych. Cząsteczki wodoru z płytki platynowej podobnie jak metale przechodzą z postaci jonów do roztworu a jednocześnie jony wodorowe z roztworu ulęgają na płytce platynowej rozładowaniu H2<=>2H++2e Potencjał elektrodowy takiej właśnie elektrody wodorowej przyjęto za równy 0. Siła elektro motoryczna (SEM) ogniwa złożonego z normalnej elektrody wodorowej i dowolnej innej elektrody daje zatem bezpośrednio potencjał zastosowanej elektrody.
Wyszukiwarka
Podobne podstrony:
sciagi do druku, Edukacja, Ziip, chemia
test chemia2, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
Właściwości tlenu wystepowanie azotu chemia, Ściągi, Chemia
Chemia1, sprawdziany, szkoła1, Sciagi, sciagi 1, CHEMIA
CZĄSTKI ELEMENT, sciągi, chemia
ściągi chemia, Kosmetologia, Ściągi
Alkany, sciągi, chemia
Adsorpcja, Studia, Chemia, chemia2, chemia od Karola, Sprawka od Karola, chemia sem3, sciągi chemia
spektroskopia ściągi, CHEMIA UŁ, 4 rok, Spektroskopia
test chemia3, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
Spektrofotometria, Studia, Chemia, chemia2, chemia od Karola, Sprawka od Karola, chemia sem3, sciągi
potencjometria1, Studia, Chemia, chemia2, chemia od Karola, Sprawka od Karola, chemia sem3, sciągi c
OBLICZANIE PRZENOŚNIKÓW, sciągi, chemia
Ściągi chemia 2, Politechnika krakowsla, uczelnia, Chemia
Alkohole, sciągi, chemia
ściagi chemia spr
ściągi chemia Kwasy karboksylowe
więcej podobnych podstron