Wstęp teoretyczny:
Odwrotność oporu nazywana jest przewodnictwem elektrycznym.
![]()
gdzie
π - przewodnictwo
R - opór
ρ - opór właściwy
q - przekrój przewodzącego słupa elektrolitu
l - długość przewodzącego słupa elektrolitu
k - przewodnictwo właściwe
Przewodnictwem właściwym nazywamy odwrotność oporu kostki sześciennej elektrolitu o długości krawędzi 1 cm. Ładunki elektryczne w elektrolicie przenoszą jony, wynika z tego, że tym większe jest przewodnictwo właściwe im większe jest stężenie jonów, oraz im większa jest szybkość jonów. Wynika z tego, że przewodnictwo właściwe jest zależne od stężenia elektrolitu oraz jego rodzaju.
![]()
W elektrochemii często jest stosowane pojęcie przewodnictwa równoważnikowego lub molowego λ, a związek przewodnictwa równoważnikowego z przewodnictwem właściwym przedstawia równanie:
gdzie
c - stężenie elektrolitu [grówn / l]
V = 1/c - rozcieńczenie, liczba litrów w których mieści się 1 grówn (lub 1 mol)
Związek pomiędzy przewodnictwem równoważnikowym, stopniem dysocjacji oraz ruchliwością jonów dla najprostszych przypadków dysocjacji przedstawiają równania:
λ = Fα(ua + uk)
dla c → 0 ; v → ∞ otrzymujemy λ0 = F (u0a + u0k) .
gdzie
F - stała Faradaya (96500 C)
α - stopień dysocjacji.
![]()
Gdy podzielimy powyższe równania stronami otrzymujemy:
Otrzymane równanie jest wykorzystywane do obliczania stopnia dysocjacji w oparciu o pomiary przewodnictwa. W rzeczywistości w powyższy sposób można obliczyć iloczyn stopnia dysocjacji
i stosunku sum ruchliwości jonów.
Miareczkowanie konduktometryczne jest metodą polegającą na wyznaczaniu przewodnictwa właściwego roztworu, jako funkcji liczby mililitrów dodawanego stopniowo roztworu miareczkującego o znanym stężeniu.
W procesach elektrolizy przemysłowej bardzo duże znaczenie ma przewodnictwo elektryczne. Wraz ze wzrostem przewodnictwa właściwego można stosować coraz niższe napięcia, w celu uzyskania takiego samego natężenia prądu, dzięki czemu w znacznie mniejszym stopniu jest zużywana energia elektryczna. W procesach przemysłowych często do kąpieli elektrolitycznych dodaje się substancji nie biorących udziału w procesach elektrodowych, lecz zwiększających przewodnictwo kąpieli. Na przykład w procesie elektrorafinacji miedzi stosuje się dodatek kwasu siarkowego. Zwiększenie przewodnictwa roztworu można uzyskać także podwyższając tempera-turę, np. elektrorafinacja miedzi jest prowadzona w temperaturze ok. 50 oC .
Miareczkowanie konduktometryczne jest metodą bardzo przydatną do wyznaczania stężenia
w roztworach mętnych lub barwnych, podobnie jak w roztworach, dla których nie jesteśmy w stanie wskazać indykatorów mogących wskazać punkt zmiareczkowania.
Cel ćwiczenia:
wyznaczenie przewodnictwa właściwego roztworów: CuSO4, H2SO4 oraz CH3COOH
o różnych stężeniach oraz sporządzenie w oparciu o uzyskane wyniki wykresów: k = f(c),
λ = f(V) , oraz α = f(c)wyznaczenie stężenia roztworu ZnCl2 w oparciu o pomiar przewodnictwa oraz dane tabelaryczne
wyznaczenie stężeń na drodze miareczkowania konduktometrycznego:
mocnego kwasu - mocną zasadą
słabego kwasu - mocną zasadą
Opracowanie wyników:
elektrolit |
stężenie c [grówn/l] |
stężenie c [mol/l] |
przewod-nictwo właściwe k [S/cm] |
tempera-tura [oC] |
przewod-nictwo molowe λ [S⋅cm2/mol] |
λ / λ0 |
rozcieńcze-nie V [dm3/mol] |
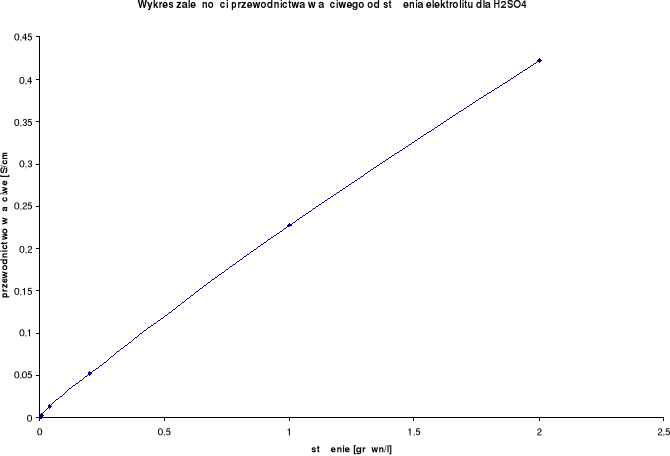
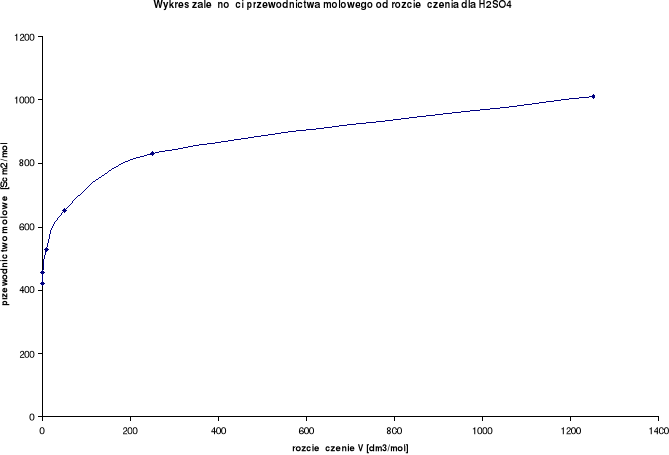
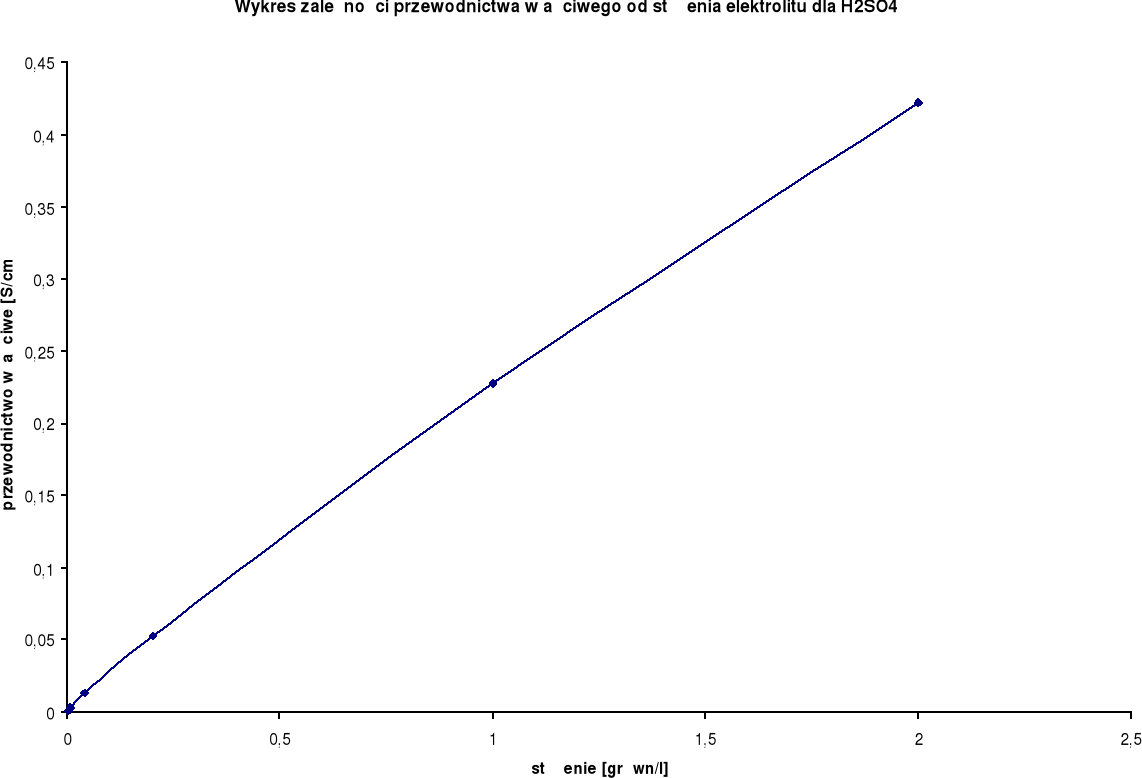
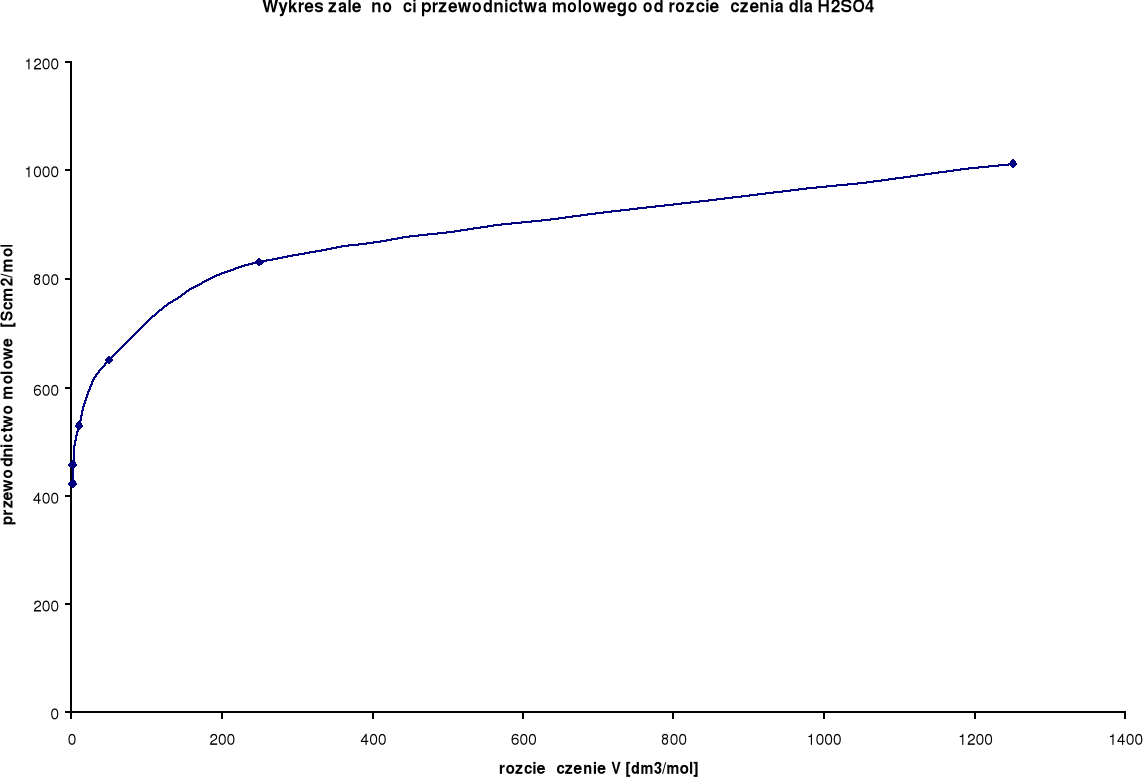
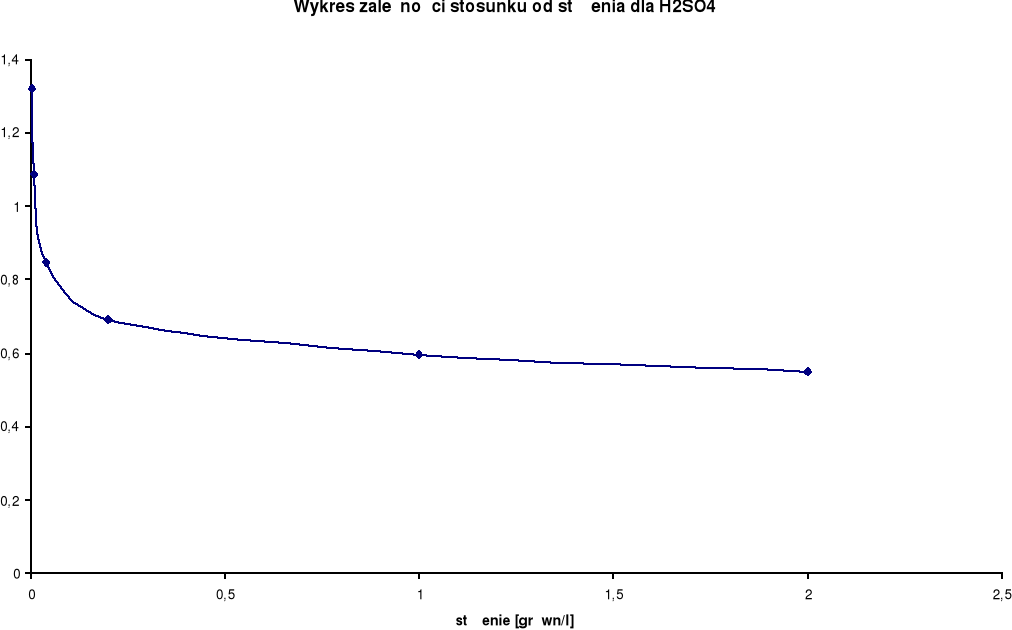
H2SO4
λ0 = 766,6 [S⋅cm2/mol] |
2,0 |
1,0 |
0,422 |
21,6 |
422 |
0,550483 |
1 |
|
1,0 |
0,5 |
0,228 |
22,6 |
456 |
0,594834 |
2 |
|
0,2 |
0,1 |
0,053 |
21,5 |
530 |
0,691364 |
10 |
|
0,04 |
0,02 |
0,013 |
22,1 |
650 |
0,8479 |
50 |
|
0,008 |
0,004 |
0,00333 |
22,5 |
832,5 |
1,085964 |
250 |
|
0,0016 |
0,0008 |
0,00081 |
22,1 |
1012,5 |
1,320767 |
1250 |
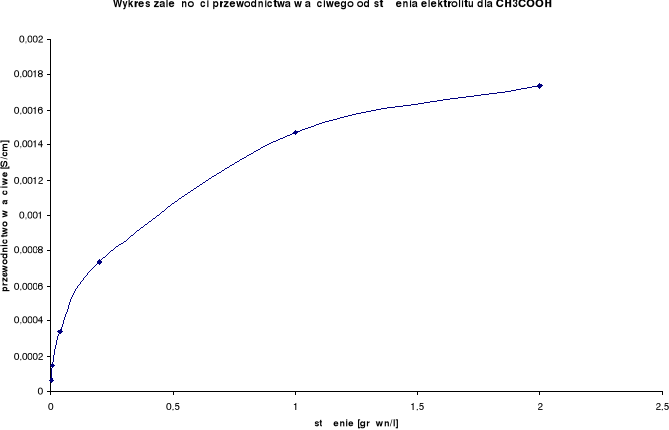
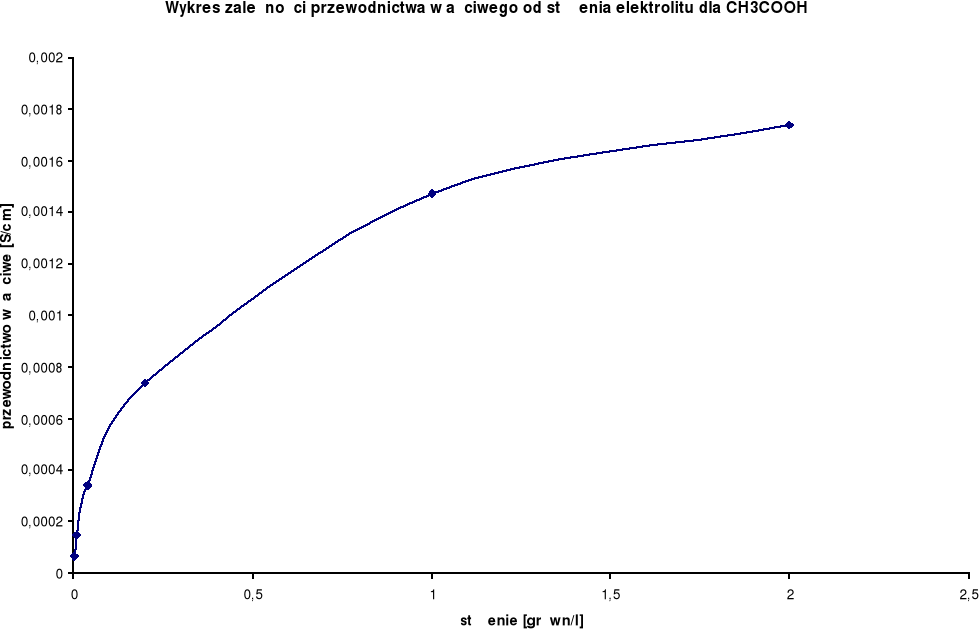
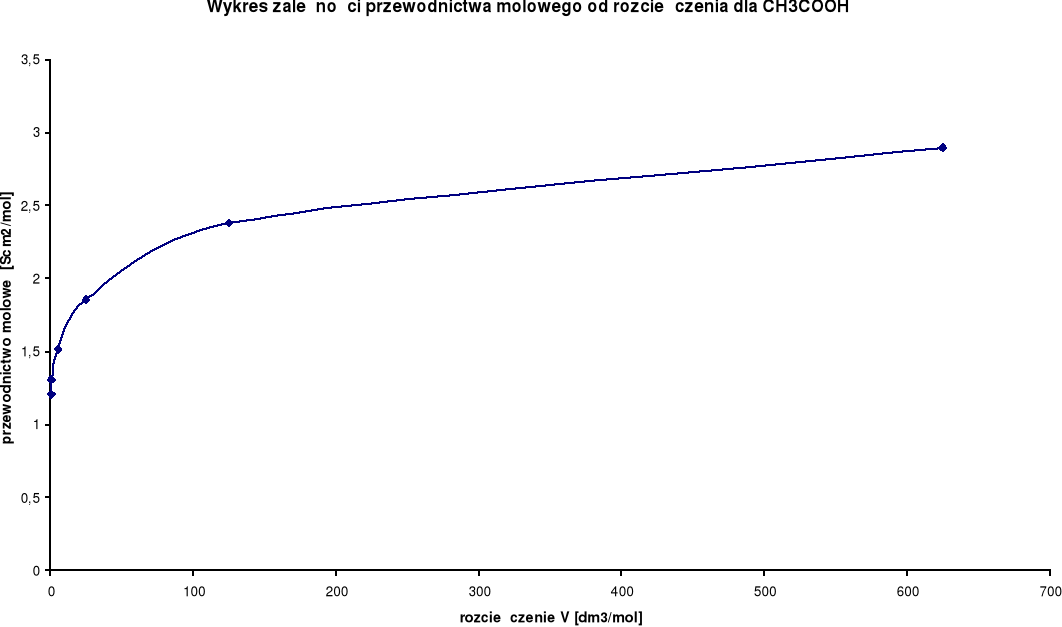
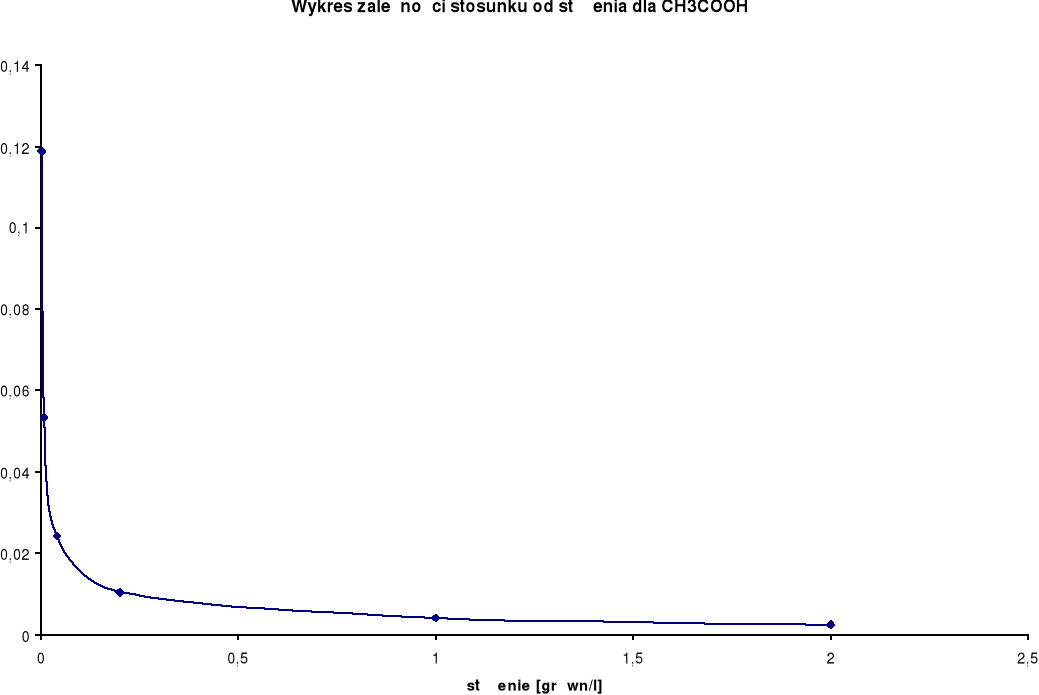
CH3COOH
λ0 = 349,9 [S⋅cm2/mol] |
2,0 |
2,0 |
0,00174 |
21,3 |
0,87 |
0,002486 |
0,5 |
|
1,0 |
1,0 |
0,00147 |
21,6 |
1,47 |
0,004201 |
1 |
|
0,2 |
0,2 |
0,00074 |
21,4 |
3,7 |
0,010574 |
5 |
|
0,04 |
0,04 |
0,00034 |
21,8 |
8,5 |
0,024293 |
25 |
|
0,008 |
0,008 |
0,00015 |
21,5 |
18,75 |
0,053587 |
125 |
|
0,0016 |
0,0016 |
0,0000665 |
21,6 |
41,56 |
0,118784 |
625 |
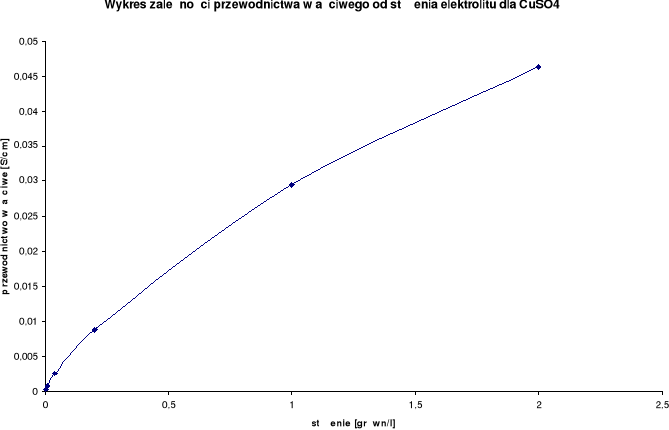
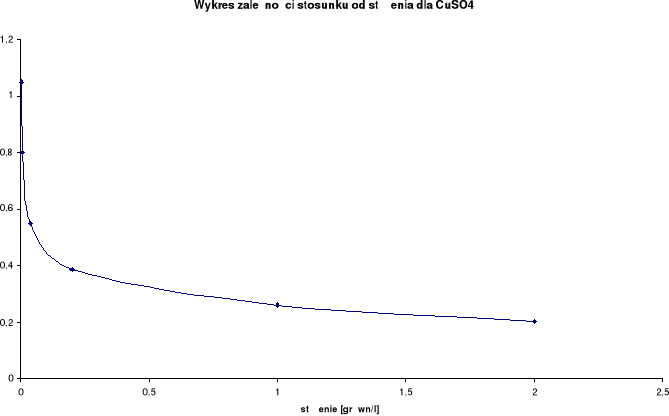
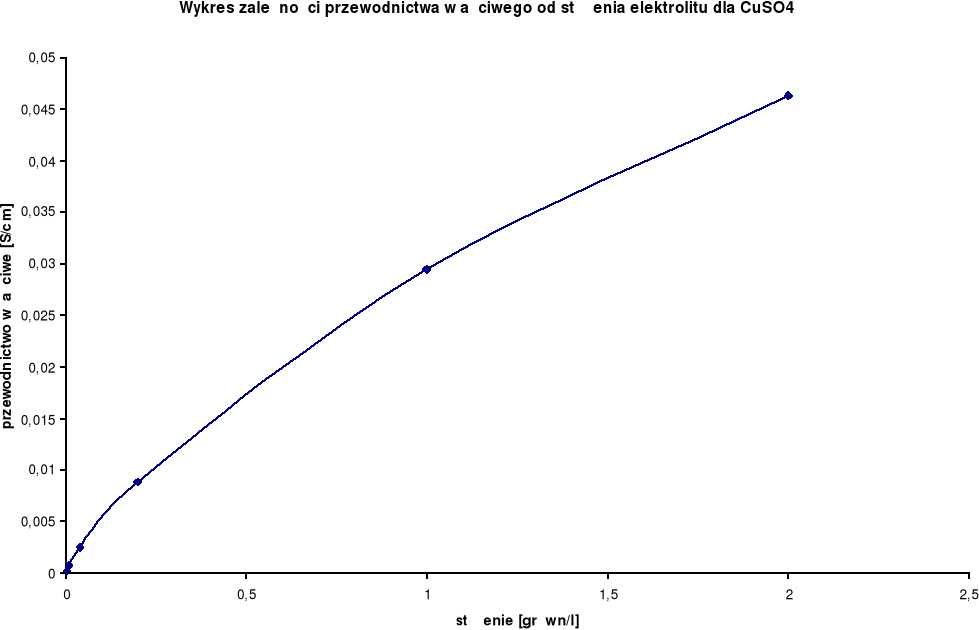
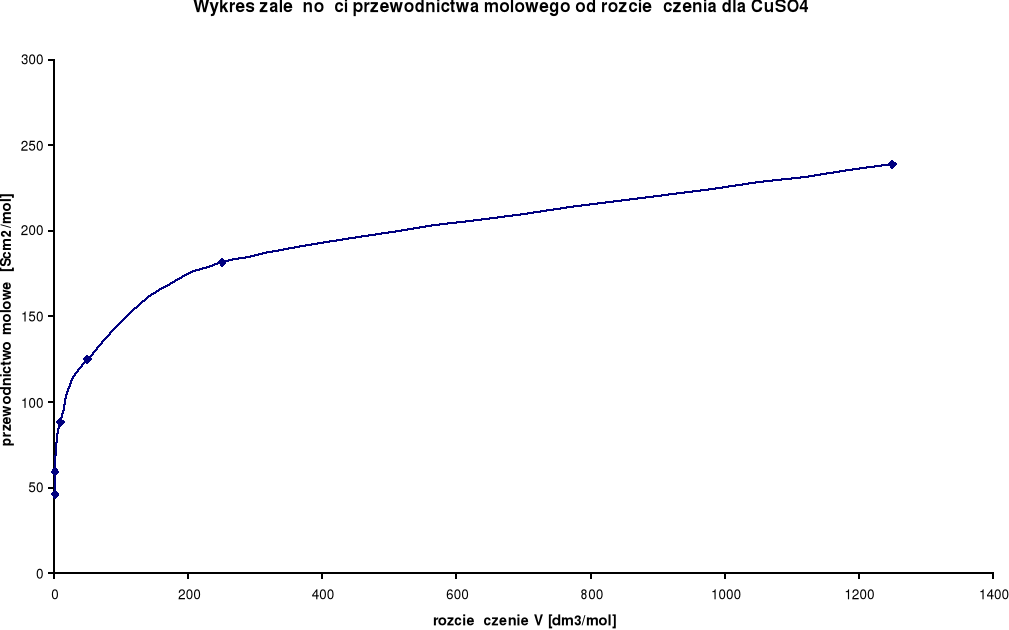
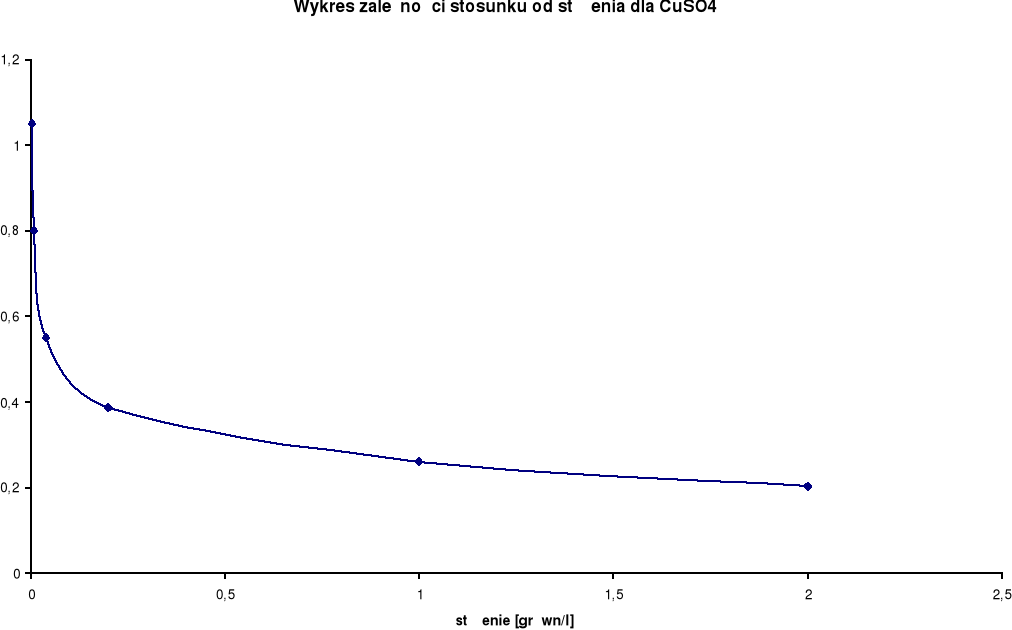
CuSO4
λ0 = 227,2 [S⋅cm2/mol] |
2,0 |
1,0 |
0,0463 |
20,9 |
46,3 |
0,203785 |
1 |
|
1,0 |
0,5 |
0,0295 |
21,7 |
59 |
0,259683 |
2 |
|
0,2 |
0,1 |
0,0088 |
20,6 |
88 |
0,387324 |
10 |
|
0,04 |
0,02 |
0,0025 |
20,5 |
125 |
0,550176 |
50 |
|
0,008 |
0,004 |
0,000727 |
21,1 |
181,75 |
0,799956 |
250 |
|
0,0016 |
0,0008 |
0,000191 |
20,8 |
238,75 |
1,050836 |
1250 |
Obliczanie stałej dysocjacji K dla kwasu octowego:
stężenie c [mol/l] |
λ / λ0 |
stała dysocjacji K |
stężenie c [mol/l] |
stopień dysocjacji α |
stała dysocjacji K |
2,0 |
0,002486 |
1,24 ⋅ 10-5 |
0,04 |
0,024293 |
2,42 ⋅ 10-5 |
1,0 |
0,004201 |
1,77 ⋅ 10-5 |
0,008 |
0,053587 |
2,43 ⋅ 10-5 |
0,2 |
0,010574 |
2,26 ⋅ 10-5 |
0,0016 |
0,118784 |
2,56 ⋅ 10-5 |
Wyznaczamy Kśr = 2,11334 ⋅ 10-5.
Wykresy zależności przewodnictwa właściwego od stężenia elektrolitu:
Wykresy zależności przewodnictwa molowego od rozcieńczenia:
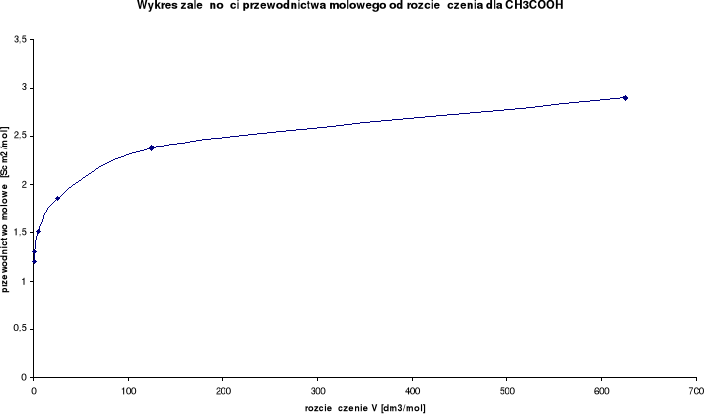
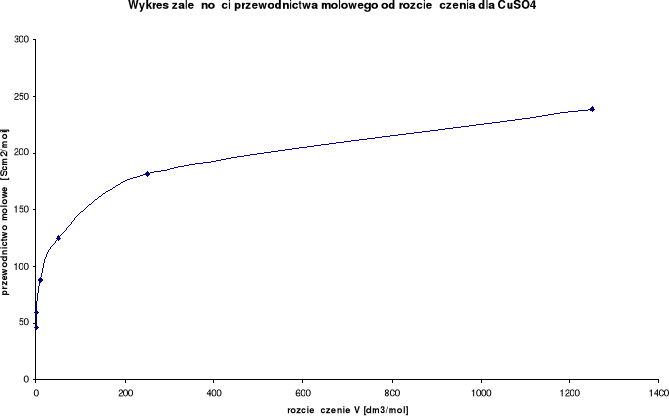
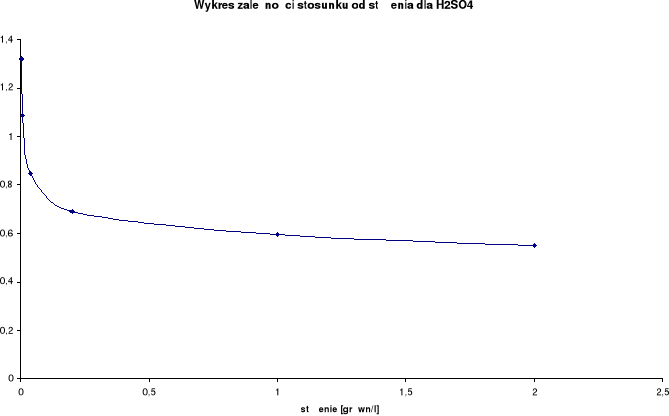
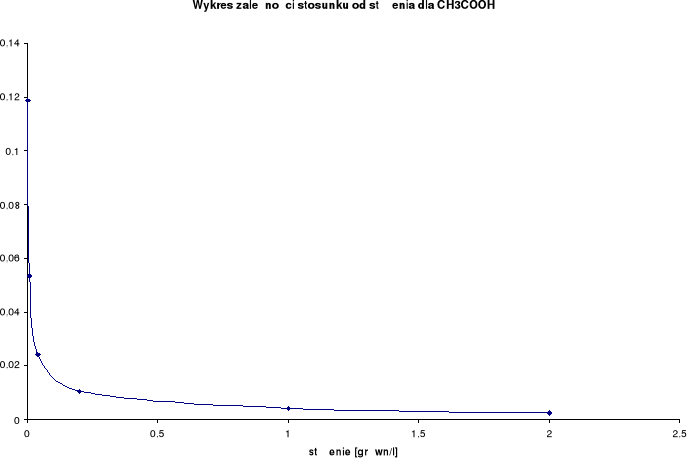
Wykresy zależności stosunku λ/λ0 od stężenia:
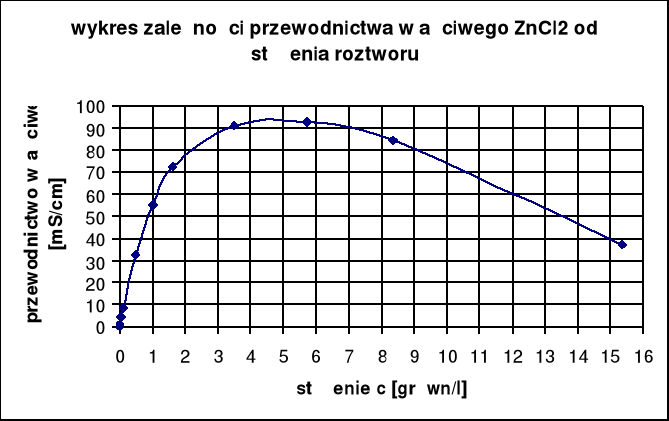
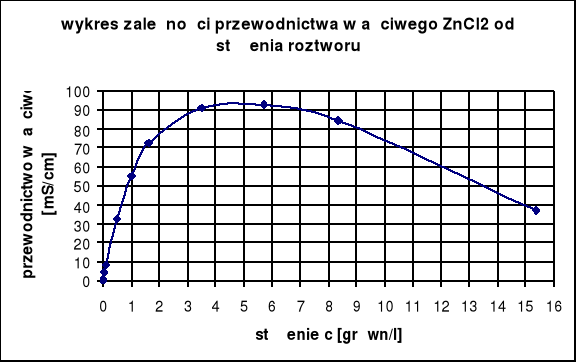
Wyznaczenie stężenia roztworu ZnCl2:
dane: szukane:
k = 66,7 [mS/cm] c = ?
t = 21,3 [oC]
dane tabelaryczne dla ZnCl2:
stężenie c [grówn/l] |
przewodnictwo właściwe k [mS/cm] |
stężenie c [grówn/l] |
przewodnictwo właściwe k [mS/cm] |
0,0005 |
0,0508 |
1 |
55 |
0,001 |
0,107 |
1,606 |
72,7 |
0,005 |
0,508 |
3,493 |
91,2 |
0,01 |
0,98 |
5,72 |
92,6 |
0,05 |
4,35 |
8,353 |
84,5 |
0,1 |
8,2 |
15,37 |
36,9 |
0,5 |
32,5 |
|
|
Korzystając z tabeli odczytujemy:
c = 1 [grówn/l] → k = 55,0 [mS/cm]
c = 1,606 [grówn/l] → k = 72,7 [mS/cm]
i układamy zależność funkcji liniowej y = ax + b
55,0 = 1⋅a + b
72,7 = 1,606⋅a + b
Rozwiązując powyższy układ równań otrzymujemy:
a = 29,2; b = 25,8
zatem równanie funkcji liniowej ma postać:
y = 29,2x + 25,8
Podstawiając wyznaczone przewodnictwo właściwe k = 66,7 [mS/cm] możemy wyliczyć szukane stężenie ZnCl2
66,7 = 29,2x + 25,8
x = 1,4
Odp: stężenie roztworu ZnCl2 wynosi 1,4 [grówn/l]
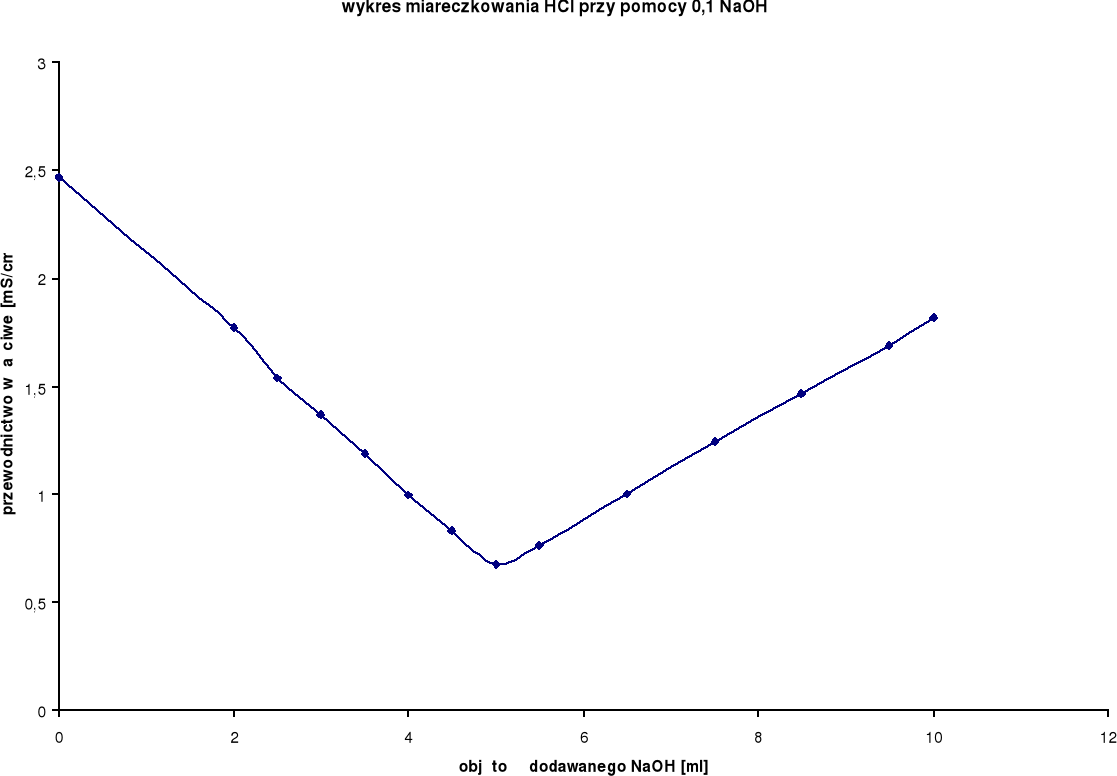
Wyniki miareczkowań konduktometrycznych dla HCl:
Rozwór miareczkowany: HCl
Rozwór miareczkujący: 0,1 n NaOH
0,1 n NaOH [ml] |
przewodnictwo właściwe [mS/cm] |
temperatura [oC] |
0,1 n NaOH [ml] |
przewodnictwo właściwe [mS/cm] |
temperatura [oC] |
0,0 |
2,47 |
21,7 |
5,0 |
0,678 |
21,5 |
2,0 |
1,77 |
21,6 |
5,5 |
0,762 |
21,5 |
2,5 |
1,54 |
21,6 |
6,5 |
1,001 |
21,5 |
3,0 |
1,37 |
21,6 |
7,5 |
1,245 |
21,5 |
3,5 |
1,19 |
21,6 |
8,5 |
1,467 |
21,5 |
4,0 |
0,997 |
21,6 |
9,5 |
1,688 |
21,5 |
4,5 |
0,830 |
21,5 |
10,0 |
1,818 |
21,5 |
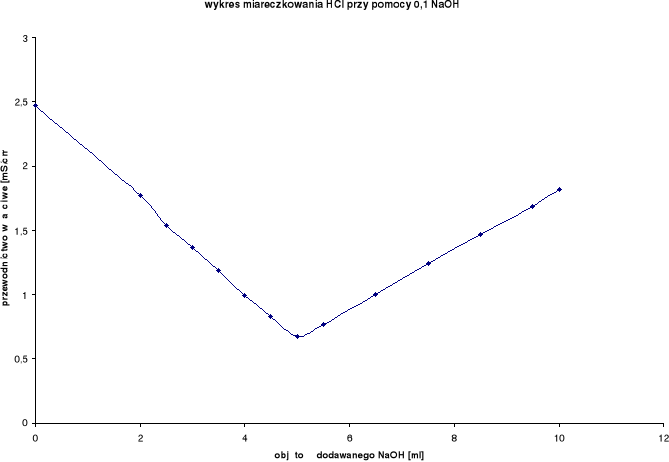
Z wykresu wynika, iż zmiareczkowanie wystąpiło po dodaniu ok. 5 ml NaOH.
Uwzględniając równanie zobojętnienie:
HCl + NaOH → NaCl + H2O
wynika, iż do zobojętnienia 1 mola HCl potrzebny jest 1 mol NaOH. Możemy z tego wyliczyć:
5,0 ml - 0.1n (NaOH)
5,0 ml - x (HCl)
5 ⋅ x = 5 ⋅ 0,1 ⇒ x = 0,5 / 5 = 0.1 n
Odp: stężenie miareczkowanego HCl wynosiło 0.1 n.
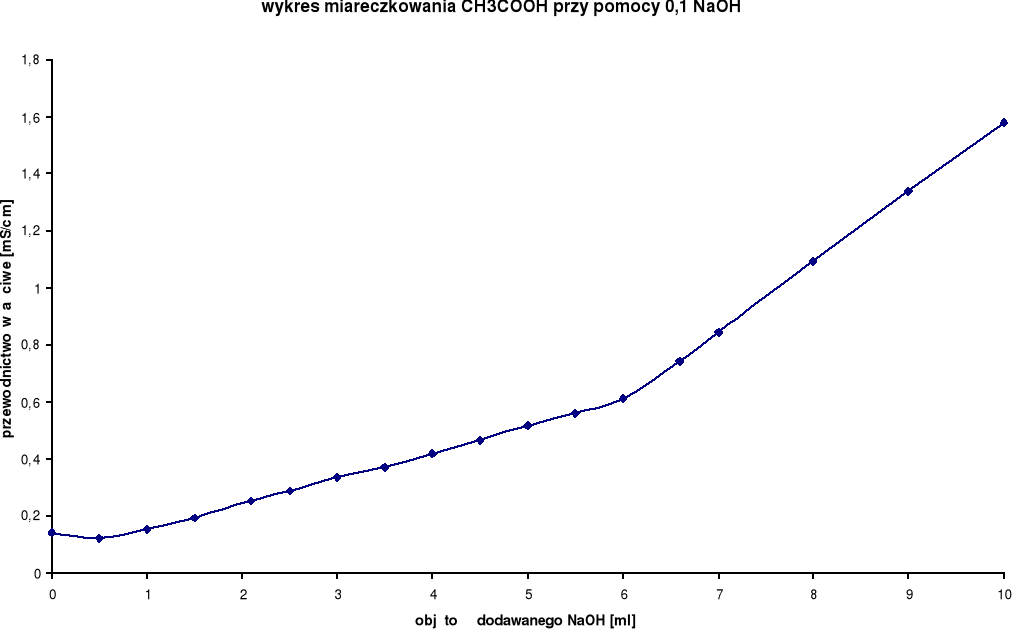
Wyniki miareczkowań konduktometrycznych dla CH3COOH:
Rozwór miareczkowany: CH3COOH
Rozwór miareczkujący: 0,1 n NaOH
0,1 n NaOH [ml] |
przewodnictwo właściwe [mS/cm] |
temperatura [oC] |
0,1 n NaOH [ml] |
przewodnictwo właściwe [mS/cm] |
temperatura [oC] |
0,0 |
0,141 |
21,6 |
4,5 |
0,466 |
21,7 |
0,5 |
0,121 |
21,8 |
5,0 |
0,519 |
21,7 |
1,0 |
0,153 |
21,8 |
5,5 |
0,559 |
21,6 |
1,5 |
0,193 |
21,7 |
6,0 |
0,613 |
21,6 |
2,1 |
0,253 |
21,7 |
6,6 |
0,743 |
21,6 |
2,5 |
0,290 |
21,7 |
7,0 |
0,845 |
21,6 |
3,0 |
0,334 |
21,7 |
8,0 |
1,093 |
21,6 |
3,5 |
0,372 |
21,7 |
9,0 |
1,340 |
21,6 |
4,0 |
0,419 |
21,7 |
10,0 |
1,577 |
21,6 |
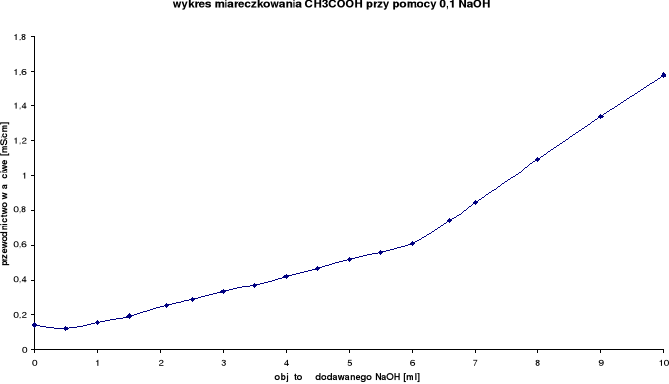
Z wykresu wynika, iż zmiareczkowanie wystąpiło po dodaniu ok. 6 ml NaOH.
Uwzględniając równanie zobojętnienie:
CH3COOH + NaOH → CH3COONa + H2O
wynika, iż do zobojętnienia 1 mola HCl potrzebny jest 1 mol NaOH. Możemy z tego wyliczyć:
6,0 ml - 0.1n (NaOH)
5,0 ml - x (HCl)
6 ⋅ x = 5 ⋅ 0,1 ⇒ x = 0,5 / 6 = 0.83 n
Odp: stężenie miareczkowanego CH3COOH wynosiło 0.83 n.
Wnioski:
Przewodnictwo molowe oraz stosunek λ / λ0 wzrastają wraz ze wzrostem rozcieńczenia. Wynika to z faktu, iż wraz ze wzrostem rozcieńczenia wzrasta liczba jonów uczestniczących w przenoszeniu ładunków, a co za tym idzie wzrasta przewodnictwo molowe.
Przewodnictwo właściwe wzrasta wraz ze wzrostem stężenia.
Błąd wyznaczonej wartości stężenia ZnCl2 może wynikać z różnicy temperatur: doświadczalnej
t = 21,3 oC oraz tabelarycznej t = 18 oC
Podczas miareczkowania mocnego kwasu solnego HCl mocną zasadą sodową NaOH na początku można zaobserwować spadek przewodnictwa właściwego, lecz po przekroczeniu granicy miarecz-kowania można zaobserwować znaczny wzrost przewodnictwa właściwego, co było spowodowane początkową wymianą „ruchliwego” kationu H+ na dużo wolniejszy kation Na+.
Podczas miareczkowania słabego kwasu octowego CH3COOH mocną zasadą sodową NaOH można zaobserwować, po początkowym, nieznacznym zmniejszeniu przewodnictwa właściwego, spowodowanym zmniejszeniem zawartości jonów kwasu octowego, można zaobserwować wolny wzrost, spowodowany pojawieniem się szybszych jonów CH3COONa, a po przekroczeniu granicy miareczkowania można zaobserwować, iż wzrost przewodnictwa właściwego stał się szybki, bowiem zaczęły przewodzić jony zasady sodowej.
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
lab. 05 - baron, Chemia fizyczna AGH laborki, lab 5
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
skoootaaa, Chemia fizyczna AGH laborki, lab 20
lepkość, Chemia fizyczna AGH laborki, lab 1
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw. polaryzacja, Chemia fizyczna AGH la
więcej podobnych podstron