Nina Zarucka
Technologia chemiczna
Wydział Chemiczny
Ćwiczenie nr 29a
Kinetyka konwersji błękitu bromofenolowego.
Ćwiczenie wykonano: 24.03.2003 r.
Sprawozdanie oddano:31.03.2003 r.
Część teoretyczna
Stałą szybkości reakcji nazywamy współczynnik proporcjonalności k w równaniu kinetycznym.
![]()
Energią aktywacji nazywamy minimum energii, jaką powinny być obdarzone cząsteczki, aby mogły przereagować. Można ją obliczyć na podstawie równania Arrheniusa:
![]()
A - współczynnik częstotliwości
Energię aktywacji można również obliczyć znając dwie stałe szybkości danej reakcji w dwóch różnych temperaturach ze wzoru:
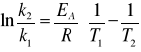
Celem ćwiczenia jest wyznaczenie stałej szybkości oraz energii aktywacji przegrupowania monoanionu błękitu trójfenolowego (II) w bezbarwny trójanion (III). Reakcja zachodzi w środowisku silnie alkalicznym w roztworze NaOH według schematu:
W miarę zwiększania pH zachodzi zmiana w strukturze cząsteczki barwnika. Ponieważ reakcja zachodzi przy dużym nadmiarze (≈ 105) NaOH można ją opisać równaniem kinetycznym I rzędu. Badana reakcja jest procesem odwracalnym przy czy stała równowagi K = k1/k2 =2,5.103 Ze względu na tak silne przesunięcie stanu równowagi możemy uznać reakcję za nieodwracalną.
2. Opis wykonywanych czynności
Zapoznałam się z instrukcja obsługi spektrometru
Przygotowałam roztwory NaOH o stężeniach 2 M, 1 M, 0,5 M
Pobrałam 0,5 ml roztworu podstawowego(błękit bromofenolowy rozpuszczony w wodzie destylowanej), rozcieńczyłam za pomocą roztworu NaOH(2 M)do objętości 10 cm3 i wymieszałam. Następnie pobrałam roztwór do kuwety i zmierzyłam absorbancję przy λ=592 nm. Wykonałam szereg pomiarów w odstępach 2 min.
Identycznie postąpiłam rozcieńczając roztwór podstawowy roztworem NaOH o stężeniu 1 M i 0,5 M
Dla stężenia 0,5 M NaOH wykonałam pomiar w temperaturze 41,5 0C.
Przygotowałam 90 ml 0,5 M roztworu NaOH w kolbie 100 ml i umieściłam w termostacie.
Po ok. 20 min dodałam 2 ml roztworu podstawowego i dopełniłam do kreski roztworem NaOH
Pobierałam w odstępach 2 min roztwór do kuwety i mierzyłam absorbancję.
Wyniki zapisałam w tabeli
Obliczenia
Stałe szybkości odczytuje z wykresów zależności
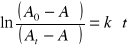
2M NaOH k1 = 0,1725 1/min = 0,0032 1/s
1M NaOH k2 = 0,0590 1/ min = 0,0011 1/s
0,5 M NaOH k3 = 0,0441 1/ min = 0,0007 1/s
0,5 M NaOH(T=41,50C) k4 = 0,1448 1/ min = 0,0024 1/s
Energię aktywacji obliczam dla roztworu rozcieńczonego 0,5 M NaOH przekształcając równanie Arrheniusa
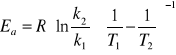
gdzie za k1 przyjmuje stałą szybkości w T1(27,50C = 300,65 K) a k2 to stała szybkości w T2=41,50C = 314,65 Kk1 = 0,0007 1/s
k2 = 0,0024 1/s
L.p. |
Czas [min] |
T = 27,5oC |
Absorbancja |
|
T = 41,50C |
|
|
|
2 M NaOH |
1 M NaOH |
0,5M NaOH |
Czas[min] |
Absorbancja |
1 |
0 |
0,927 |
1,148 |
0,927 |
0 |
0,557 |
2 |
2 |
0,607 |
1,017 |
0,847 |
1,5 |
0,444 |
3 |
4 |
0,407 |
0,873 |
0,775 |
3 |
0,381 |
4 |
6 |
0,275 |
0,754 |
0,702 |
4,5 |
0,306 |
5 |
8 |
0,186 |
0,651 |
0,644 |
6,5 |
0,219 |
6 |
10 |
0,134 |
0,564 |
0,59 |
8,3 |
0,16 |
7 |
12 |
0,09 |
0,495 |
0,538 |
10,5 |
0,125 |
8 |
14 |
0,066 |
0,441 |
0,493 |
12,5 |
0,091 |
9 |
16 |
0,045 |
0,377 |
0,45 |
14,5 |
0,064 |
10 |
18 |
0,034 |
0,335 |
0,412 |
16,5 |
0,051 |
11 |
20 |
0,022 |
0,291 |
0,378 |
18,5 |
0,039 |
12 |
22 |
0,019 |
0,265 |
0,346 |
20,5 |
0,029 |
13 |
24 |
0,015 |
0,237 |
0,317 |
|
|
14 |
26 |
0,011 |
0,206 |
0,288 |
|
|
15 |
28 |
0,009 |
0,19 |
0,264 |
|
|
16 |
30 |
0,006 |
0,179 |
0,242 |
|
|
17 |
32 |
0,05 |
0,169 |
0,221 |
|
|
18 |
34 |
0,003 |
0,153 |
0,203 |
|
|
19 |
36 |
0,002 |
0,15 |
0,185 |
|
|
20 |
38 |
0 |
0,146 |
0,172 |
|
|
21 |
40 |
|
0,144 |
0,158 |
|
|
22 |
42 |
|
0,135 |
0,144 |
|
|
23 |
44 |
|
|
0,132 |
|
|
24 |
46 |
|
|
0,123 |
|
|
25 |
48 |
|
|
0,112 |
|
|
26 |
50 |
|
|
0,104 |
|
|
27 |
52 |
|
|
0,095 |
|
|
28 |
54 |
|
|
0,089 |
|
|
29 |
56 |
|
|
0,082 |
|
|
30 |
58 |
|
|
0,075 |
|
|
gdzie A0, At i A∞ oznaczają absorbancję w chwili początkowej, po czasie t i po osiągnięciu stanu równowagi. Dla ułatwienia przyjęłam, że A∞=0 więc równanie przyjmuje prostszą postać ![]()
. Z nachylenia prostych odczytałam poszczególne wartości stałych szybkości reakcji roztworów rozcieńczonych NaOH o stężeniach:
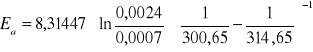
Ea = 67296,3054J = 67,3 kJ/mol
c) Obliczam wartość stałej szybkości II rzędu (k') wykonując wykres zależności stałej szybkości od stężenia [OH-]. Wartość stałej liczę z nachylenia prostej. Ponieważ y = 0,1461x:
k' = 0,1461 dm3/(mol.s)
4.Wnioski
Celem ćwiczenia było wyznaczenie stałej szybkości oraz energii aktywacji przegrupowania monoanionu błękitu trójfenolowego (II) w bezbarwny trójanion (III). Stała szybkości tej reakcji zależy od stężenia roztworu NaOH, który jest środowiskiem reakcji oraz od temperatury. Zauważyłam, że ze zwiększeniem pH (zwiększeniem stężenia NaOH) stała szybkości także wzrasta. Np. dla 0,5 M roztworu NaOH k3=0,0007 s -1, dla 1 M NaOH k2 = 0,0011 s -1 a gdy roztwór NaOH jest 2 M k1 = 0,0032 s -1. Jednocześnie widać, że w wyższej temperaturze stała szybkości również jest większa. W temperaturze 27,50C stała szybkości k3 = 0,007 s -1a przy podwyższeniu temperatury o 140C zwiększa stała do k4 = 0,0024 s -1. Ponieważ doświadczenie wykonałam dla trzech stężeń NaOH obliczyłam wartość stałej szybkości II rzędu k' = 0,1461 dm3mol-1.s-1.
Energia aktywacji dla większości reakcji przebiegających z mierzalną szybkością tj. mających okresy połowicznej przemiany rzędu minuty lub godziny wynosi Ea = 50-100 kJ/mol. W przypadku konwersji błękitu bromofenolowego wynosi Ea=67,3 kJ/mol.
5
Wyszukiwarka
Podobne podstrony:
Sprawko 31, studia, bio, 2rok, chemia fizyczna, laborki, 3-
sprawko 3 automatyka, studia, bio, 2rok, pomiary i automatyka, laborki
dibenzylidenoaceton, studia, bio, 2rok, chemia organiczna, laborki
Auto2 wykresy, studia, bio, 2rok, pomiary i automatyka, laborki
Auto Raport v2, studia, bio, 2rok, pomiary i automatyka, laborki
natalia sprawko 44, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
iska, studia, bio, 2rok, pomiary i automatyka, laborki
sprawozdaniePomiary9, studia, bio, 2rok, pomiary i automatyka, laborki
pomiary cw6-poprawione, studia, bio, 2rok, pomiary i automatyka, laborki
sprawko 26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
spr9, studia, bio, 2rok, pomiary i automatyka, laborki
sprawozdanie9, studia, bio, 2rok, pomiary i automatyka, laborki
nowe cw 9, studia, bio, 2rok, pomiary i automatyka, laborki
pia2, studia, bio, 2rok, pomiary i automatyka, laborki
pomiary cw2-poprawione, studia, bio, 2rok, pomiary i automatyka, laborki
Sprawozdanie nr 9, studia, bio, 2rok, pomiary i automatyka, laborki
więcej podobnych podstron