skan0060
Termodynamika chemiczna 63
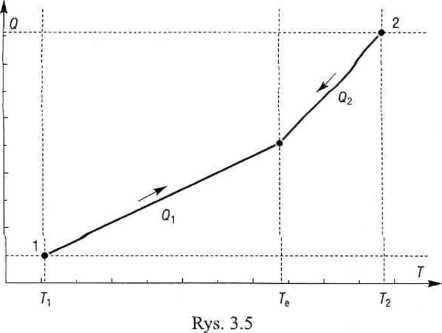
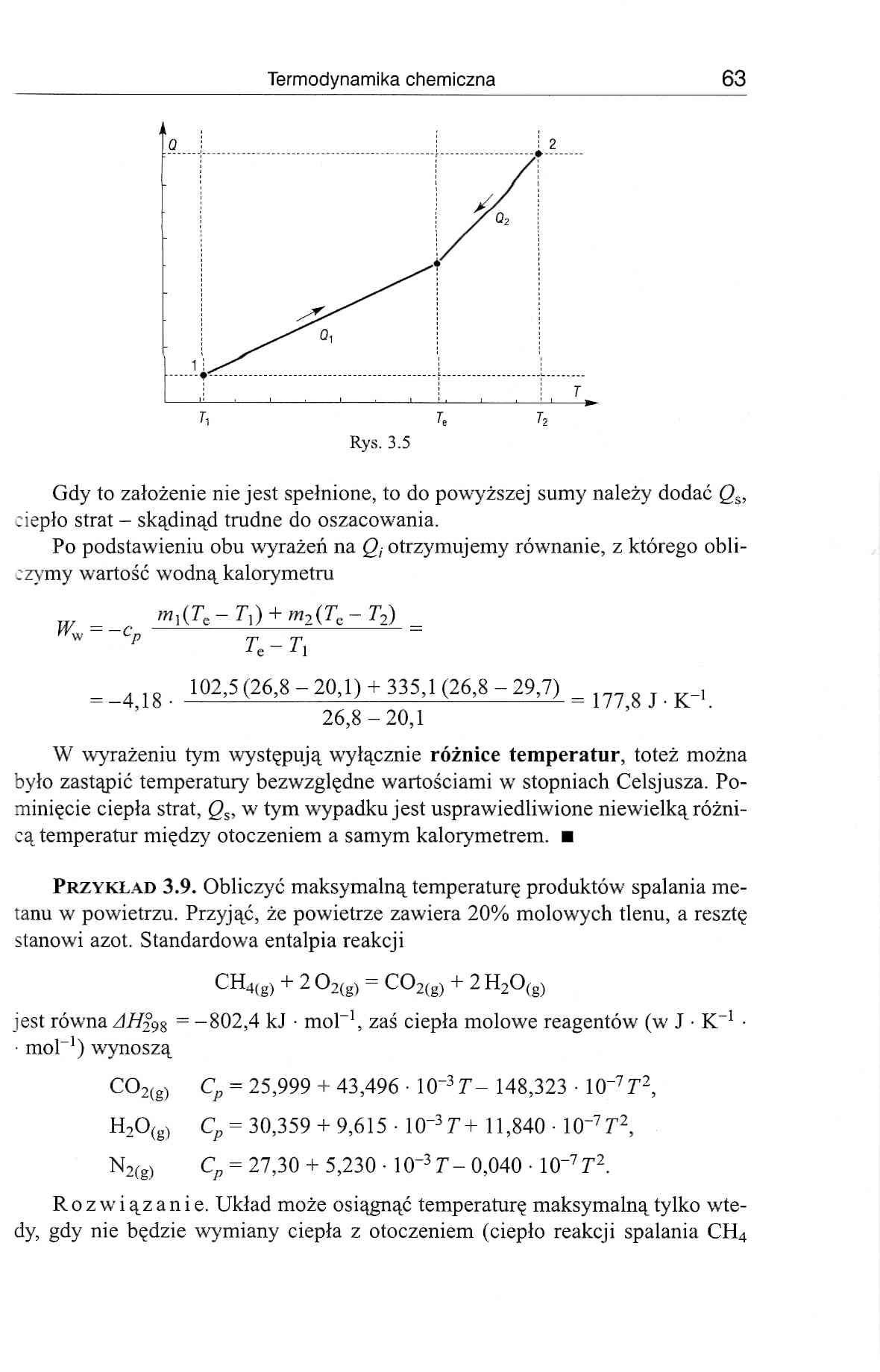
Gdy to założenie nie jest spełnione, to do powyższej sumy należy dodać Q&, ciepło strat - skądinąd trudne do oszacow-ania.
Po podstawieniu obu wyrażeń na Q, otrzymujemy równanie, z którego obli-:zymy wartość wodną kalorymetru
m](Tc-T]) + m2(Tc-T2)
Ww — —cn -=
* p tc - r,
177,8 JK-1.
= 102,5 (26,8 - 20,1) + 335,1 (26,8 - 29,7)
5 ’ 26,8-20,1
W wyrażeniu tym występują wyłącznie różnice temperatur, toteż można było zastąpić temperatury bezwzględne wartościami w- stopniach Celsjusza. Pominięcie ciepła strat, Qs, w tym wypadku jest usprawiedliwione niewielką różnicą temperatur między' otoczeniem a samym kalorymetrem. ■
Przykład 3.9. Obliczyć maksymalną temperaturę produktów- spalania metanu w powietrzu. Przyjąć, że powietrze zawiera 20% molowych tlenu, a resztę stanowi azot. Standardowa entalpia reakcji
CH4(g) + 2 02(g) = C02(g) + 2 H20(g)
jest równa AH29g = -802,4 kJ • mol-1, zaś ciepła molowe reagentów (w J • K-1 • • mol-1) wynoszą
C02(g) Cp = 25,999 + 43,496 • 10-3T- 148,323 • 10-7T2,
H20(g) Cp = 30,359 + 9,615 • 10-37+ 11,840 ■ 10-7T2,
N2(g) Cp = 27,30 + 5,230 • \ 0~3T- 0,040 • 10-7r2.
Roz w i ąz a n i e. Układ może osiągnąć temperaturę maksymalną tylko wtedy, gdy nie będzie wymiany ciepła z otoczeniem (ciepło reakcji spalania CH4
Wyszukiwarka
Podobne podstrony:
18926 skan0082 Termodynamika chemiczna 85 to otrzymamy relację Gibbsa-Helmholtza d H dT l t) P
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
134 Monika Jeziorska gdy znany jest rozkład prawdopodobieństwa zdarzeń, a gdy taki rozkład nie jest
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0061 64 Termodynamika chemiczna zostanie zużyte w całości na ogrzanie produktów tej reakcji do t
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
więcej podobnych podstron