PNOM (I) - ODPOWIEDZI NA KOLOKWIUM
Omów siły i energie oddziaływań między atomami w krysztale.
Oddziaływania między atomami to oddziaływania elektromagnetyczne pomiędzy elektronami walencyjnymi a jądrami atomów.
Energia potencjalna i siły zależne są od odległości pomiędzy atomami.
Minimum energii potencjalnej uważa się za stan stabilny wiązania.
Zmiana odległości pomiędzy atomami wiąże się ze zmianą stanu skupienia substancji.
Energia potencjalna jest największa, gdy atomy są najdalej - rośnie wraz z oddalaniem się atomów od siebie.
Siły przyciągające atomy są największe, gdy atomy są najbliżej - maleją wraz z oddalaniem się atomów od siebie.
Scharakteryzuj wiązania chemiczne i ich wpływ na właściwości kryształów.
Wiązanie jonowe - tworzy się pomiędzy pierwiastkami o dużej różnicy elektroujemności (El- >1,7), polega na przejęciu elektronu(ów) z powłoki walencyjnej pierwiastka mniej elektroujemnego przez bardziej elektroujemny, co powoduje powstanie jonów.
Właściwości kryształów jonowych: średnia energia wiązania (200-800 kJ/mol), wysoka temperatura topnienia, średnia twardość, kruchość, izolatory/półprzewodniki, o właściwościach optycznych jak swobodnych jonów, np. NaCl.
Wiązanie kowalencyjne (atomowe) - tworzy się pomiędzy pierwiastkami o podobnej elektroujemności, poprzez uwspólnienie elektronu(ów) z powłok walencyjnych pierwiastków.
Właściwości kryształów kowalencyjnych: wysoka energia wiązania (600-1000 kJ/mol), bardzo wysoka temperatura topnienia, duża twardość, izolatory/półprzewodniki, załamują światło, np. diament.
Wiązanie metaliczne - w zasadzie wiązania kowalencyjne o słabszej podatności na polaryzację, polega na przestrzennym uporządkowaniu jonów dodatnich i swobodnie poruszających się między nimi elektronów, które tworzą gaz elektronowy, przebywający w obrębie kryształy na skutek elektrostatycznego przyciągania kationów.
Właściwości kryształów metalicznych: średnia energia wiązania (200-800 kJ/mol), szeroki zakres temperatur topnienia, zmienna twardość i plastyczność, dobre przewodniki, połysk metaliczny.
Wiązanie międzycząsteczkowe siłami van der Waalsa - przypominają wiązania jonowe lecz ładunek cząstek nie jest skoncentrowany na pojedynczym atomie tylko na wielu rozproszonych atomach.
Właściwości kryształów molekularnych: niska energia wiązania (4-20 kJ/mol), niska temperatura topnienia, mała twardość, dobre izolatory, o właściwościach optycznych jak pojedynczych cząstek, np. CCl4.
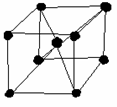
Scharakteryzuj komórki: regularną ściennie centrowaną, regularną przestrzennie centrowaną i heksagonalną.
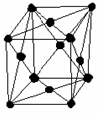
Regularna ściennie centrowana (RSC) - o kształcie sześcianu, złożona z ośmiu atomów
w narożach sześcianu i sześciu pośrodku ścian.
Regularna przestrzennie centrowana (RPC) - o kształcie sześcianu z czterema atomami
w narożach i jednym centralnym wewnątrz sześcianu.
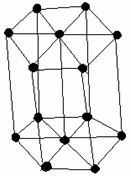
Heksagonalna (H) - o kształcie graniastosłupa o podstawie sześciokąta z dwunastoma
atomami w narożach struktury i dwoma na każdej z sześciokątnych podstaw.
Omów różnice w krystalizacji metali pierwiastkowych, stopów metali i materiału amorficznego.
1 - czysty metal, 2 i 3 - stopy metali, 4 - materiał amorficzny; Tk - temperatura krystalizacji (topnienia)
Materiał krystaliczny (ułożenie uporządkowane) - stopy metali i metale pierwiastkowe - na krzywych krzepnięcia widoczne są wahania w szybkości spadku temperatury spowodowane przemianą fazową i pochłanianiem energii (temperatury) z tym, że w stopach zachodzi ten proces łagodniej.
Dla metali temperatura krystalizacji jest temperaturą stałą. W tej temperaturze metal skrystalizował, przez co utrzymywana jest ona przez dłuższy czas (później obniża się temperatura otoczenia).
Materiał amorficzny (ułożenie przypadkowe) - jego temperatura spada stopniowo w czasie bez żadnych wahań spowodowanych przemianą fazową, nie ma stałej wartości temperatury krzepnięcia.
Wyjaśnij pojęcie równowagi termodynamicznej. Podaj i omów zależności opisującą entalpię swobodną Gibbsa i energię swobodną Helmholtza. Kiedy obie energie mają zbliżone wartości?
Równowaga termodynamiczna - makroskopowy stan układu, w którym parametry takie jak P (ciśnienie), V (objętość), T (temperatura) są stałe w czasie. Na równowagę termodynamiczną składa się:
- równowaga chemiczna (brak przepływu cząstek i brak reakcji chemicznych),
- równowaga mechaniczna (nie występują niezrównoważone siły),
- równowaga termiczna (nie występuje przepływ energii).
Entalpia swobodna Gibbsa (G) - potencjał termodynamiczny, którym można zmierzyć „użyteczną” pracę możliwą do uzyskania w procesie izotermiczno-izobarycznym, wyrażana wzorem:
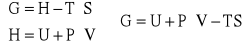
Energia swobodna Helmholtza (F) - potencjał termodynamiczny, którym można zmierzyć „użyteczną” pracę możliwą do uzyskania w procesie izotermiczno-izochorycznym, wyrażana wzorem:
![]()
gdzie: U - energia wewnętrzna, T - temperatura, S - entropia, P - ciśnienie, V - objętość, H - entalpia.
Równanie Gibbsa-Helmholtza:
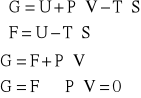
Odp. Obie energie mają zbliżone wartości wtedy, gdy ![]()
, czyli dla faz skondensowanych (![]()
Omów pierwszą zasadę termodynamiki.
Pierwsza zasada termodynamiki to prosta zasada zachowania energii, czyli ogólna reguła głosząca, że energia w żadnym procesie nie może pojawić się „znikąd”.
![]()
„Zmiana energii wewnętrznej układu równa jest dostarczonemu do układu ciepłu i pracy wykonanej przez układ bądź nad układem przez siły zewnętrzne.”
Zdefiniuj pojemność cieplną. Wyprowadź zależności na ciepło właściwe przy stałej objętości i przy stałym ciśnieniu.
Pojemność cieplna (c) - stosunek ilości ciepła dostarczonego do układu (dQ) do odpowiadającego mu przyrostu temperatury (dT), wyrażana wzorem: ![]()
.
● Ciepło właściwe dla ![]()
z I zasady termodynamiki:![]()
bo: ![]()
● Ciepło właściwe dla ![]()
ze wzoru na entalpię:![]()
z I zasady: ![]()
![]()
![]()
![]()
![]()
Wyjaśnij, jaki układ nazywamy termodynamicznie metastabilnym. Podaj przykłady takich układów.
Stan metastabilny - stan, który nie charakteryzuje się minimum energii i jest trwały ze względu na bariery kinetyczne.
Przykłady: stal hartowana, szkło metaliczne, aluminium utwardzane wydzieleniowo.
Podaj definicję fazy, roztworu stałego i fazy międzymetalicznej.
Faza - jednorodna część układu oddzielona granicą, po przekroczeniu której własności zmieniają się skokowo.
Roztwór stały - jednorodna faza złożona z co najmniej dwóch składników, znajdująca się w stałym stanie skupienia, która zachowuje strukturę krystaliczną rozpuszczalnika.
Faza międzymetaliczna - faza o strukturach i właściwościach pośrednich między roztworem stałym i związkiem chemicznym, cechy charakterystyczne: struktura krystaliczna odmienna od struktury składników, wiązania metaliczne, uporządkowane rozmieszczenie atomów składników w sieci, stała proporcja składników.
Podaj definicję i podział roztworów stałych.
Roztwór stały - jednorodna faza złożona z co najmniej dwóch składników, znajdująca się w stałym stanie skupienia, która zachowuje strukturę krystaliczną rozpuszczalnika. Roztwory stałe dzielimy na:
- podstawowe - rozpuszczalnikiem jest pierwiastek chemiczny,
- wtórne - rozpuszczalnikiem jest faza międzymetaliczna (np. rozpuszczanie w wodzie),
- różnowęzłowe - następuje ekspansja lub kontrakcja sieci (nieograniczone, ograniczone),
- międzywęzłowe - następuje ekspansja sieci - ograniczone,
- pustowęzłowe - ograniczone.
Scharakteryzuj roztwory stałe. Co to są roztwory stałe uporządkowane?
Roztwór stały - jednorodna faza złożona z co najmniej dwóch składników, znajdująca się w stałym stanie skupienia, która zachowuje strukturę krystaliczną rozpuszczalnika.
Roztwory stałe uporządkowane - roztwory stałe, które mają uporządkowany układ atomów składnika B w sieci rozpuszczalnika A, tworzą się w określonym zakresie temperatur, mają określony stosunek składników AB, AB3.
Jakie kryteria decydują o powstawaniu roztworów stałych i faz międzymetalicznych?
Kryteria tworzenia roztworów stałych Hume-Rothery'ego:
- czynnik wielkości atomu (różnica większa niż 15% między A i B wyklucza roztwór nieograniczony),
- czynnik elektrochemiczny (duża różnica w elektrowartościowości - powstanie faz międzymetalicznych),
- czynnik wartościowości (składnik o większej wartościowości rozpuszcza się w składniku o mniejszej wartościowości).
Scharakteryzuj fazy międzymetaliczne. Podaj przykłady.
Fazy międzymetaliczne - fazy, które mają struktury i własności pośrednie między roztworem stałym a związkiem chemicznym, cechy charakterystyczne:
- struktura krystaliczne odmienna od struktury składników,
- uporządkowane rozmieszczenie atomów składników w sieci,
- stała proporcja składników,
- wiązania metaliczne.
Fazy międzymetaliczne mogą być trwałe przy składzie stechiometrycznym lub trwałe jako roztwory wtórne (różnowęzłowe, międzywęzłowe, pustowęzłowe).
Jakie właściwości stopów są zależne, a jakie niezależne od struktury?
Właściwości stopów:
● zależne od struktury: mechaniczne, elektryczne, magnetyczne, przewodność cieplna, współczynnik dyfuzji, odporność korozyjna;
● niezależne od struktury: gęstość, ciepło właściwe, współczynniki rozszerzalności cieplnej i ściśliwości.
Podaj różnice we właściwościach czystych metali i stopów wielofazowych.
Czyste metale: duża ciągliwość, mała twardość i wytrzymałość mechaniczna, dobra przewodność elektryczna i cieplna, dobra odporność korozyjna.
Stopy wielofazowe: większa twardość i wytrzymałość, mniejsza ciągliwość, mniejsza przewodność elektryczna i cieplna, mniejsza odporność korozyjna.
Scharakteryzuj defekty punktowe.
Do wad punktowych, cechujących się niewielkimi wymiarami we wszystkich kierunkach, należą wakanse, tj. wolne węzły w sieci krystalicznej, atomy międzywęzłowe, które zajęły pozycje w lukach, opuszczając węzły sieci na skutek drgań cieplnych, oraz atomy obce węzłowe i międzywęzłowe.
Defekty powstają w wyniku drgań cieplnych, gdzie przy odpowiedniej amplitudzie drgań atom może zostać wytrącony z obecnego położenia.
Obecność zarówno wakansów, jak i atomów międzywęzłowych, powoduje wokół nich lokalne odkształcenie sieci przestrzennej kryształu, zwane kontrakcją lub ekspansją.
Omów defekt Frenkla i defekt Schotky'ego.
Defekt Frenkla - mechanizm procesu aktywowanego cieplnie, który polega na przemieszczaniu się atomu w miejsce sąsiadującego wakansu, w wyniku czego powstaje wakans w innym miejscu sieci. Rys a).
Defekt Schottky'ego - mechanizm procesu aktywowanego cieplnie, który polega na przemieszczaniu się rdzenia atomowego z pozycji węzłowej do przestrzeni międzywęzłowej, przez co tworzy się wakans i atom międzywęzłowy. Rys b).
Jak zależy ilość defektów od temperatury?
W każdej temperaturze istnieje równowagowa liczba defektów.
Liczba równowagowych defektów rośnie z temperaturą.
![]()
, gdzie:
Jakie czynniki powodują powstawanie defektów struktury?
Czynniki powodujące powstawanie defektów:
- szybkie chłodzenie z wysokiej temperatury,
- napromieniowanie ciężkimi cząstkami,
- odkształcenia plastyczne na zimno.
Scharakteryzuj dyslokacje krawędziowe.
Dyslokację krawędziową wywołuje obecność w strukturze krystalicznej dodatkowej półpłaszczyzny obsadzonej atomami, której krawędź stanowi linia brzegowa zwana linią dyslokacji.
Wokół linii dyslokacji następuje jednocześnie objętościowe i postaciowe odkształcenie kryształu. Dyslokacje krawędziowe posiadają zdolność przemieszczania się w płaszczyźnie poślizgu pod wpływem odpowiednio skierowanego nacisku.
Wektor Burgera jest prostopadły do linii dyslokacji.
W zależności od położenia dodatkowej półpłaszczyzny dyslokacje mogą być dodatnie (┴) lub ujemne (┬).
Scharakteryzuj dyslokacje śrubowe
Dyslokacja śrubowa to defekt liniowy struktury krystalicznej spowodowany przemieszczeniem części kryształu wokół osi, zwanej linią dyslokacji śrubowej.
Dyslokacja powstaje, gdy wszystkie atomy na danej powierzchni poślizgu zostaną przesunięte o jedną odległość atomową w tym samym kierunku względem drugiej płaszczyzny. Dyslokacja śrubowa to granica pomiędzy nie przesuniętą, a przesuniętą częścią kryształu.
Wektor Burgera jest równoległy do linii dyslokacji.
Dyslokacje śrubowe mogą być prawoskrętne lub lewoskrętne.
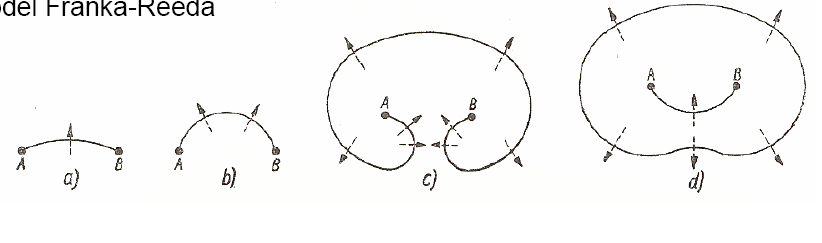
Omów mechanizm powstawania dyslokacji Franka-Reeda.
Mechanizm polegający na powstawaniu dyslokacji w procesie odkształcenia na zimno (np. przez zgniatanie). Teoria zakłada, że w metalu nie odkształconym istnieje przestrzenny układ dyslokacji, unieruchomionych w pewnych miejscach.
W płaszczyźnie rysunku na dyslokację unieruchomioną w węzłach A i B działa naprężenie styczne (strzałka). Linia dyslokacji (AB) w pierwszej fazie zaczyna się wyginać. Następnie tworzy ona dwie przeciwnie zorientowane spirale, których krawędzie łączą się. W ten sposób powstają dwie dyslokacje: zewnętrzna i wewnętrzna (łącząca węzły A i B).
Teoretycznie możliwe jest powstanie nieskończenie wielu pętli, ale praktycznie defekty strukturalne nie pozwalają na rozwój pętli linii dyslokacji.
W miarę zwiększania się ilości dyslokacji twardość metalu wzrasta, lecz maleją jego właściwości plastyczne i zmieniają się właściwości fizyczne (np. maleje przewodność elektryczna, rośnie potencjał elektrochemiczny).
Scharakteryzuj granice ziaren.
Granica ziaren - obszar o szerokości kilku średnic atomowych, o nieprawidłowej strukturze sieciowej.
Granice ziaren stanowią wady powierzchniowe budowy krystalicznej.
W metalu polikrystalicznym granice oddzielają ziarna różniące się wzajemną orientacją krystaliczną, a w stopach technicznych ponadto składem chemicznym.
W zależności od kąta dezorientacji krystalicznej granice ziaren dzieli się na:
- wąskokątowe,
- szerokokątowe.
Granice między ziarnami różnych faz są nazywane granicami międzyfazowymi.
Różnią się parametrami i typem sieci, mają budowę zbliżoną do granic szerokokątnych. Można je podzielić na:
- koherentne,
- półkoherentne,
- niekoherentne.
Jakie są charakterystyczne parametry granic ziaren?
Parametr granic ziaren:
- różnicą orientacji sąsiednich ziaren.
- energią granicy ziaren (podwyższona energia granicy ziaren skutkuje mniejszą odpornością na korozję, podatnością na trawienie, ruchem - rozrostem ziaren).
Jak tworzą się granice wąskokątowe?
Granice wąskokątowe, powstające w miejscu zetknięcia podziaren, charakteryzują się niewielkim kątem dezorientacji (<10-15º) i mają budowę dyslokacyjną.
Granice wąskokątowe daszkowe łączą kryształy o wspólnym kierunku krystalograficznym równoległym do granicy.
Granice wąskokątowe skrętne powstają w miejscu połączenia kryształów o wspólnym kierunku sieciowym prostopadłym do granicy.
Granice wąskokątowe powstają podczas krystalizacji, złączania się krawędzi dendrytów oraz w stanie stałym podczas wygrzewania materiału uprzednio odkształconego plastycznie.
Porównaj granice sprzężone, niesprzężone i półsprzężone.
Granice sprzężone (koherentne):
- dobre dopasowanie sieci graniczących faz,
- bardzo mała energia granicy, na granicy nie ma nieprawidłowości w rozmieszczeniu atomów,
- występują w kryształach bliźniaczych,
- granice pomiędzy kryształami proste (płaskie).
Granice półsprzężone (półkoherentne):
- częściowe dopasowanie sieci graniczących faz,
- często dyslokacja na granicy faz,
- wyższa energia granicy niż w granicach koherentnych,
- granica tworzy niewielki kąt z płaszczyzną bliźniaczą.
Granice niesprzężone (niekoherentne):
- liczne zaburzenia w rozmieszczeniu atomów na granicy,
- wysoka energia granicy,
- zaokrąglone granice kryształów (minimalizacja energii).
Strona 1 z 7
RSC)
RPC)
H)
n - liczba defektów
N - liczba atomów
e - stała matematyczna (podstawa logarytmu naturalnego)
E - energia aktywacji utworzenia mola defektów
R - stała gazowa
T - temperatura bezwzględna
Wyszukiwarka
Podobne podstrony:
mat, fiz, pnom, Matematyka - odpowiedzi na repetytorium I, Omów siły i energie oddziaływań między at
mat, fiz, pnom, Pytania na kolokwium PNOM
mat, fiz, pnom Pytania na kolokwium PNOM
mat, fiz, pnom, Pole-pod-krzywa-a-calka-oznaczona[2], POLE POD KRZYWĄ A CAŁKA OZNACZONA
mat, fiz, pnom, SZT sem 1 fizyka (część I)
PSYCHOLINGWISTYKA pytania i odpowiedzi na kolokwium
enzymy pytania i odpowiedzi na kolokwium
Odpowiedzi na kolokwium
Odpowiedzi na kolokwium z fizyki
Pytania i odpowiedzi na 1 kolokwium, Prywatne, Studia
Odpowiedzi na kolokwium (1), Elektrotechnika PŁ, Fizyka
biochemia pytania i odpowiedzi na kolokwium, wsr rok 1 2012, wykłady, I semestr, BioChem sem1
Ochrona środowiska odpowiedzi na kolokwium
MSE PYTANIA I ODPOWIEDZI NA KOLOKWIUM 97 ZAGADNIE (2), Bezpieczeństwo narodowe, międzynarodowe stos
odpowiedzi na polimery - polowa, AGH IMIR AiR, S2, PNOM - Podstawy nauki o materiałach
więcej podobnych podstron