34300 P5101350
Zadanie 19 (2 punkty)
Sola równowagi reakcji odwracalnej H, + 1, «=* 2 HI w określone) temperaturze T wynosi K -« sunie równowagi stężenia wodoru i Jodu wynoszą: [HJr =* 2 mol/dm\ [I2Jf = 2 mol/dm’. równowagowe stężenie jodowodoru.__
Odpowiedź:
E- W _4
[Hz], Ui],
K = ^- = 4 2 2
xJ = 16
x = 4
(HI)r = 4 mol/dm1
Zadanie 20 (3 punkty)
W sunie równowagi reakcji N; + 3 H; 2 NH} w określonej temperaturze T stężenia reagentów
wynoszą: [N2]r = 3 mol/dm', [H2]r = 1 mol/dm5, (NH Jr = 8 mol/dm5. Oblicz początkowe stężenia azotu i wodom w danej temperaturze.
Odpowiedź:
Skoro równowagowe stężenie produktu NH, wynosi 8 mol/dm5, tzn. że prze reagowały następujące liczby moli substratów:
1 mol N2 - 2 mole NH, x - 8 moli NH,
x = 4 mole N2
3 mole H2 - 2 mole NH, x - 8 moli NH,
x s 12 moll H2
1NJ. | | + 4 =* 7 [mol/dm5]
§§y 8 1112 1 13 [mol/dm5]
Zadanie 21 (2 punkty)
Określ, jak wzrost ciśnienia wpłynie na układ znajdujący się w stanie równowagi (zakładamy, że wszystkie reagenty są w sunie gazowym):
a) Nj + JH, »=* 2NH,
b) 2 NO, ss=e 2 NO + O,
c) 11,+ i, 2HI
Odpowiedź:
» w rozważanej reakcji z 4 moli gazów otrzymujemy 2 mole gazów, czyli wzrost ciśnienia w układzie spowoduje przesunięcie położenia stanu równowagi w prawo.
^ w rozważanej reakcji z 2 moli gazów otrzymujemy 3 mole gazów, czyli wzrost ciśnienia w układzie spowoduje przesunięcie położenia stanu równowagi w lewo, cl« rozważanej reakcji z 2 moli gazów otrzymujemy 2 mole gazów,czyli wzrost ciśnienia w układzie me imienia położenia stanu równowagi.
Pamiętaj! Wzrost lub spadek ciśnienia może wywołać zmianę objętości w układzie (warunek: V, * Vp. jeżeli Vf = V„, to ciśnienie nie ma wpływu), jeżeli proces jest przemianą izotcrmiczną. musi być spełniona zależność: p V = eonu.
Zadanie 22 (1 punkt)
Kursuj wykres przedstawiający zależność stałej równowagi K od temperatury dla reakcji egzoenogetycznej. Odpowiedź:
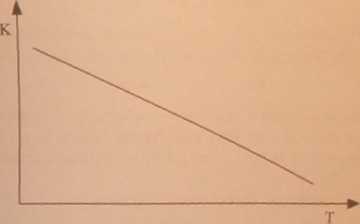
Zadanie 23 (3 punkty)
Zmieszano 3 mole gazu X, z 6 molami gazu Y2. W osiągniętym przez układ stanie równowagi otrzymano i mole produktu XY. Oblicz stałą równowagi reakcji: X, + Y3 ■*- -*■ 2 XY
Odpowiedź:
K =
Analizując równanie reakcji, można zauważyć określone stosunki molowe, w jakich reagenty ze sobą zarc-igowiiy na rzecz utworzonych 4 moli produktu:

Kinetyki I t&mtmg* chemiczna 16'
Wyszukiwarka
Podobne podstrony:
P5101312 Zadanie 19 (2 punkty) ^HHtyMMMOMfc.któweu cekin fest oUzymanie chlorowodoru Opis doświadcze
89308 P5101343 Zadanie 10 (2 punkty) w tabeli podano wartości entalpii tworzenia określonych
P5101382 Zadanie 10 (2 punkty) yń
34272 P5101383 Zadanie 17 (3 punkty) Napis* wzory pótatfukturalnc wsaystklcli możliwych nasyconych a
więcej podobnych podstron