245 [1024x768]

252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
1. Traaslacyjna suma stanów. Aby obliczyć sumę stanów, związaną z danym rodzajem energii cząsteczki e,, musimy znać wyrażenie na odpowiednią energię. Zgodnie z mechaniką kwantową energię translacyjną cząsteczki o masie m, poruszającej się swobodnie wewnątrz jednowymiarowego pudła potencjału o długości a, można przedstawić za pomocą równania (patrz str. 37).
hy
£t Brna2' w którym n oznacza liczbę kwantową ruchu translacyjnego. Energia transla-cyjna cząsteczki, poruszającej się swobodnie wewnątrz trójwymiarowego pudła o wymiarach a b - c, wyrazi się amalogicznym równaniem:
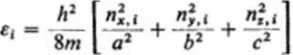
(3.186)
gdzie: h — stała Plancka, m — masa cząsteczki, nXt,\n,y% ntti — liczby kwan towe ruchu w kierunkach osi x,y i z.
Wstawiając to wyrażenie w równanie na sumę stanów (3.163):
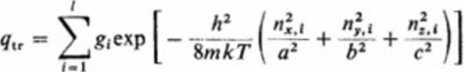
(3.187)
możemy otrzymać sumę stanów po przeprowadzeniu sumowania. Dla ruchu translacyjnego gt = 1, a ponieważ odstępy pomiędzy energetycznymi poziomami translacyjnymi są znikomo małe, możemy sumowanie zastąpić całkowaniem:
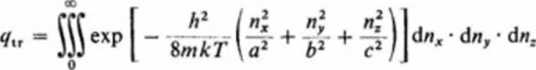
(3.188)
Liczby kwantowe nx, ny i nt zmieniają się od zera do nieskończoności. Występujące tutaj całki są równe:
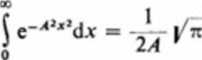
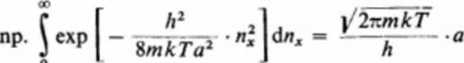
o
Zatem:
(3.189)
(2nmkT)*12 . (InmkT)2'2 „
— J?—------w~v
Wyszukiwarka
Podobne podstrony:
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
231 [1024x768] 238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ które po uwzględnieniu (3.112) przyjmie
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
243 [1024x768] 250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ oraz wyrażeniem na energię wewnętrzną (3.170) I
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
251 [1024x768] 258 PODSTAWY TERMODYNAMIKI CHEMICZNEJa stąd: R -in" ‘ i(3.212)Występujące w ty
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
255 [1024x768] 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Tak
257 [1024x768] 264 PODSTAWY TERMODYNAMIKI CHEMICZNEJ obliczyć standardową zmianę entalpii reakcji CH
249 [1024x768] PODSTAWY TERMODYNAMIKI CHEMICZNEJ Skąd InGrot = MnT+const Wstawiając tę wartość do ró
PODSTAWY TERMODYNAMIKI CHEMICZNEJ skrypt do wykładów Maria Bełtowska-Brzezinska Wydział Chemii U
skan0056 Termodynamika chemiczna 59 Łatwo sprawdzić, że obliczając pracę w procesie nieodwracalnym z
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
więcej podobnych podstron