448 [1024x768]

KINETYKA CHEMICZNA
/(s) Ap(mm Hg)
Wykazać, ip reakcja jest pierwszego rzędu.
Równanie reakcji pierwszego rzędu możemy zapisać w postaci
Jeżeli ciśnienie początkowe eteru oznaczymy przez p0, to ciśnienie końcowe, gdy reakcja przebiegnie do końca, wyniesie 3 p0. Gdy aktualne ciśnienie po czasie t wynosi p0 ł-A/>. to do powyższego równania możemy wstawić zamiast c0 wartość 2pa, a zamiast c wyrażenie 2p0 - bp. Otrzymujemy więc
k
2,303*
r + log2/)0
log(2p0-A/>)
2 poniższego wykresu widzimy, że punkty doświadczalne odpowiadające wartościom log(2p0- &p) w zależności od czasu układają się idealnie na linii prostej świadcząc, żc mamy ' do czynienia z reakcją pierwszego rzędu. Z nachylenia prostej można określić wartość stałej szybkości, która wynosi Ar » 4,37- I0_4s"'.
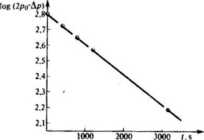
Czas
POLOWKOW. REAKCJI
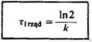
Ważnym pojęciem w kinetyce reakcji chemicznych jest tzw. czas połówkowy reakcji, tj. czas, po upływie którego stężenie substratu spada do połowy początkowej wartości.
Podstawiając do równania (6.4) c - 1 /2c0, otrzymujemy, że czas połówkowy r dla reakcji pierwszego rzędu wynosi
(6.6)
Wynika stąd, że czas ten nic zależy od stężenia początkowego substratu. Równanie reakcji drugiego rzędu uwzględniające tylko jeden rodzaj cząs-
Wyszukiwarka
Podobne podstrony:
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
450 [1024x768] KINETYKA CHEMICZNA Po scałkowaniu otrzymujemy = kt (6.14) 1 _ f (2b
454 [1024x768] KINETYKA CHEMICZNA miast a—jest stężeniem początkowym wyjściowego substratu A. Równan
470 [1024x768] KINETYKA CHEMICZNA pomiędzy cząsteczkami. Przyjmując taki wyidealizowany model, możem
474 [1024x768] KINETYKA CHEMICZNA Rys. 6.9. Analizator aminokwasów A AA 881 prod. KOVO ilości zaadso
484 [1024x768] KINETYKA CHEMICZNAStruktura enzymów Enzymy —BtOKATALI- ZATORY Biokatalizatory —enzymy
488 [1024x768] KINETYKA CHEMICZNA 3) następuje wzbudzenie do tak wysokich stanów o
490 [1024x768] KINETYKA CHEMICZNA przy czym r = ^ określa czas życia stanu wzbudzonego D* w nieobecn
skan0117 (2) 120 Termodynamika chemiczna 165 3g:l. Ciśnienie C02(g) nad stałym CaC03 w temperaturze
444 [1024x768] część szósta kinetyka chemiczna
446 [1024x768] 456 KINETYKA CHEMICZNA Współczynniki potęgowe przy stężeniach w równaniach kinetyczny
452 [1024x768] 462 KINETYKA CHEMICZNA Przykład Przebieg reakcji 3 HCNO=(HCNO)j badano na podstawie s
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
458 [1024x768] 468 KINETYKA CHEMICZNA Przykład 3 Pewna reakcja w lemp. 40°C po upływie 15 min. zacho
462 [1024x768] 472 KINETYKA CHEMICZNA Szybkość więc reakcji będzie określonad[C] d / *K*lA][B]. (6.4
468 [1024x768] 47* KINETYKA CHEMICZNA Strzałkami zaznaczono kierunek przenoszenia ładunku ujemnego p
472 [1024x768] 482 KINETYKA CHEMICZNA stosuje się różne związki, najczęściej celit (glinokrzemian),
478 [1024x768] 488 KINETYKA CHEMICZNA wymieniacza. Dla ilościowego opisu równowagi można także posłu
480 [1024x768] 490 KINETYKA CHEMICZNA centrów aktywnych. Jeżeli wyrazimy izotermę Langmuira w postac
więcej podobnych podstron