WSTĘP TEORETYCZNY:
Stałą szybkości reakcji nazywamy współczynnik proporcjonalności k w równaniu kinetycznym.
W klasycznej kinetyce przyjmuje się, że stała k jest niezależna od stężenia reagentów i czasu reakcji, natomiast zmienia się z temperaturą i zależy od rodzaju i stężenia katalizatorów. Stała szybkości wyraża liczbowo szybkość reakcji, gdy stężenie każdego z substratów wynosi 1 mol/l. Wymiar stałej zależy od postaci równania kinetycznego i wyraża się ogólnym wzorem:
Jodowanie acetonu jest reakcją autokatalizowaną przez jony wodorowe, będące jednym z jej produktów:
Jest to reakcja dwustopniowa, następcza:
Etap I
Etap II
Etap I jest powolny, odwracalny i decydujący o szybkości całej reakcji. Przebieg jego jest następujący:
postać ketonowa postać enolowa
W rezultacie szybkość całej reakcji zależy od stężenia acetonu (a-x) i kwasu (b+x), a nie zależy od stężenia jodu. Reakcja jodowania acetonu jest reakcją drugiego rzędu i szybkość jej możemy wyrazić następującym wzorem:
lub po scałkowaniu:
gdzie:
k - stała szybkości
a - początkowe stężenie acetonu
b - początkowe stężenie jonów wodorowych
x - ubytek stężenia acetonu (równy przyrostowi stężenia kwasu) po czasie t
Energią aktywacji nazywamy minimum energii jaką powinny być obdarzone cząsteczki, aby mogły przereagować. Można ją obliczyć na podstawie równania Arrheniusa:
A - współczynnik częstotliwości
Energię aktywacji można również obliczyć znając dwie stałe szybkości danej reakcji w dwóch różnych temperaturach ze wzoru:
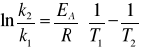
lub badając nachylenie prostej w układzie współrzędnych lg k = f(1/T).
WYNIKI:
OPRACOWANIE WYNIKÓW:
Podstawiając do wzoru kolejno każdą otrzymaną wartość otrzymujemy wykres obrazujący zależność zmian stężenia w czasie
![]()
gdzie:
k - stała szybkości
a - początkowe stężenie acetonu
b - początkowe stężenie jonów wodorowych
x - ubytek stężenia acetonu (równy przyrostowi stężenia kwasu) po czasie t
Stężenia początkowe acetonu a i kwasu b, zostały obliczone na podstawie zależności:

Ubytek stężenia acetonu „x” (i równy mu przyrost stężenia kwasu) po upływie czasu t obliczamy w oparciu o równanie reakcji redukcji jodu tiosiarczanem i reakcję jodowania acetonu. Ubytek ten jest dwukrotnie mniejszy od ubytku tiosiarczanu, a więc: od różnicy ilości moli Na2S2O3 zużyte na początku (Vo) i po upływie czasu t (V1) na zmiareczkowanie nadmiaru jodu
![]()
gdzie Vo i Vt to ilości Na2S2O3 zużyte na zmiareczkowanie 25 cm3 mieszaninie reagującej na początku reakcji (t=0) i po czasie t, c - stężenie Na2S2O3 w mol/dm3
Podczas eksperymentu badano stałą szybkości reakcji jodowania acetonu w stałej temperaturze (298,15 K) dla dwu mieszanin reakcyjnych o różnym stężeniu kwasu solnego (35 ml HCl i 25 ml HCl). Wartości tych stałych wynoszą odpowiednio:
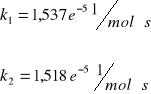
OPIS WYKONYWANEGO ĆWICZENIA:
Do kolby miarowej o pojemności 250 cm3 odmierzyłam dokładnie podane przez asystenta ilości kwasu solnego (35 ml i 25 ml) i jodu (50 ml). Mieszaninę rozcieńczyłam wodą destylowaną tak, aby do objętości 0,25 dm3 brakowało kilka cm3. Kolbę z roztworem wstawiłam do termostatu (temperatura = 25 oC = 298,15 K). Następnie po ustaleniu się temperatury (ok. 20 minut) odmierzyłam pipetą 4 cm3 acetonu i wlałam do kolby. Dopełniłam jej zawartość wodą destylowaną do kreski. Szybko wymieszałam i pobrałam próbkę mieszaniny reagującej pipetą o pojemności 25 cm3. Pobraną próbkę roztworu wlałam do kolby napełnionej uprzednio 25 cm3 0,15 M roztworem NaHCO3 i miareczkowałam ją 0,02 M Na2S2O3. Kolejne próbki pobierałam co 15 minut, notując czas, jaki upłynął od chwili rozpoczęcia reakcji do momentu jej zahamowania w podanej próbce.
WNIOSKI:
Jodowanie acetonu jest reakcją autokatalizowaną przez jony wodorowe będące jednym z jej produktów. Jest to reakcja dwustopniowa, następcza. Etap I jest powolny, odwracalny i decydujący o szybkości całej reakcji. Przebieg jest
następujący:
Etap I
Etap II
Celem mojego ćwiczenia było oznaczenie stałej szybkości jodowania acetonu. W klasycznej kinetyce przyjmuje się, że stała k jest niezależna od stężenia reagentów i czasu reakcji, natomiast zmienia się z temperaturą i wyraźnie zależy od rodzaju i stężenia katalizatorów.
Jak już wcześniej napisałam stałe szybkości wyznaczone za pomocą programu „kinetyka chemiczna” (dla HCl równego 25 i 35 cm3) wynoszą kolejno:
k![]()
k![]()
Z moich jednak obliczeń wynika, że ów stałe wynoszą kolejno:
k![]()
k![]()
Zatem błędy bezwzględne wynoszą kolejno:
Dla HCl = 25 cm3 błąd wynosi ![]()
Dla HCl = 35 cm3 błąd wynosi ![]()
Błędy jak widać są dość duże, jednak nie potrafię wskazać miejsca błędu. Być może został on popełniony podczas obliczeń stałych k dla pojedynczych pomiarów. Całe doświadczenie starałam się wykonywać prawidłowo, dokładnie i precyzyjnie.
10
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
22, chemia fizyczna laboratorium, 22
Pytanianakolosach, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
chemia fizyczna laboratoria, 12Ania, cccccccc
więcej podobnych podstron