Anna Wieczorek 03.12.2001
Wydział Chemii Spożywczej i Biotechnologii
Kierunek: Technologia Chemiczna
Gr. 3, semestr 3
LABORATORIUM Z CHEMII FIZYCZNEJ
Ćwiczenie nr 35
Temat: Oznaczanie stałej równowagi reakcji
I![]()
+ I![]()
↔ [I![]()
]
Wstęp:
Prawo podziału mówi, że dla układu trójskładnikowego, zawierającego dwie ciecze A i B oraz składnik C rozpuszczalny w każdej z nich, mamy:
K = ![]()
(1)
Gdzie: c![]()
to stężenia molowe odpowiadające ułamkowi ( roztwór C w A )
c![]()
to stężenie molowe odpowiadające ułamkowi ( roztwór C w B )
K to stała podziału zależna od parametrów P i T
W przypadku, gdy składnik dysocjuje lub asocjuje w jednej z faz, wzór przybiera postać:
K = ![]()
(2)
Gdzie n jest stałą
Wykorzystanie prawa podziału , wymaga znajomości wartości stałych K i n. Można by je wyznaczyć, mierząc stężenia : c![]()
i c![]()
w obu fazach pozostających ze sobą w równowadze. Ale taki sposób postępowania napotyka na trudności analityczne. Dlatego badaniu poddaje się jedną fazę, łatwiejszą do analizy. A mianowicie przygotowuje się roztwór wyjściowy C w A o stężeniu c![]()
( ![]()
). Pobiera się jego próbkę o objętości V![]()
(w l ) i dodaje cieczy B o objętości V![]()
(w l ). Składnik C przechodzi częściowo do roztworu C w A do cieczy B. Po ustaleniu się równowagi stężenie c![]()
w fazie C + A maleje do c![]()
, a w fazie C + B osiąga wartość c![]()
. A zatem liczba moli składnika C, których ubyło z roztworu C w A wynosi (c![]()
- c![]()
)* V![]()
. Stąd stężenie c![]()
jest równe:
c![]()
= ![]()
(3)
Stężenia c![]()
i c![]()
mierzy się metodą miareczkowania objętościowego, kolorymetryczną, refraktometryczną itd. Stałą podziału podziału wyraża się więc ostatecznie wzorem:
K = 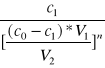
(4)
Uwzględniając, że zależność lg c![]()
= f(lg c![]()
) jest liniowa, można stąd obliczyć wielkości n i lg K.
W niektórych przypadkach pomiary stałej podziału umożliwiają wyznaczenie stałej równowagi reakcji zachodzącej w jednej z faz, np.: jon dodany do wodnego roztworu jodku potasu ulega reakcji chemicznej:
I![]()
+ I![]()
= I![]()
(5)
Której chemiczna stała równowagi wynosi:
K![]()
= 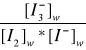
(6)
Uwzględniając, że w wodnym roztworze KI część rozpuszczonego jodu jest w postaci wolnej, a część ulega związaniu, tworząc I![]()
, stałą podziału jodu pomiędzy ten roztwór a ciecz organiczną ( benzen, tolusen, czterochlorek węgla ) można wyrazić:
K = ![]()
(7)
Gdzie indeksy „0” i „W” odnoszą się odpowiednio do warstwy cieczy organicznej i warstwy i warstwy wodnego roztworu KI.
Z wzorów: (6) i (7) otrzymuje się:
![]()
- 1 = K![]()
*[I![]()
]![]()
(8)
gdzie K![]()
= ![]()
oznacza stałą podziału pomiędzy „czystą” wodę bez KI i ciecz organiczną. A zatem mierząc wielkości K dla roztworów KI o różnych stężeniach oraz stałą K![]()
można wyznaczyć stałą równowagi K![]()
reakcji (5) .
Wyniki:
Lp. |
[I stężenie KI |
A |
K |
|
|
|
|
|
|
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
22, chemia fizyczna laboratorium, 22
Pytanianakolosach, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
chemia fizyczna laboratoria, 12Ania, cccccccc
więcej podobnych podstron