
Ciepło topnienia ciała stałego
- 1 -
WYZNACZANIE CIEPŁA TOPNIENIA CIAŁ STAŁYCH
Cele ćwiczenia:
1. Wykorzystanie bilansu cieplnego do wyznaczania ciepła topnienia.
2. Szacowanie niepewności pomiarowej i ustalenie najbardziej
prawdopodobnej przyczyny odstępstwa uzyskanej wartości ciepła
topnienia od wartości tablicowej.
Spis przyrządów:
Kalorymetr, waga techniczna, odważniki, termometr.
Zagadnienia:
1. Przemiany fazowe, wykres fazowy, krzywa ogrzewania substancji
krystalicznej.
2. Definicja energii wewnętrznej, temperatury, ciepła, ciepła właściwego,
pojemności cieplnej, ciepła topnienia i ich jednostki.
3. I zasada termodynamiki.
4. Sposób wyznaczania ciepła topnienia lodu przy użyciu kalorymetru.
Układanie bilansu cieplnego.
Literatura:
1. T. Dryński, Ćwiczenia laboratoryjne z fizyki, PWN, Warszawa, 1978
2. Halliday D., Resnick. R, Walker.J, Podstawy fizyki, Wydawnictwo
Naukowe PWN, Warszawa 2003.
3. M. Skorko, Fizyka, PWN, Warszawa, 1973.
4. S. Szczeniowski, Fizyka doświadczalna, cz. 2, PWN, Warszawa, 1980.
5. H. Szydłowski, Pracownia fizyczna, PWN, Warszawa, 1994.
6. Praca zbiorowa pod redakcją Cz. Kajtocha, I Pracownia Fizyczna
Wydawnictwo Naukowe AP, Kraków 2007

Ciepło topnienia ciała stałego
- 2 -
WYZNACZANIE CIEPŁA TOPNIENIA LODU.
Tok postępowania:
1. Potłuc lód na kilka większych kawałków i włożyć do zlewki z wodą.
2. Włączyć garnek elektryczny i podgrzać wodę do temperatury około 70
o
C.
3. Zważyć puste, suche wewnętrzne naczynie kalorymetryczne wraz
z mieszadłem - m
k
.
4. Wlać do naczynia kalorymetrycznego wewnętrznego ok. 1/2 jego objętości
wodę o temperaturze ok. 70
o
C, całość ponownie zważyć i zanotować
w tabeli jako m
1
.
5. Naczynie kalorymetryczne z wodą i mieszadłem wstawić do kalorymetru
(naczynia zewnętrznego), przykryć tekturową pokrywą, zanurzyć
termometr i odczytać temperaturę początkową - t
p
.
6. Wyjąć jeden kawałek lodu ze zlewki i osuszyć go w szmatce.
7. Włożyć szybko osuszony lód (trzymając przez szmatkę) do wewnętrznego
naczynia kalorymetru, zamknąć i przykryć. Obserwować spadek
temperatury, pamiętając o mieszaniu. Gdy temperatura przestanie się
zmieniać (kilka powtarzających się wyników odczytu temperatury
świadczy o zakończeniu procesu wymiany ciepła w kalorymetrze),
odczytać i zanotować temperaturę końcową t
k
. Odkryć kalorymetr
i delikatnie otworzyć naczynie kalorymetryczne, sprawdzając czy lód
stopniał w całości.
8. Wyjąć naczynie kalorymetryczne i zważyć je ponownie (wraz
z mieszadłem), zanotować w tabeli jako m
2
. Obliczyć masę lodu m
L
.
Ciepło topnienia ciała stałego
- 3 -
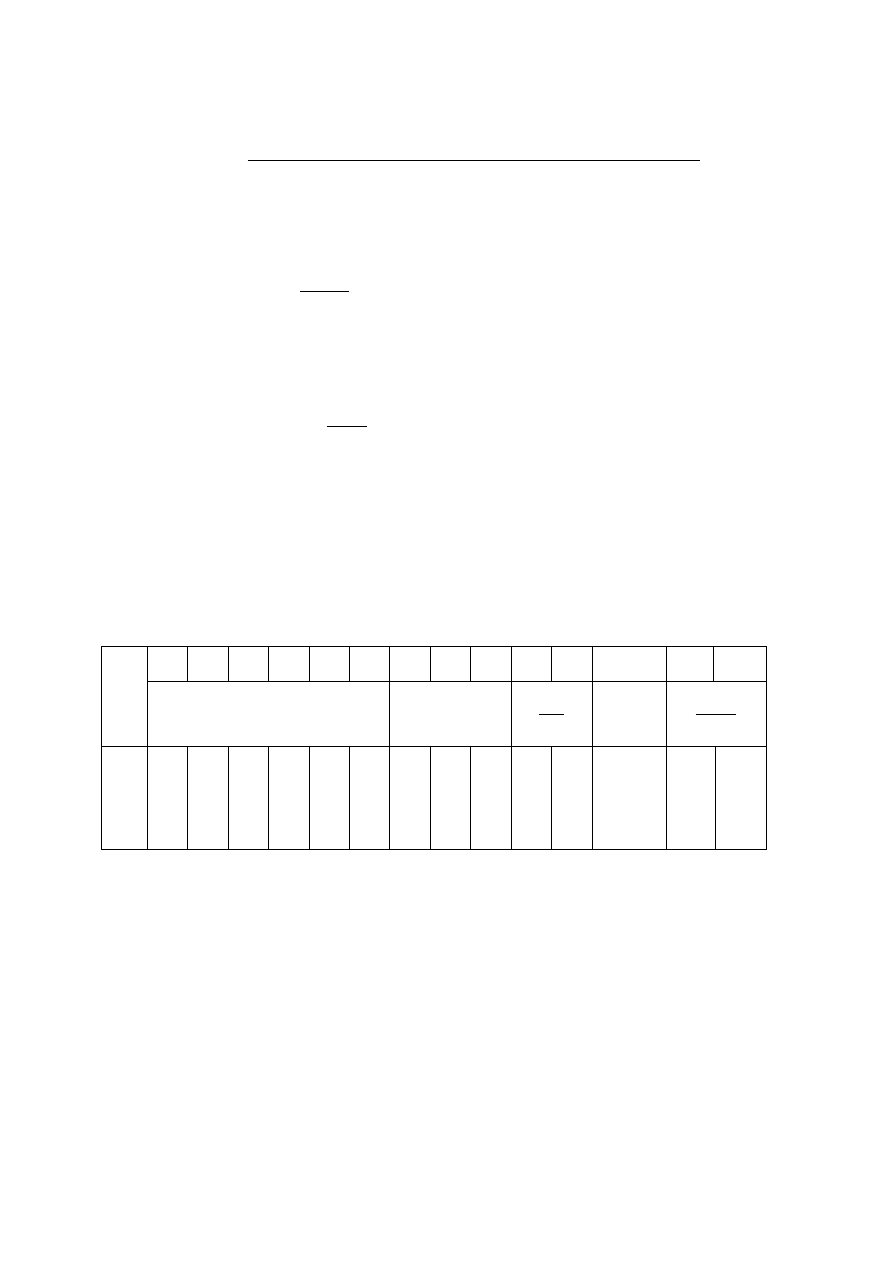
9. Obliczyć ciepło topnienia lodu L ze wzoru
L
t
k
wody
wl
L
k
p
Al
wl
k
wody
wl
w
m
)
t
t
(
c
m
)
t
t
)(
c
m
c
m
(
L
gdzie:
t
t
- temperatura topnienia lodu ( 0
o
C);
c
wł Al
= 896
K
kg
J
- ciepło właściwe naczynia kalorymetrycznego,
wykonanego z aluminium;
c
wł wody
= 4185
K
kg
J
- ciepło właściwe wody.
10. Obliczyć niepewność pomiarową i odchylenie od wartości tablicowej.
11. Powtórzyć wszystkie pomiary 2
3 razy dla innych wartości m
L
.
Tabela pomiarowa
Lp. m
k
m
1
m
w
m
2
m
L
m t
p
t
k
t L
L L/L
tab
c
w
c
k
[kg]
[
C]
kg
J
[-]
K
kg
J
1.
2.
3.
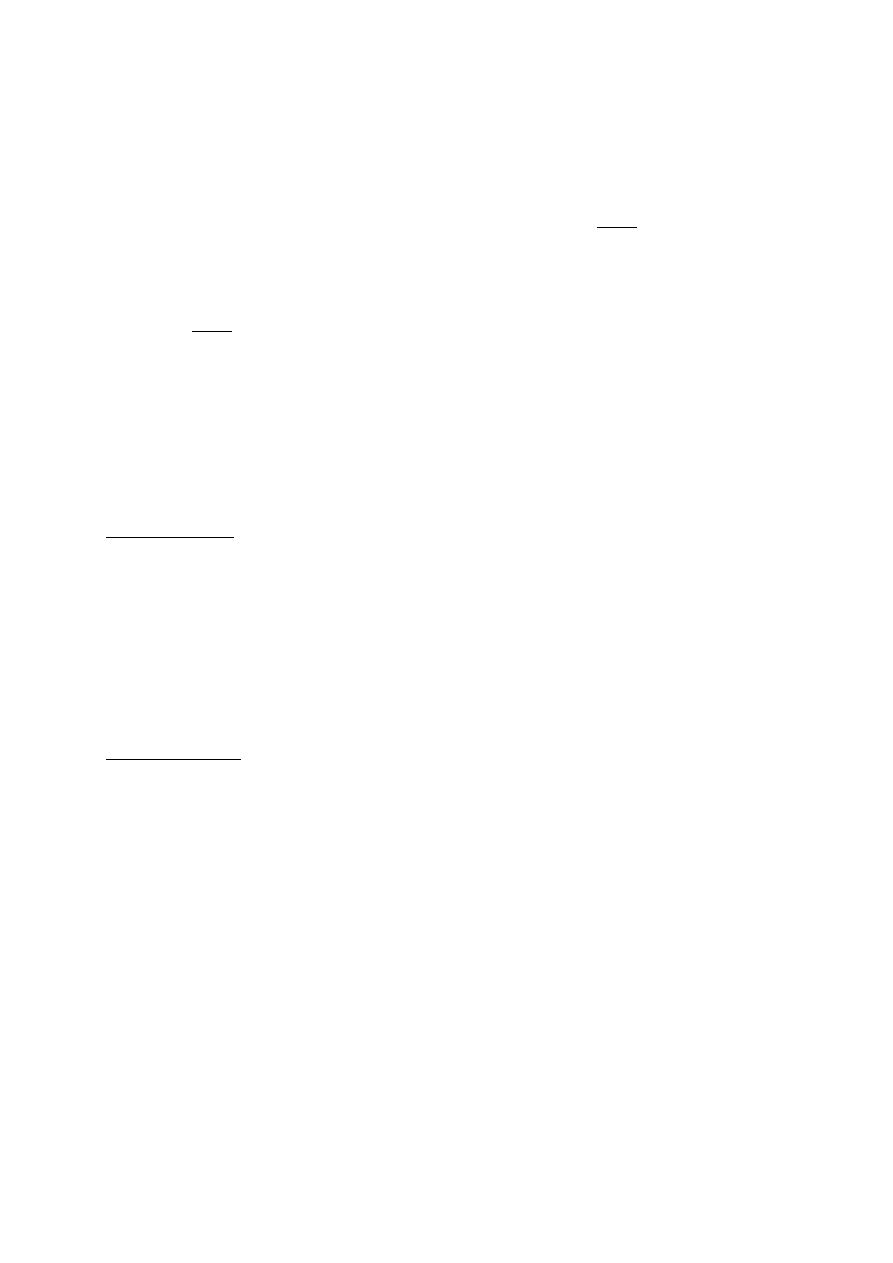
Ciepło topnienia ciała stałego
- 4 -
W ćwiczeniu "Wyznaczanie ciepła topnienia lodu" w wymianie ciepła biorą
udział :
1. Kalorymetr o masie m
k
[kg] i cieple właściwym C
włAl
K
kg
J
.
2. Woda, nalana do kalorymetru, o masie m
w
[kg] i cieple właściwym
C
wł wody
K
kg
J
.
3. Topniejący lód o masie m
L
i cieple topnienia L.
4. Woda, która powstała z topniejącego lodu.
Bilans cieplny
Ciepło oddane:
1. przez kalorymetr:
Q
1
= m
k
c
włAl
(
t
1
)
t
1
=(t
p
t
k
)
(1)
2. przez podgrzaną wodę nalaną do kalorymetru:
Q
2
= m
w
c
wł wody
(
t
1
)
(2)
Ciepło pobrane:
3. przez topniejący lód
Q
3
= m
L
L
(3)
4. przez wodę, która powstała z topniejącego lodu
Q
4
= m
L
c
wł wody
(
t
2
)
t
2
=(t
k
- t
p
)
(4)
gdzie:
t
p
= t
t
= 0
o
C
Bilans cieplny
Q
1
+ Q
2
= Q
3
+ Q
4
Q
3
= Q
1
+ Q
2
Q
4
m
L
L = Q
1
+ Q
2
Q
4

Ciepło topnienia ciała stałego
- 5 -
L
4
2
1
m
Q
Q
Q
L
L
t
k
wody
wl
L
k
p
Al
wl
k
wody
wl
w
m
)
t
t
(
c
m
)
t
t
)(
c
m
c
m
(
L
Uwaga:
Ponieważ w bilansie występuje różnica temperatur
t, możemy nie przeliczać
jednostek, pozostawiając temperaturę w stopniach Celsjusza, w obliczeniach
nie będzie to miało wpływu na wartość
t.
T[K] = t[
o
C] + 273,15
Wstęp teoretyczny
Ciepło - jest wielkością charakteryzującą przepływ energii wywołany różnicą temperatur.
Wzrost temperatury od początkowej (t
p
) do
końcowej (t
k
) wymaga dostarczenia układowi ciał
jednorodnych ciepła (Q) proporcjonalnego do iloczynu masy i różnicy tych temperatur:
)
t
t
(
cm
Q
p
k
Współczynnik proporcjonalności c, zależy od rodzaju substancji i od warunków wymiany ciepła (stałego
ciśnienia (p = const), czy stałej objętości (V=const) i nazywamy go ciepłem właściwym czyli ilością
ciepła konieczną do ogrzania jednostki masy -1kg substancji o 1K. Przy dokładnych pomiarach okazuje
się, że c jest funkcją temperatury i dla niezbyt dużych różnic t
p
i t
k
można założyć zależność liniową
.
Wielkość c· m, nazywamy pojemnością cieplną ciała. Pojemność cieplna jest to ciepło konieczne do
ogrzania masy o 1K. Ciepło mierzymy w tych samych jednostkach co pracę i energię czyli w dżulach
J
]
Q
[
zaś ciepło właściwe ma wymiar:
kgK
J
]
T
][
m
[
]
Q
[
]
c
[
.
Ilość ciepła pobrana przy zmianie temperatur od t
p
do t
k
równa jest ilości ciepła oddanego dla zmiany od
t
k
do t
p
przy przejściu przez te same stany pośrednie.
Ciepło topnienia - to z kolei ilość ciepła konieczna do stopienia 1kg substancji w stałej
temperaturze:
m
Q
L
, gdzie jednostka
kg
J
]
L
[
.

Ciepło topnienia ciała stałego
- 6 -
Przyrządem służącym do takich pomiarów jest kalorymetr, składający się z dwóch koncentrycznie
osadzonych naczyń metalowych, między którymi znajduje się, źle przewodząca ciepło, warstwa
powietrza. Naczynie wewnętrzne oddzielone jest podpórkami wykonanymi z materiałów izolujących a
całość zakryta pokrywą z materiału nieprzewodzącego ciepło. Straty ciepła, związane są głównie z
wymianą przez promieniowanie podczerwone.
Zasada pomiarów kalorymetrycznych polega na ustaleniu bilansu ciepła, czyli porównania ciepła
traconego przez ciała cieplejsze i zyskane przez chłodniejsze.
W przypadku pomiaru ciepła topnienia lodu mierzymy spadek temperatury w kalorymetrze od t
p
do t
k
związany ze stopieniem w wodzie lodu i następnie jej podgrzaniem od temperatury topnienia.
Bilans ciepła w kalorymetrze.
Lód topiąc się pobiera ciepło
L
1
Lm
Q
nie zmieniając przy tym swej temperatury, natomiast woda
powstała po stopieniu ogrzewa się od zera 0
0
C do t
k
, zatem pobiera ciepło:
)
C
0
t
(
m
C
Q
k
L
W
2
.
Ciepło traci natomiast kalorymetr
)
t
t
(
m
c
Q
k
p
k
k
3
i woda:
k
p
w
w
4
t
t
m
c
Q
.
Zgodnie z równaniem bilansu otrzymujemy:
4
3
2
1
Q
Q
Q
Q
czyli:
k
p
w
w
k
p
k
k
k
L
W
L
t
t
m
c
t
t
m
c
C
0
t
m
c
Lm
a zatem :
L
k
L
w
k
p
w
w
k
p
k
k
m
C
0
t
m
c
t
t
m
c
t
t
m
c
L
.
Ciepła właściwe wody (c
w
) i materiału (c
k
), z którego wykonany jest kalorymetr (zwykle glin)
przyjmujemy jako znane - z tablic.
Z powyższego wzoru wynika, że należy wyznaczyć: m
k
, m
w
( przed i po stopieniu lodu), obliczyć m
L
i
wyznaczyć właściwie temperatury: t
p
oraz t
k.
Q
1
- ciepło potrzebne do stopienia lodu
Q
2
- ciepło potrzebne do ogrzania wody powstałej z lodu
Q
3
- ciepło tracone przez kalorymetr
Q
4
- ciepło tracone przez wodę
Wyszukiwarka
Podobne podstrony:
wyznaczanie ciepa waciwego cia staych2
02, WST$P, Jedn˙ z podstawowych metod laboratoryjnych wyznaczania g˙sto˙ci cia˙ sta˙ych i cieczy jes
Wyznaczanie ciep a w a ciwego cia sta ych, PRACOWNIA ZAK˙ADU FIZYKI PL
wyznaczanie wsp˘czynnika rozszerzalnoci cia staych
Fizyka 37, W cia˙ach sta˙ych energie elektron˙w ograniczone s˙ dopewnych poziom˙w, kt˙re z kolei na
pytania z katalizy, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
LASER11, Wyznaczanie szeroko˙ci szczelin, sta˙ych siatek dyfrakcyjnych i d˙ugo˙ci fali spr˙˙ystej w
zaliczenie wyk-adu 1, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
FIZ-47, 1.Cel ˙wiczenia: Wyznaczenie charakterystyki o˙wietleniowej fotoogniwa oraz zbadanie
LASER10, Wyznaczanie szeroko˙ci szczelin, sta˙ych siatek dyfrakcyjnych i d˙ugo˙ci fali spr˙˙ystej w
LčD, 13.1 Wyznaczanie ciep˙a topnienia lodu.
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Wyznaczanie ciep-a topnienia lodu(czewrwony), Studia PWr W-10 MBM, Semestr II, Fizyka, Fizyka - labo
więcej podobnych podstron