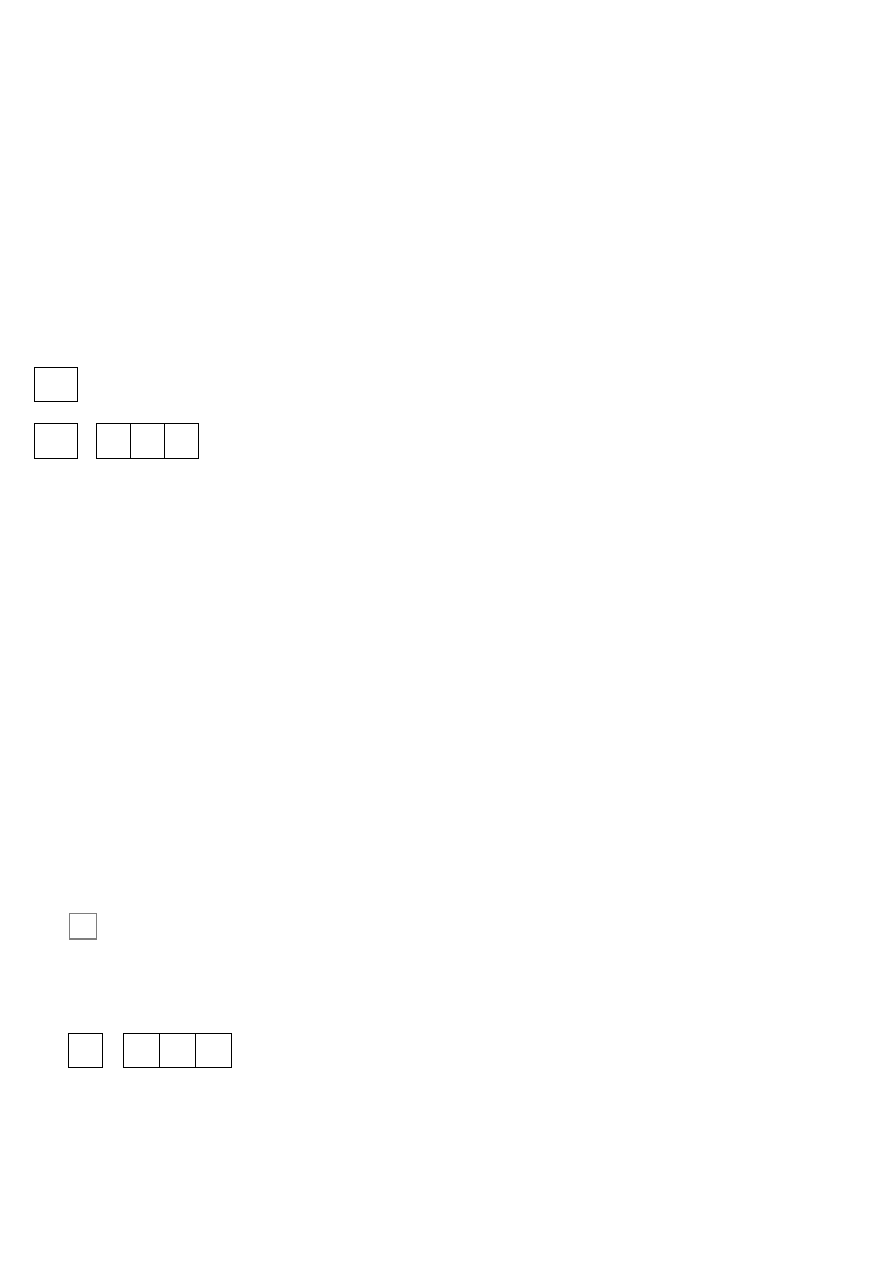
1
n
= 2;
1
l
= ___
1
m
= ___
1
s
m
= ___
2
n
= ___
2
l
= ___
2
m
= ___
2
s
m
= ___
Budowa atomu_ćwiczenie 4
1.(0 – 3 pkt)
Napisz konfigurację elektronową atomów artenu As
75
33
i chromu
Cr
52
24
. Podkreśl elektrony walencyjne tych
atomów.
……………………………………………………………………….......................................................................
…………………………………………………………………………...................................................................
2.(0 – 2 pkt)
Na podstawie konfiguracji elektronowej atomu siarki:[
10
Ne] 3s
2
3p
4
, określ typowe stopnie utlenienia tego
pierwiastka w związkach z;
a) tlenem…………………………….......... b) wodorem …………………………...................
3.(0 – 2 pkt)
W stanie podstawowym atom węgla tworzy konfiguracje elektronową: 1s
2
2s
2
2p
2
, którą można przedstawić w
systemie klatkowym:
Określ cztery liczby kwantowe opisujące stan dowolnego niesparowanego elektronu
……………………………………………………….........................................................
4. (0 – 3) Napisz konfigurację elektronową atomów bromu i manganu. Podkreśl elektrony walencyjne tych
atomów.
…………………………………………………………………………………………………………………
……………………………………….................................................................................................................
5. (0 – 2) Napisz skróconą konfigurację elektronową atomu arsenu oraz określ typowe stopnie utlenienia tego
pierwiastka w związkach z tlenem.
…………………………………………………………………………………………………………………
……………………………………….................................................................................................................
6. (0 – 2) Podaj wartość 3 liczb kwantowych opisujących podane orbitalne:
a) 6s ………………………………………………………………….
b) 3p
x
…………………………………………………………………..
7.
(0 – 4 pkt) Ustal zespół liczb kwantowych dla podanych elektronów:
a)
b)
1
n
= 1;
1
l
= _______
1
m
= _______
1
s
m
= _________
2
n
= ___
2
l
= _______
2
m
= _______
2
s
m
= _________
Wyszukiwarka
Podobne podstrony:
Budowa atomu ćwiczenie 5
budowa atomu ćwiczenie 2(1)
budowa atomu ćwiczenie 3
budowa atomu ćwiczenie 1(1)
Budowa atomu ćwiczenie 5
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu zadania
budowa atomu I
budowa atomu
więcej podobnych podstron