
Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
1
Ćwiczenie
nr 1
Temat ćwiczenia:
Elektroliza wody
Konspekt
Nr zespołu:
Wydział, rok, grupa:
Data
Ocena
Nazwisko i imię
Teoria
Wykonanie ćwiczenia
Końcowa z ćwiczenia
1.
2.
Elementy układu:
1. elektrolizer,
2. zmienne obciążenie zewnętrzne,
3. amperomierz,
4. woltomierz,
5. zasilacz,
6. kable (komplet),
7. krótka rurka,
8. klipsy,
9. stoper,
10. woda dejonizowana ( destylowana).
1.Informacje wstępne
Elektroliza jest procesem rozkładu elektrolitu na elektrodach, następującym w wyniku
przepływu prądu przez ten elektrolit. Tak więc, w trakcie elektrolizy do układu doprowadzana jest
energia elektryczna. Warunkiem przepływu prądu przez elektrolit jest istnienie w nim
naładowanych cząstek – jonów. Jony te mogą powstać w wyniku rozstrzepienia substacji pod
wpływem oddziaływania z rozpuszczalnikiem (dysocjacji), tak jak to ma miejsce w roztworze
wodnym NaCl (NaCl dysocjuje na kationy Na
+
i aniony Cl
-
). W wodnych roztworach elektrolitów
jony otoczone są grupą oddziaływujacych z nimi cząteczek wody (są hydratyzowane). Gdy
dysocjacja ma miejsce w roztworze niewodnym otaczają je cząsteczki rozpuszczalnika – jony są
solwatyzowane. W wiekszości, sole stopione w stanie ciekłym składają się wyłącznie z jonów – są
cieczami jonowymi. Pewne substancje w stanie stałym, na przykład tlenek cyrkonu ZrO
2
stabilizowany tlenkiem itru Y
2
O
3
, w podwyższonej temperaturze charakteryzują się również
wysokim przewodnictwem jonowym. Przepływ ładunku przez stały elektrolit następuje na skutek
wędrówki jonów O
2-
po defektach sieciowych podsieci anionowej (tlenkowej). Przepływ prądu
przez elektrolit wiąże się z przepływem masy. Elektrolity są przewodnikami drugiego rodzaju.
Na anodzie elektrolizera (elektrodzie dodatniej) ma miejsce proces elektroutleniania, w
trakcie którego do elektrody dopływają aniony i oddają elektrony. Na katodzie (elektrodzie
ujemnej) ma miejce proces elektroredukcji, w trakcie którego kationy pobierają elektrony.
Produkty elektrolizy wydzielają się na elektrodach.

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
2
W przeciwieństwie do elektrolizera, do którego dostarczana jest energia, ogniwo
galwaniczne dostarcza energii elektrycznej. W ogniwie galwanicznym proces anodowy
(elektroutleniania) przebiega na elektrodzie ujemnej, zaś proces elektroredukcji na dodatniej
katodzie.
Ogniwo galwaniczne
Elektrolizer
Reakcje przebiegają samorzutnie.
Reakcje są wymuszane przyłożonym z zewnątrz
napięciem
Przebiegające w ogniwie reakcje powodują
przepływ elektronów w obwodzie
zewnętrznym.
Kierunki przepływu prądu w układzie
elektrolizera i ogniwie są przeciwne
Procesy polegają na przekazaniu energii z
ogniwa do otoczenia, czyli do obwodu
zewnętrznego (procesy egzoenergetyczne).
Zewnętrzne źródło prądu przekazuje energię
reagentom elektrolizera (procesy
endoenergetyczne).
Prawa Faraday’a
Zgodnie z I prawem Faraday’a, ilość wydzielonej substancji (w przypadku elektrolizy
wody – gazu) jest wprost proporcjonalna do przepływającego w czasie elektrolizy ładunku Q.
Kiedy przez elektrolizer przepuścimy ładunek 96500 C oznacza to, że przepłynął przez niego 1 mol
elektronów. Jeżeli prąd płynący przez elektrolizer nie zmienia się w czasie a jego natężenie wynosi
I to ładunek jest iloczynem natężenia prądu i czasu.
Q = I⋅ t
Teoretycznie, ilość wydzielonego wodoru można obliczyć korzystając z II prawa Faraday’a
I⋅t = n⋅z⋅F
Sprawność faradajowską elektrolizera wody, obliczamy dzieląc objętość wydzielonego
podczas elektrolizy gazu przez objętość gazu wynikającą z prawa Faraday’a
ther
H
H
F
V
V
2
2
exp
=
η
gdzie:
V
ther
2
H
- teoretyczna ilość otrzymanego wodoru [m
3
] lub[ml]
V
exp
2
H
- rzeczywista ilość otrzymanego wodoru [m
3
] lub[ml]
oraz
V
ther
2
H
=
z
p
F
t
T
I
R
⋅
⋅
⋅
⋅
⋅
[m
3
] lub [ml] lub V
ther
2
H
=
F
z
V
t
I
m
⋅
⋅
⋅
gdzie: gdzie n = V/V
m

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
3
gdzie:
V
ther
2
H
- teoretyczna ilość otrzymanego wodoru [m
3
] lub[ml]
R- uniwersalna stała gazowa; R= 8,314
⋅ K
mol
J
;
p – ciśnienie otoczenia [Pa];
F- stała Faraday’a , F= 96485
mol
C
gdzie 1 [C]=1 A
⋅
s
T – temperatura [ K]
t - czas [ s]
z - ilość elektronów potrzebna do wydzielenia jednego mola H
2
-
[ 2]
V
m
– objętość molowa
Wartość obliczonej sprawności faradajowskiej powinna być bliska 1 ( 100%).
Jeżeli więc
obliczona sprawność faradajowska < 1 (100%), to wynika to zarówno z błędów pomiarowych,
zanieczyszczenia elektrolitu jak i z istnienia tzw. straty dyfuzyjnej w elektrolizerze wody. Strata
dyfuzyjna wynika z faktu, że część gazów przepływających przez membranę ponownie łączy się
tworząc wodę. Jeżeli obliczona sprawność faradajowska wynosi na przykład 0.90 (90 %) to
wskazuje to, że przepływający prąd prawie w całości posłużył do wytworzenia paliwa wodorowego
(tylko 10% ładunku dostarczonego do elektrolizera zostało „zmarnowane” na procesy uboczne).
Sprawność energetyczna elektrolizera wody jest to stosunek energii zawartej w
otrzymanym w wyniku procesu elektrolizy wodorze, do energii elektrycznej potrzebnej do jego
wytworzenia, czyli zużytej w trakcie elektrolizy.
t
I
U
V
H
H
oH
E
⋅
⋅
⋅
=
exp
2
2
η
gdzie:
H
r
2
oH
- wartość opałowa wodoru
]
m
MJ
[
920
,
11
H
3
2
oH
−
⋅
=
,
V
exp
2
H
- rzeczywista ilość otrzymanego wodoru [m
3
] lub [ml]
Badając zależność przyłożonego do elektrod napięcia i otrzymanego natężenia prądu, otrzymamy
wykres Rys.1.

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
4
Rys.1. Wykres zmian natężenia prądu w funkcji napięcia
W stadium początkowym elektrolizy (odcinek 1), mimo przykładania coraz wyższego
napięcia nie obserwujemy znaczącego przyrostu wartości prądu płynącego w elektrolizerze oraz
wydzielania się na elektrodach gazowych produktów elektrolizy. Ma to miejsce dopiero po
osiągnięciu napięcia U
rozkł.
(odcinek 2). W przypadku elektrolizy wody, U
rozkł
musi być wyższe od
siły elektromotorycznej (SEM) ogniwa wodorowo-tlenowego, w trakcie pracy którego ma miejsce
proces odwrotny do elektrolizy wody – samoistna jej synteza.
Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
5
WYKONANIE ĆWICZENIA nr 1
A. Zapoznanie się z działaniem elektrolizera polimerowego
W ćwiczeniu nr 1 zapoznamy się z działaniem elektrolizera polimerowego, które
najważniejszą część stanowi zespół elektrod i membrany (ang. MEA = Membrane Electrode
Assembly). Zespół ten składa się z anody i katody węglowej z rozproszoną Pt i specjalnej
membrany polimerowej – Nafionu, w której nośnikami prądu są dodatnie jony wodorowe H
+
-
protony. Nafion jest to fluorowęglowy polimer, zbliżony budową do Teflonu.
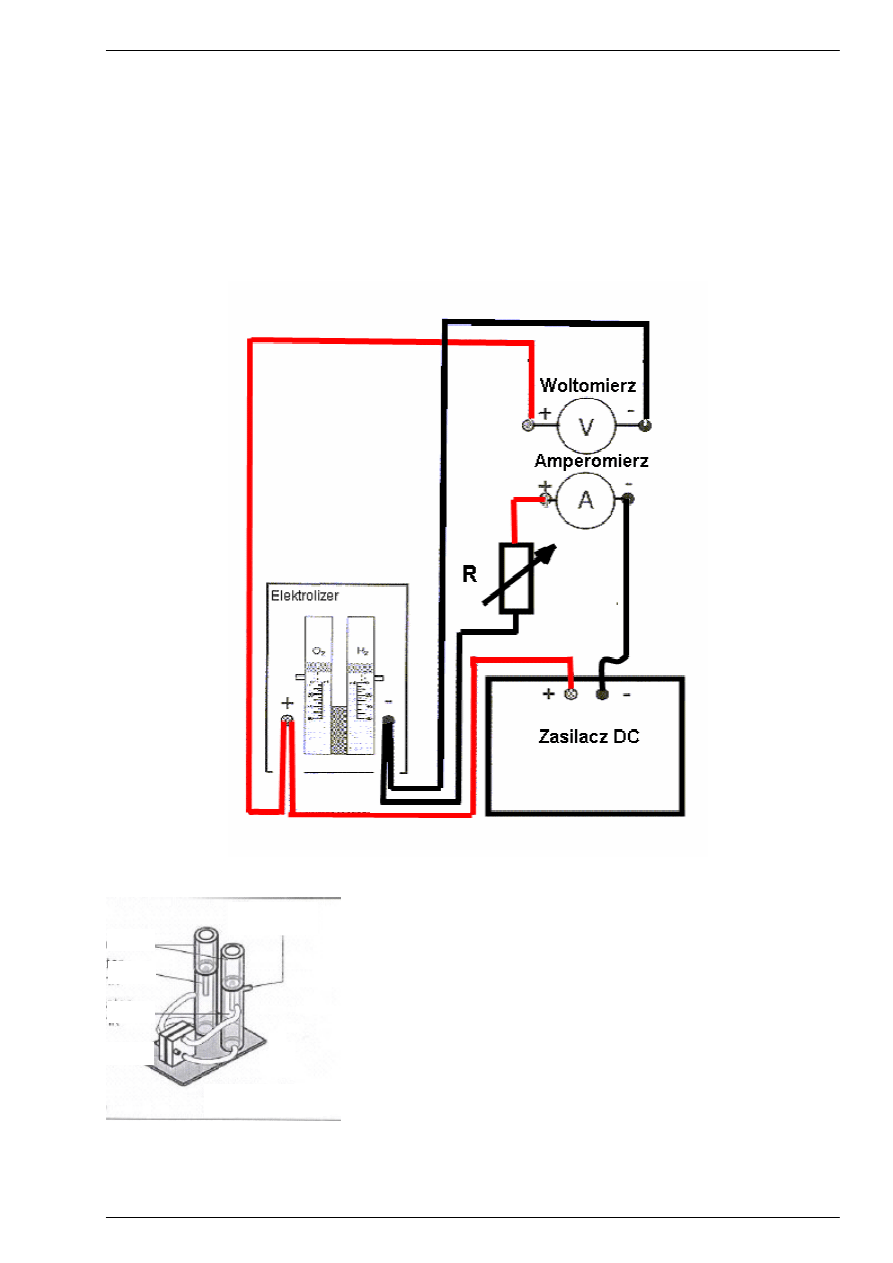
Rys.1.2. Schemat ogólny połączeń układu pomiarowego.
Rys.1.3. Budowa elektrolizera.
Objaśnienia
1) zbiorniki kompensacyjne,
2) zbiornik: O
2,
3) zbiornik: H
2,
4) elektrolizer.
1
2
3
4
Wypływ gazów
Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
6
Elektrolizer
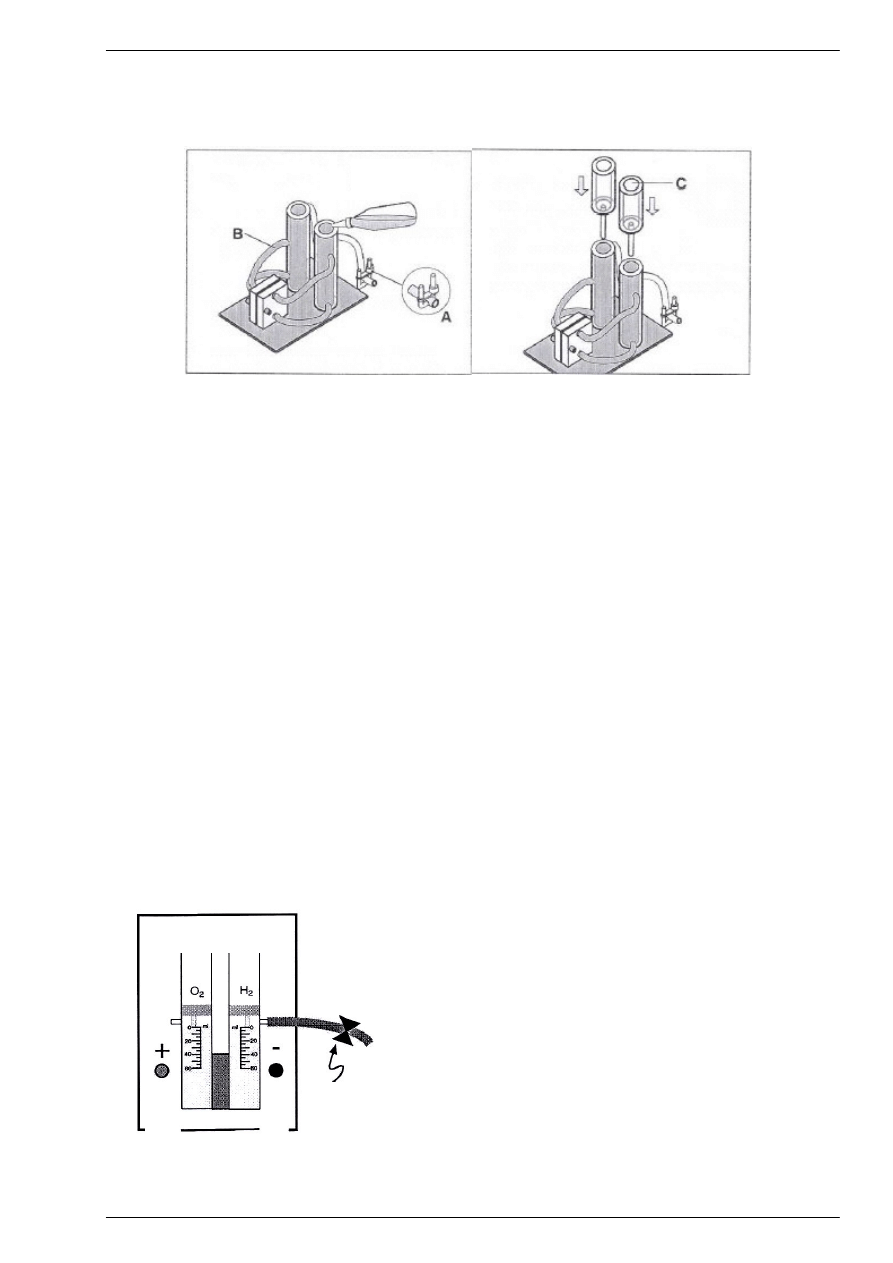
Rys.1.4. Przygotowanie elektrolizera do pracy: a) napełnianie; b) montaż.
1. Połącz układ zgodnie ze schematem przedstawionym na Rys. 1.2.
a) Gniazdo „+” zasilacza (czerwony przewód) połącz z „+” gniazdem elektrolizera.
Gniazdo „-” zasilacza ( czarny przewód) połącz z gniazdem „-” amperomierza,
a gniazdo „+” amperomierza połącz z jednym z gniazd zmiennego oporu a następnie drugie
gniazdo oporu połącz z gniazdem „-” elektrolizera.
b) Woltomierz przyłącz równolegle do elektrolizera. „+” woltomierza (przewód czerwony) przyłącz
do „+” elektrolizera zaś „-”woltomierza (przewód czarny) przyłącz do „-”elektrolizera (gniazda
czarnego) Rys.1.2.
2. Odkręć zbiorniki kompensacyjne dla wodoru i tlenu i odłóż je na bok . (Rys.1.4a)
3. Napełnij obydwa cylindry elektrolizera wodą dejonizowaną (destylowaną ) do poziomu 0 [ml],
bardzo ostrożnie aby zapobiec powstawaniu baniek powietrza w układzie. (Rys.1.4a).
4. Nałóż oba zbiorniki kompensacyjne (dla wodoru i tlenu) i dokręć je do zbiorniczków H
2
i O
2
Rys.1.4b).
5. Na rurkę od strony wodorowej nałóż klips jak pokazuje schemat na Rys. 1.5. Taki sam klips
nałóż na rurkę od strony tlenowej. Zaciśnij szczelnie klipsy (zakręć).
- 6 -
Rys.1.5. Nakładanie klipsów.
6. Ustaw zakres na woltomierzu 2V.
woda
dejonizowana
Klips
Elektrolizer
Klips

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
7
7. Ustaw zakres na amperomierzu 10 A.
8.Ustaw pokrętło obciążenia oporu zmiennego na wartość
.
∞
9.Włącz zasilacz do sieci.
10.Ustaw pokrętło obciążenia oporu zmiennego kolejno na wartości:
(a) 33 k
Ω
, (b) 10 k
Ω
i (c) 5 k
Ω
11.Odczytaj wartość napięcia wyświetloną na woltomierzu gdy na amperomierzu pojawi się
wartość 0.04A.
12. Zmień wartość oporu zmiennego na kolejną, mniejszą wartość (przekręć pokrętło oporu o jedną
pozycję w prawo). Zapisz wartość oporu w Tab.1.1.
Po ustabilizowaniu się wartości napięcia i prądu (niezmiennej w ciągu ok.1 min.) zapisz je w
Tab.1.1.
13. Odkręć (ostrożnie) pokrętło klipsa na zbiorniku wodoru i ustaw menisk wody na poziomie „0”.
14. Powtórz tą czynność dla zbiornika tlenu.
15. Zakręć klipsy na obu zbiornikach
16. Ustaw pokrętło oporu zmiennego na wartość 10
Ω
. Włącz stoper. Zapisz napięcie elektrolizera i
natężenie prądu płynącego i przez elektrolizer. Tab.1.2.
17. Co 1 minutę odczytuj na skali cylindra objętość wodoru i tlenu i wpisuj odczytaną wartość do
Tab.1.2. Gdy objętość wodoru osiągnie 20 ml zapisz w tabelce czas tego zdarzenia i odpowiadającą
mu objętość tlenu.
18. Wyłącz elektrolizer i stoper.
19. Odkręć (ostrożnie) pokrętło klipsa na zbiorniku wodoru i ustaw menisk wody na poziomie „0”.
20. Powtórz tą czynność dla zbiornika tlenu. W razie konieczności uzupełnij ilość wody do
poziomu 0.
21. Kolejne ćwiczenie przeprowadź przy stałym czasie pomiaru t = 180 [s]. Dobierz wartość oporu
na zmiennym oporniku, tak aby wartość prądu płynącego przez elektrolizer wynosiła I = ok. 0.1 A,
0.3-0.4 A, 0.6-0.9 A, oraz ok. 1 A. Odczytaj objętości wydzielonego wodoru i tlenu wyniki zapisz
w Tab.1.3

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
8
II Wyniki pomiarów i obliczenia
Tab.1.1. Charakterystyka prądowo-napięciowa elektrolizera polimerowego
Opór
R [
Ω]
Ω]
Ω]
Ω]
Napięcie ogniwa
U [V]
Natężenie prądu
I [A]
0.00
0.00
0.01
Tab.1.2. Zależność objętości wydzielonego wodoru i tlenu od czasu elektrolizy
Czas
[s]
Objętość
H
2
[ml]
Objętość
O
2
[ml]
Napięcie
U [V]
Natężenie
I [A]
0
0
0
60
Tab.1.3. Zależność objętości wydzielonego wodoru od natężenia prądu elektrolizy
t = idem = 180 s
Natężenie
I [A]
Objętość
H
2
[ml]
Objętość
O
2
[ml]
III Opracowanie wyników:
1) Wykreśl zależność prądu płynącego przez elektrolizer od napięcia elektrolizera I = f(U).
(Tab.1.1.)
2) Wyznacz napięcie rozkładowe wody dla badanego układu elektrolizera.

Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
9
3) Wykreśl zależności objętości wodoru i tlenu w funkcji czasu elektrolizy: V
H
2
= f (t) oraz
V
O
2
= f (t) (Tab.1.2.)
4) Wyznacz współczynniki regresji liniowej V= a t dla wodoru i tlenu ( V = obj. gazu, t- czas
elektrolizy, a –współczynnik regresji) przechodzącej przez początek układu współrzędnych. Podaj
współczynnik korelacji i błąd współczynników nachylenia prostych.
5) Wykreśl zależności objętości wodoru i tlenu w funkcji natężenia prądu elektrolizy V
H
2
= f( I) .
(Tab.1.3.).
6) Wyznacz współczynniki regresji liniowej V= b I ( I- prąd elektrolizy, b –współczynnik regresji)
przechodzącej przez początek układu współrzędnych. Podaj współczynnika korelacji i błąd
współczynników nachylenia prostych.
6) Oblicz stosunki współczynników pochyleń otrzymane dla obydwu regresji. Objaśnij otrzymany
wynik.
7) Sprawdź zgodność otrzymanych wyników z prawami Faraday’a. w następujący sposób:
a) Teoria
I prawo Faraday’a.
m = k
t
I ⋅
⋅
gdzie m- masa wydzielonej substancji
II prawo Faraday’a
[ ]
[ ]
C
96484
F
C
k
R
F
c
=
⇒
=
[A
⋅
s]
gdzie Rc=
z
M
gramorównoważnik wydzielonej substancji (M
H2
= 2 g; z
H2
= 2; M
02
= 32 g; z
02
= 4)
M - masa molowa [g] (M
H2
= 2 g; M
02
= 32 g)
z - ładunek jonu (względem ładunku elektronu)-(z
H2
= 2; z
02
= 4)
Stąd, korzystając z praw gazu doskonałego, otrzymujemy:
Sprawdzenie:
F
z
V
t
I
V
2
H
m
teor
2
H
⋅
⋅
⋅
=
=
t
F
Z
V
I
m
⋅
⋅
⋅
=
theor
2
H
a
t
⋅
(1)
F
z
V
t
I
V
2
H
m
teor
2
H
⋅
⋅
⋅
=
=
I
F
Z
V
t
m
⋅
⋅
⋅
=
theor
2
H
b
I
(2)
gdzie t – czas tworzenia wodoru [s]
V
m
– objętość molowa substancji = 24000 ml; 22,4 dm
3
; 24 l/mol dla T=20
0
C
F – stała Faraday’a = 96484 [C/ mol] [ As/mol]
b) Oblicz współczynniki
theor
2
H
a
i
theor
2
H
b
.
Ć
wiczenie 1. Elektroliza.
Wydział Paliw i Energii Akademii Górniczo – Hutniczej w Krakowie
10
c) Na odpowiednie wykresy (punkty (3) oraz (5)) nanieść zależności (1) i (2) z obliczonymi
współczynnikami
theor
2
H
a
i
theor
2
H
b
i objaśnij otrzymany wynik.
d) Wykonaj powyższe obliczenia i sporządź wykresy dla tlenu.
8) Oblicz sprawność faradajowską elektrolizera
Sprawność faradajowska
η
F
jest to stosunek ilości otrzymanego wodoru, do ilości wodoru, jaka
powinna być otrzymana, gdy spełnione są prawa Faraday`a.
theor
2
H
exp
2
H
F
V
V
=
η
=
theor
2
H
.
exp
2
H
V
t
a
⋅
F
z
V
t
I
V
m
teor
H
⋅
⋅
⋅
=
2
=
t
F
Z
V
I
m
⋅
⋅
⋅
=
theor
2
H
a
t
⋅
theor
2
H
a
=
F
Z
V
I
m
⋅
⋅
teor
2
H
V
=
I
F
Z
V
t
m
⋅
⋅
⋅
ther
H
H
F
V
V
2
2
exp
=
η
=
theor
2
H
.
exp
2
H
theor
2
H
.
exp
2
H
a
a
t
a
t
a
=
⋅
⋅
gdzie
t – czas tworzenia wodoru [ s]
V
m
– objętość molowa substancji [ml/mol]
F – stała Faraday’a = 96484 [C
⋅
mol
-1
][A
⋅
s/mol]
Z – liczba jonów-2 (H
2
)
I – natężenie prądu przy którym tworzony jest wodór [A]
9) Oblicz sprawność energetyczną elektrolizera.
Sprawność energetyczna to stosunek energii zawartej w wygenerowanym wodorze, do energii
elektrycznej potrzebnej do jego wytworzenia.
t
I
U
V
H
exp
2
H
2
oH
E
⋅
⋅
⋅
∆
=
η
=
=
⋅
⋅
⋅
∆
t
I
U
t
a
H
exp
2
H
2
oH
I
U
a
H
exp
2
H
2
oH
⋅
⋅
∆
gdzie
∆
H
oH2
–wartość opałowa wodoru
∆
]
m
MJ
[
920
,
11
H
3
2
oH
−
⋅
=
,
V
exp
2
H
- rzeczywista ilość otrzymanego wodoru [m
3
] lub [ml]
10) Przedyskutuj otrzymane wyniki.
Wyszukiwarka
Podobne podstrony:
Lab 2 - Elektroliza wody, Sprawozdanie 2 - Elektroliza wody, LABORATORIUM KONWERSJI ENERGII
ELEKTRONIKA cw00 id 158827 Nieznany
Fizyka Prad elektryczny test id Nieznany
ELEKTRONIKA cw05 id 158833 Nieznany
elektroforeza page id 158050 Nieznany
elektrochemia simr03pl id 15797 Nieznany
33 Schemat elektryczny FM445 id Nieznany (2)
elektrochemia simr09pl id 15797 Nieznany
Lab II Termistor instrukcja id 749857
Nasze zdrowie a rabunek wody id Nieznany
ELEKTRONIKA cw02 id 424650 Nieznany
ELEKTRONIKA cw01 id 158830 Nieznany
Instr lab elektronika Cw 2
Elektronika W10 id 159018 Nieznany
Lab I Pomiar Masy Instrukcja id 74985
sprawko3, SIMR 1ROK, SIMR SEM2, LAB. ELEKTROTECHNIKA, LABO
REGULAMIN lab ELEKTRONIKA
więcej podobnych podstron