
BO¯ENA KRÓL, PIOTR KRÓL
*)
Politechnika Rzeszowska
Wydzia³ Chemiczny
Katedra Technologii Tworzyw Sztucznych
ul. Powstañców Warszawy 6, 35-959 Rzeszów
Materia³y pow³okowe otrzymywane z kationomerów
poliuretanowych modyfikowanych funkcjonalizowanym
silseskwioksanem
Cz. I. BUDOWA CHEMICZNA KATIONOMERÓW
Streszczenie — Opisano trzyetapow¹ syntezê wodorozcieñczalnych kationomerów poliuretano-
wych (PUR) na podstawie 4,4’-diizocyjanianu difenylenometanu (MDI), oligo(oksypropyleno)gli-
kolu i N-metylodietanoloaminy (N-MDEA, dodatkowy substrat hydroksylowy i przed³u¿acz ³añ-
cucha), które — po utworzeniu jonów amoniowych w reakcji wprowadzonych grup N-alkilowych
z HCOOH oraz (na 4. etapie) dyspergowaniu w wodzie, utworzy³y trwa³e dyspersje. Kationomery
te na 3. etapie procesu (synteza prepolimeru uretanowo-izocyjanianowego) modyfikowano che-
micznie z zastosowaniem funkcjonalizowanego grupami -OH silseskwioksanu (PHIPOSS). Budo-
wê chemiczn¹ kationomerów i ich ciê¿ary cz¹steczkowe scharakteryzowano metodami IR i NMR
oraz chromatografii GPC. Metody te zastosowano równie¿ do scharakteryzowania otrzymanego
niezale¿nie PHIPOSS.
S³owa kluczowe: nanokompozyty, kationomer poliuretanowy, funkcjonalizowany silseskwio-
ksan, budowa chemiczna, ciê¿ary cz¹steczkowe.
COATING MATERIALS OBTAINED FROM POLYURETHANE CATIONOMERS MODIFIED
WITH FUNCTIONALIZED SILSEQUIOXANES
Summary — The three-stage synthesis of waterborne polyurethane cationomers on the basis of
diphenyl methane-4,4’-diisocyanate (MDI), oligo(oxypropylene glycol) and N-methyldiethanol-
amine [(N-MDEA) used as an additional hydroxylating and chain-elongating reagent] has been
presented. Stable dispersions were obtained after the quaternisation, in a further fourth stage, of
the introduced N-alkyl groups with formic acid (HCOOH) and then dispergation in water (Table
5). The cationomers obtained in the third stage of the synthesis of urethane-isocyanate prepoly-
mers were modified chemically with silsequioxanes functionalized with –OH groups (Table 6).
The chemical structure of the cationomers and their molecular weights were determined using IR,
NMR and GPC chromatography (Figs. 6—13, Tables 7—11). The same methods were also applied
in determining the properties of the obtained PHIPOSS [equation (VI), Figs. 1—5, Tables 1—4].
Key words: nanocomposites, polyurethane cationomer, functionalized silsequioxane, chemical
structure, molecular weight.
Przedmiotem znacznego zainteresowania w ostatnich
latach — ze wzglêdu na unikatowe w³aœciwoœci fizyko-
chemiczne, termiczne, mechaniczne i powierzchniowe —
sta³y siê polimery nanohybrydowe zawieraj¹ce fragmen-
ty oligosilseskwioksanowe (POSS). Wykorzystuje siê je
przede wszystkim w mikroelektronice, ochronie antyko-
rozyjnej, do hydrofobowania powierzchni materia³ów
pochodzenia naturalnego (szk³o, papier, drewno) a tak¿e
jako implanty medyczne o wzmocnionej odpornoœci bio-
logicznej. Sytuuj¹ siê one na pograniczu klasycznych po-
limerów organicznych typu termoplastów lub usiecio-
wanych duroplastów modyfikowanych nieorganiczny-
mi nanonape³niaczami oraz polimerów czysto nieorga-
nicznych stosowanych dotychczas w ceramice [1—4].
Od samego pocz¹tku badañ w tej dziedzinie zwróco-
no uwagê na nowe mo¿liwoœci u¿ycia POSS jako nano-
440
POLIMERY 2010, 55, nr 6
*
)
Autor do korespondencji; e-mail: pkrol@prz.edu.pl

nape³niacza w powszechnie stosowanych w ró¿nych
dziedzinach techniki tworzywach poliuretanowych PUR
o charakterze elastomerowych materia³ów konstrukcyj-
nych, piankowych i pow³okowych o podwy¿szonej od-
pornoœci termicznej [5—7]. Jedn¹ z istotnych korzyœci
by³a przy tym mo¿liwoœæ otrzymywania w ten sposób
nanokompozytów PUR o zmniejszonej palnoœci [8, 9].
W przypadku poliuretanów dodatkowe mo¿liwoœci ich
modyfikacji chemicznej zwi¹zkami krzemoorganiczny-
mi stworzy³o syntetyzowanie ró¿nych funkcjonalizowa-
nych pochodnych POSS, np. z grupami hydroksylowymi
lub aminowymi. Zagadnienia zwi¹zane z uzyskiwaniem
takich pochodnych i ich zastosowaniem jako modyfika-
torów do wytwarzania nanokompozytów z udzia³em la-
nych PUR obszernie opisano w pracy [10]. Stwierdzono,
¿e najczêœciej w celu modyfikowania polimerów otrzy-
muje siê cz¹steczki POSS z 8 atomami krzemu. Wymiary
cz¹steczek POSS nie przekraczaj¹ kilkunastu Å, dlatego
te¿ s¹ one klasyfikowane jako reaktywne nanonape³nia-
cze. Jednak¿e na skutek tendencji do agregacji, oligosil-
seskwioksany obecne w matrycy polimerowej czêsto
tworz¹ krystality o wymiarach kilkunastu—kilkudzie-
siêciu nanometrów.
Do modyfikacji lanych elastomerów poliuretanowych
Autorzy pracy [7] u¿yli specjalnie funkcjonalizowanego,
dostêpnego w handlu 1-[1-(2,3-dihydroksypropo-
ksy)butylo]-3,5,7,9,11,15-heptaizobutylopentacyklo[9.5.
1.1.(3,9).1(5.5).1(7,13)]oktasiloksanu, uzyskuj¹c nano-
kompozyty PUR otrzymane z prepolimerów izocyjania-
nowych wytwarzanych w reakcji 4,4’-diizocyjanianu di-
fenylometanu (MDI) i glikolu poli(oksatetrametylenowe-
go) (PTMG), przed³u¿anych nastêpnie butano-1,4-dio-
lem. Funkcjonalizowany POSS wprowadzano w postaci
roztworu w PTMG bezpoœrednio do MDI, a wiêc ju¿ na
etapie syntezy prepolimeru.
Taka w³aœnie koncepcja uzyskiwania nowych nano-
kompozytów poliuretanowych stanowi³a inspiracjê na-
szej opisywanej tu pracy, w której funkcjonalizowany
POSS zastosowaliœmy do otrzymywania nanokompozy-
tów na podstawie kationomerów poliuretanowych, któ-
rych sposób wytwarzania, szerokie mo¿liwoœci modyfi-
kacji chemicznej i w³aœciwoœci zosta³y przedstawione we
wczeœniejszych naszych pracach [11—15]. W literaturze
patentowej istniej¹ dane dotycz¹ce otrzymywania wod-
nych dyspersji PUR modyfikowanych POSS jako ekolo-
gicznych lakierów, ale dotyczy to anionomerów poliure-
tanowych lub dyspersji wodnych, w których modyfiko-
wany POSS stanowi niezwi¹zany chemicznie sk³adnik
lakieru poliuretanowego [16,17].
Opracowana przez nas wieloetapowa metoda syntezy
kationomerów poliuretanowych maj¹cych postaæ wodo-
rozcieñczalnych dyspersji wodnych, a — po odparowa-
niu wody — tworz¹cych pow³oki o regulowanej hydrofo-
bowoœci polega³a na wytworzeniu najpierw wg z³o¿onej
procedury prepolimeru izocyjanianowego a nastêpnie na
wbudowaniu do jego ³añcuchów okreœlonej iloœci POSS
funkcjonalizowanego grupami hydroksylowymi. Ko-
nieczne okaza³o siê kontrolowanie budowy chemicznej
wytwarzanych nanokompozytów — zarówno od strony
wbudowania POSS, jak i jego wp³ywu na mikrostrukturê
fazy twardej, tworzonej w wyniku wspó³dzia³ania
sztywnych segmentów uretanowo-mocznikowych i frag-
mentów pochodz¹cych z POSS.
Dlatego pierwsza czêœæ prezentowanej pracy doty-
czy charakterystyki chemicznej u¿ytego przez nas
handlowego funkcjonalizowanego POSS, sposobu
prowadzenia syntez modyfikowanych nim kationo-
merów PUR a tak¿e interpretacji wyników badañ ka-
tionomerów metodami spektroskopii IR i NMR oraz
chromatografii ¿elowej, których celem by³o potwier-
dzenie ich oczekiwanej budowy, a zw³aszcza trwa³ego,
opartego na zwi¹zaniu chemicznym wbudowania siê
modyfikatora do ³añcuchów PUR.
W czêœci drugiej zostan¹ natomiast przedstawione
i przeanalizowane wyniki badañ struktury fazowej, mor-
fologii powierzchni, swobodnej energii powierzchnio-
wej, trwa³oœci termicznej oraz wybranych w³aœciwoœci
u¿ytkowych otrzymanych materia³ów jako pow³ok och-
ronnych.
CZÊŒÆ DOŒWIADCZALNA
Materia³y wyjœciowe i ich ewentualne wstêpne
przygotowanie
— 4,4’-Diizocyjanian difenylometanu [MDI, M =
250,25 g/mol, wzór (I)],
odczynnik firmy Aldrich, u¿ywany w postaci dostarczo-
nej przez producenta.
— Oligo(oksypropyleno)diol o nazwie handlowej
Rokopol 7P [M = 450 g/mol, wzór (II)],
produkt Zak³adów Chemicznych ROKITA SA w Brzegu
Dolnym; przed u¿yciem by³ odwadniany w wyniku
ogrzewania w atmosferze azotu w temp. do 120 °C
w ci¹gu 2 h.
— N-metylodietanoloamina [N-MDE, M = 119 g/mol,
wzór (III)]
o gêstoœci 1,04 g/cm
3
, odczynnik firmy Aldrich, u¿ywany
w postaci dostarczonej przez producenta.
— Tetrahydrofuran (THF), produkt firmy POCh SA
Gliwice; w celu usuniêcia wody jego oczyszczanie pro-
wadzono w dwóch etapach: a) ogrzewanie w temperatu-
rze wrzenia (65 °C) z dodatkiem sodu przez 2,5 h; b) des-
tylacja prosta z dodatkiem stabilizatora (2,6-di-tert-buty-
lo-4-metylofenolu, BHP), zapobiegaj¹cego wydzielaniu
siê wybuchowych nadtlenków, prowadzona do 1/3 objê-
POLIMERY 2010, 55, nr 6
441
CH
2
N
C
O
N C O
(I)
HO CH
2
CH O H
CH
3
n
(II)
(HO CH
2
CH
2
)
2
>N CH
3
(III)
toœci kolby destylacyjnej. Odwodniony THF przechowy-
wano nad sitami molekularnymi typu 4Å, wypra¿onymi
w piecu muflowym przez 3 h w temp. 300 °C.
— Kwas mrówkowy (HCOOH, M = 46 g/mol), 99 %,
cz.d.a., firmy POCh SA Gliwice.
— Dilaurynian dibutylocyny o nazwie handlowej
Jeffcal T-12 (C
12
H
25
COO)
2
Sn(C
4
H
9
)
2
, produkt firmy
Huntsman u¿ywany w postaci dostarczonej przez pro-
ducenta.
— Funkcjonalizowany POSS (PHIPOSS), 1-[1-(2,3-di-
hydroksypropoksy)butylo]-3,5,7,9,11,15-heptaizobuty-
lopentacyklo[9.5.1.1.(3,9).1(5.5).1(7,13)]oktasiloksan (ok-
reœlenie skrócone 1,2-propanodioloizobutylosilses-
kwioksan) o wzorze sumarycznym C
34
H
76
O
15
Si
8
(M =
950 g/mol), produkt handlowy firmy Hybrid Plastic
(USA) [18] charakteryzowany wzorem strukturalnym
(IV):
gdzie:
(V)
Jest to bezbarwna, krucha substancja polikrystaliczna
rozpuszczalna w THF i acetonie, o strukturze utworzonej
z trójfunkcyjnych jednostek krzemowych, w których na
jeden atom krzemu przypada pó³tora atomu tlenu
(RSiO)
1,5
[10].
Dostarczony przez producenta PHIPOSS poddaliœmy
bardziej szczegó³owym badaniom metodami IR i NMR
a tak¿e GPC aby potwierdziæ oczekiwan¹ jego budowê
chemiczn¹ i uzyskaæ informacje przydatne do analiz
otrzymywanych nastêpnie nanokompozytów z udzia-
³em tego nape³niacza i kationomeru PUR. Rezultaty tych
badañ i ich interpretacjê przedstawiono w rozdziale
„Wyniki badañ i ich omówienie”.
Otrzymywanie kationomerów PUR
Trójetapowe procesy syntezy kationomerów prowa-
dzono w ogrzewanej kolbie trójszyjnej, wyposa¿onej
w mieszad³o mechaniczne, wkraplacz, termometr, ch³od-
nicê zwrotn¹ oraz doprowadzenie azotu, aby zabezpie-
czyæ reagenty przed kontaktem z wilgoci¹ i tlenem za-
wartym w powietrzu. Przebieg syntez przedstawiono w
tabeli 5 na przyk³adzie kationomeru 3.
Na 1. etapie otrzymywano prepolimer uretanowo-
-izocyjanianowy w reakcji MDI rozpuszczonego w bez-
wodnym THF (B), z Rokopolem 7P (A) i NMDEA (X) (ta-
bela 1):
A + X + 3B
® BABXB
(1)
Przebieg reakcji kontrolowano oznaczaj¹c zawartoœæ
nieprzereagowanych grup -NCO, a otrzymany wynik
porównywano z wartoœci¹ obliczan¹ na podstawie zale¿-
noœci stechiometrycznych.
Na etapie 2. prepolimer z etapu 1. poddawano w
temp. 50 °C dalszej reakcji z amin¹ NMDEA:
BABXB + X
® BABXBX
(2)
wbudowuj¹c w ten sposób do jego ³añcucha dodatkowe
trzeciorzêdowe grupy N-alkilowe, a po zakoñczeniu tej
reakcji ponownie oznaczano zawartoœæ grup -NCO, któ-
ra zgodnie z przyjêtymi iloœciami stechiometrycznymi
mala³a, praktycznie bior¹c, do 0 %.
Na 3. etapie wytwarzano kationy alkiloamoniowe
w wyniku protonowania grup N-alkilowych za pomoc¹
HCOOH:
442
POLIMERY 2010, 55, nr 6
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
O
O
O
R
R
R
R
R
R
R
OH
OH
n
b
b
b
q
b
17
20
20
19
16
19'
(IV)
)
H
(C
H
C
H
C
R
2
m
3
15
P
18
n
2
17
-
-
-
=
T a b e l a 1. Przebieg syntezy kationomerów na przyk³adzie kationomeru nr 3 (wg tabeli 5)
T a b l e 1. Components and procedure of cationomer No. 3 synthesis as model for cationomer synthesis (see Table 5)
Kolejny
nr etapu
procesu
Surowce i ich iloϾ
MDI, g (mole)
THF, g
Rokopol 7P
g (mole)
N
-MDEA
g (mole)
HCOOH
g (mole)
Woda, g
THF, g
PHIPOSS
g (mole)
1
10,269 (0,0410)
26,7
1,98 (0,0044)
3,67 (0,0308)
2
42,62 g prepolimeru (X
NCO obl.
= 0,57 %, wg analizy X
NCO
=
0,51 % NCO)
0,52 (0,0044)
3
1,62 (0,0352)
17,8
1,02 (0,0011)*
)
4
61,96 g prepolimeru ureta-
nowo-izocyjanianowego
(wg analizy X
NCO
» 0 %)
30,6
Produkt
94,18 g ok. 20 % dyspersji kationomeru (zaw. suchej masy wg analizy 21,79 %), lepkoϾ wg Brookfielda 1,280
*
)
Dotyczy produktu modyfikowanego.
...AB O CH
2
CH
2
N CH
2
CH
2
O BA... + HCOOH
CH
3
...AB O CH
2
CH
2
NH
+
CH
2
CH
2
O BA...
CH
3
COO
-
(3)

W tym celu do otrzymanej mieszaniny wprowadzano
HCOOH w iloœci molowej odpowiadaj¹cej ca³kowitej iloœci
moli wbudowanej na 1. i 2. etapie aminy NMDEA. Reakcjê
z HCOOH prowadzono w temp. 50 °C w ci¹gu 2 h, po
czym kontynuowano j¹ w temp. otoczenia przez 24 h.
Na ostatnim 4. etapie, intensywnie mieszaj¹c, doda-
wano podwójnie destylowan¹ wodê. Otrzymana jedno-
rodna dyspersja mia³a charakter kwaœny (pH = 2—3) i za-
wiera³a ok. 20 % suchej masy. Podczas dyspergowania
móg³ te¿, teoretycznie bior¹c, przebiegaæ proces przed³u-
¿ania ³añcucha z udzia³em wi¹zañ mocznikowych
w tych ³añcuchach kationomerów, które zawiera³y reszt-
kowe grupy -NCO (równanie 4).
Dlatego otrzymywane kationomery powinny charak-
teryzowaæ siê budow¹ chemiczn¹ jonomerów poli(ureta-
nowo-mocznikowych).
W przypadku otrzymywania kationomerów modyfi-
kowanych nanonape³niaczem przed dyspergowaniem
w œrodowisku wodnym z dodatkiem HCOOH liniowy
poliuretan, zawieraj¹cy nieznaczn¹ iloœæ nieprzereago-
wanych grup -NCO (czyli na etapie 3.) poddawano reak-
cji z PHIPOSS w iloœciach, odpowiednio, 1, 3, 6 lub 9 %
mas. w stosunku do ca³kowitej masy syntetyzowanego
prepolimeru organicznego (por. tabela 2), tak aby mo¿li-
we by³o ka¿dorazowe ca³kowite przereagowanie grup
-OH zawartych w PHIPOSS z wolnymi grupami -NCO
prepolimeru uretanowo-izocyjanianowego:
BABXBX + POSS
® POSS–BABXBX
(5)
Zawartoœci PHIPOSS w syntetyzowanych przez nas
kationomerach zawiera tabela 2.
T a b e l a 2. ZawartoϾ PHIPOSS w syntetyzowanych kationo-
merach
T a b l e 2. PHIPOSS content in synthesized polyurethane catio-
nomers
Oznaczenie próbki
kationomeru
Udzia³ masowy
PHIPOSS, % mas.
0 (niemodyfikowany)
0
1
1
2
3
3
6
4
9
Nanonape³niacz ten przed wprowadzeniem do pre-
polimeru rozpuszczano ka¿dorazowo w 10 ml bezwod-
nego THF. Reakcjê (5) prowadzono w obecnoœci efektyw-
nego katalizatora poliaddycji, czyli dilaurynianu dibuty-
locyny, w temp. 50 °C przez 2 h, w warunkach intensyw-
nego mieszania, stopniowo rozcieñczaj¹c reaguj¹c¹ mie-
szaninê kolejn¹ porcj¹ 10 ml THF. Dopiero po zakoñcze-
niu dodawania PHIPOSS oznaczano zawartoϾ wolnych
grup -NCO i w przypadku potwierdzenia, ¿e zawartoœæ
ich sta³a siê niemal równa 0 %, rozpoczynano 3. etap —
wkraplanie HCOOH w celu utworzenia kationów amo-
niowych, pochodz¹cych od uprzednio wbudowanej do
prepolimeru aminy NMDA. Prowadzi³o to do uzyskania
kationomeru poli(uretanowo-mocznikowego) modyfi-
kowanego za pomoc¹ PHIPOSS, a formalnie rzecz ujmu-
j¹c, przebieg tego etapu obrazuje równanie (6):
2 POSS + 2 BABXBX + 2 HCOOH
®
® [POSS–BABXHBXH]
+2
(COO)
–
2
(6)
Reakcje zobojêtniania (etap 3.) i koñcowego dysper-
gowania modyfikowanego kationomeru prowadzono
w temp. 50 °C przez 2 h w warunkach mo¿liwe najwiêk-
szej intensywnoœci mieszania. Otrzyman¹ tak mieszani-
nê pozostawiano w temperaturze otoczenia na 24 h, aby
zakoñczyæ reakcjê powstawania jonów amoniowych
i umo¿liwiæ ewentualne przebieganie reakcji (4), a nas-
têpnie okreœlano zawartoœæ suchej masy w badanych
emulsjach, porównuj¹c uzyskiwane wyniki z wartoœci¹
obliczan¹ na podstawie bilansu masowego.
Metodyka badañ kationomerów
Oznaczanie grup izocyjanianowych metod¹
acydymetryczn¹
Kontroluj¹c przebieg procesu, okreœlano zawartoœæ
wolnych grup NCO (X
NCO
) w mieszaninach reakcyjnych
na poszczególnych etapach syntezy, z wykorzystaniem
znanej reakcji grup izocyjanianowych z dibutyloamin¹,
której nadmiar odmiareczkowywano roztworem HCl
wobec b³êkitu bromofenolowego [19].
(7)
gdzie: V
1
— objêtoœæ 0,2 M roztworu HCl zu¿yta na zmiarecz-
kowanie badanej próbki, cm
3
; V
2
— objêtoœæ 0,2 M roztworu
HCl zu¿yta na zmiareczkowanie œlepej próby, cm
3
; m — na-
wa¿ka prepolimeru, g
.
Widma IR
Widma IR w obszarze 4000—650 cm
-1
otrzymanych
kationomerów PUR rejestrowano z zastosowaniem spek-
trofotometru Paragon 1000 FT-IR, wykorzystuj¹c metodê
POLIMERY 2010, 55, nr 6
443
AB O CH
2
CH
2
NH
+
CH
2
CH
2
O B NCO + H
2
O
CH
3
COO
-
- CO
2
AB O CH
2
CH
2
NH
+
CH
2
CH
2
O B NH CO NH B O CH
2
NH
+
CH
2
CH
2
O BA
CH
3
CH
3
COO
-
COO
-
(4)
mas.)
(%
·
84
,
0
1
2
m
V
V
X
NCO
-
=
os³abionego ca³kowitego odbicia (ATR); b³onê polimero-
w¹ umieszczano przy tym miêdzy œciankami pryzma-
tów. Otrzymane widma przedstawiano w postaci zale¿-
noœci transmitancji T (%) w funkcji liczby falowej
n (cm
-1
).
Widma NMR
Widma
1
H NMR i
13
C NMR rejestrowano za pomoc¹
spektrometru FT NMR Broker Avance 500
II
. Badane
próbki rozpuszczano w DMSO-d
6
otrzymuj¹c roztwory o
stê¿eniu ok. 0,2 g/dm
3
. Jako wzorzec zewnêtrzny zasto-
sowano tetrametylosilan (TMS).
Chromatografia ¿elowa (GPC)
Analizê chromatograficzn¹ metod¹ GPC wykonywa-
no przy u¿yciu chromatografu ¿elowego firmy Viscotec
T60A wyposa¿onego w uk³ad trzech typów detektorów:
RI (detektor za³amania œwiat³a), LS (detektor rozprasza-
nia œwiat³a) i DV (detektor lepkoœciowy). Rozdzia³u do-
konywano w temp. 25 ± 0,1 °C w 2 kolumnach typu SDV
o œrednicy porów 100Å — 1000Å firmy Polymer Stan-
dards Service w nastêpuj¹cych warunkach: temperatura
— 25 ± 0,1 °C, objêtoœciowe natê¿enie przep³ywu eluentu
(THF) — 1 cm
3
/min, pêtla zaworu dozuj¹cego —
20 µdm
3
, stê¿enie roztworów badanych próbek — 5—6
mg/cm
3
, czas analizy — 35 min.
Prac¹ chromatografu sterowa³ program komputero-
wy TRISEC Data Acquisition System, umo¿liwiaj¹cy reje-
stracjê sygna³ów detektorów wyra¿onych w mV w funk-
cji czasu retencji. Interpretacjê wyników przeprowadzo-
no na podstawie konwencjonalnej kalibracji kolumn
(wzorce polistyrenowe).
WYNIKI BADAÑ I ICH OMÓWIENIE
Funkcjonalizowany POSS
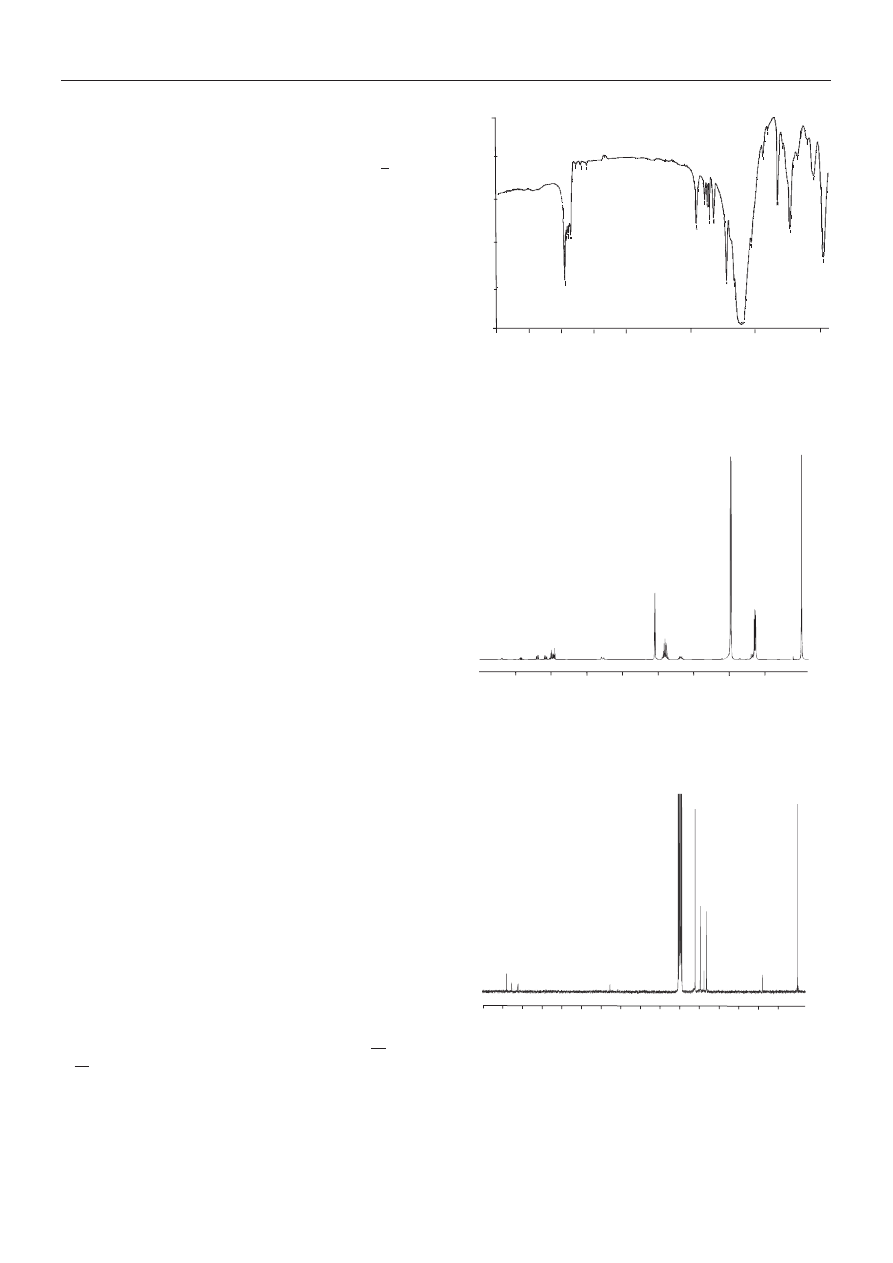
Rysunek 1 przedstawia widmo IR stosowanego przez
nas PHIPOSS, a interpretacjê tego widma zawiera tabela
3, natomiast widma
1
H i
13
C NMR PHIPOSS (rys. 2 i 3)
zinterpretowano w tabelach 4 i 5. Protony oznaczono tam
literami, atomy wêgla zaœ liczbami, tak jak pokazano we
wzorach (IV) i (V). Widmo obejmuje tak¿e sygna³y ato-
mów C pochodz¹cych od grupy C=O acetonu u¿ytego do
rozpuszczenia POSS (
d = 73,886 ppm), natomiast sygna³y
grup CH
3
acetonu wystêpuj¹ w obszarze sygna³ów wêg-
la nr 15 grupy izobutylowej.
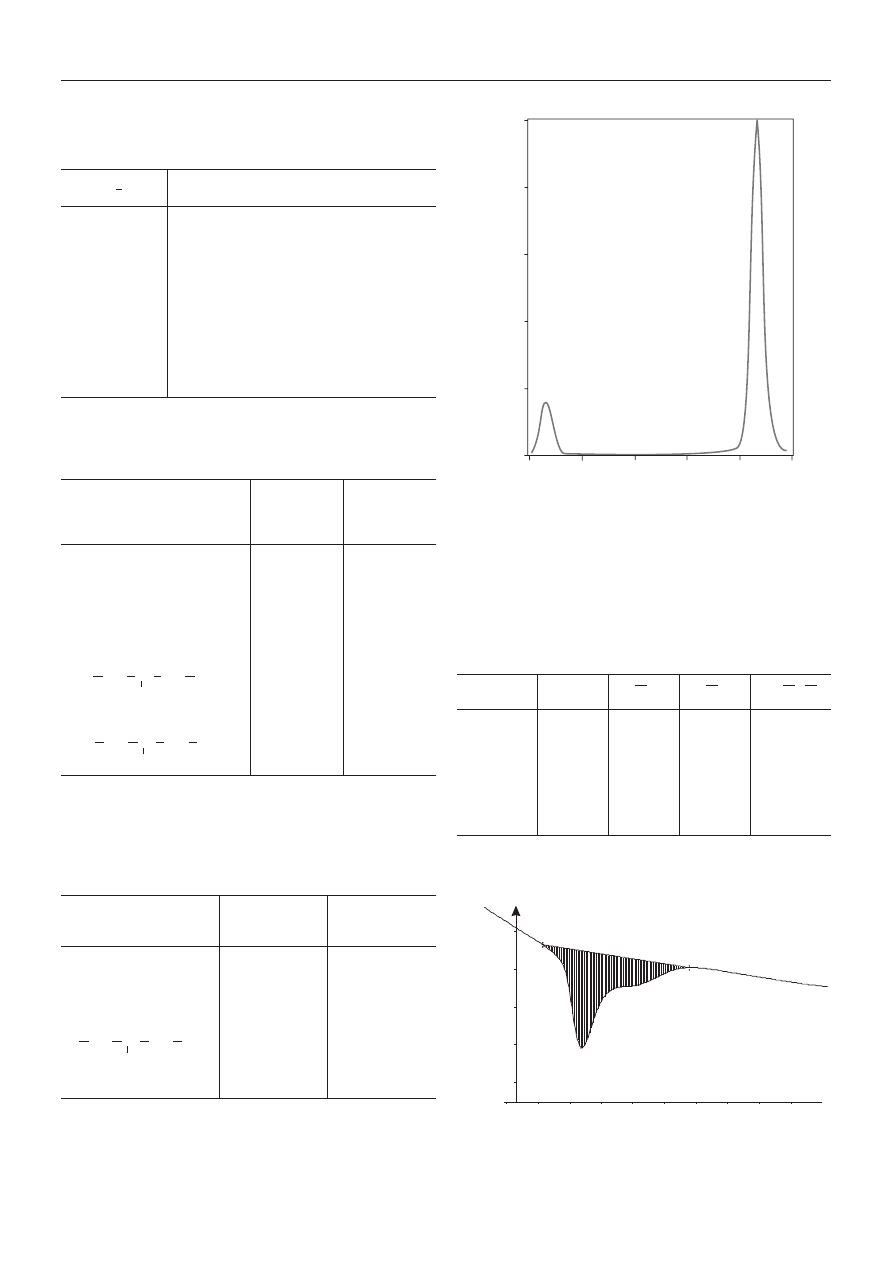
W celu sprawdzenia monodyspersyjnoœci PHIPOSS
wykonano pomiary metod¹ GPC (rys. 4, tabela 6), które
wykaza³y, ¿e wg przyjêtej kalibracji (PS) jego M
n
= 650,
a M
w
= 1200, podczas gdy wartoϾ katalogowa wynosi
M
= 950; PHIPOSS nie jest wiêc zwi¹zkiem œciœle mono-
dyspersyjnym.
Wszystkie przedstawione powy¿ej dane potwierdza-
j¹ jednak, ogólnie bior¹c, budowê chemiczn¹ nanona-
pe³niacza PHIPOSS, odpowiadaj¹c¹ wzorom (IV) i (V).
Z badañ przeprowadzonych metod¹ DSC (rys. 5) wy-
nika, ¿e zwi¹zek ten jest substancj¹ krystaliczn¹ o tempe-
raturze topnienia <6 °C.
444
POLIMERY 2010, 55, nr 6
4000 3500 3000 2500 2000
1500
1000
500
0
100
2955,2
2809,0 2718,2 2638,3
1
107,1
1231,3
1038,1
1
169,8
481,4
565,8
743,0
838,9
613,4
689,5
803,3
921,4
954,1
1333,5
1367,0
1466,6
transmitancja,
%
liczba falowa, cm
-1
2908,2
2871,0
80
60
40
20
Rys. 1. Widmo IR PHIPOSS
Fig. 1. PHIPOSS IR spectrum
0,5
1,0
1,5
2,0
2,5
3,0
3,5
4,0
d, ppm
b
p, q
m
n
Rys. 2. Widmo
1
H NMR PHIPOSS
Fig. 2. PHIPOSS
1
H NMR spectrum
75
65
55
45
35
25
15
5
d, ppm
20
21
16
15,18
17
Rys. 3. Widmo
13
C NMR PHIPOSS
Fig. 3. PHIPOSS
13
C NMR spectrum
T a b e l a 3. Interpretacja widma IR PHIPOSS
T a b l e 3. Interpretation of obtained PHIPOSS IR spectrum
bands
Po³o¿enie
pasma
n, cm
-1
Rodzaj drgañ oraz odpowiadaj¹ce im
ugrupowania
2965—2628
drgania walencyjne C-H grup alkilowych:
-CH
3
, -CH
2
, -CH
1467, 1387
drgania def. symetryczne i antysymetryczne
grup -CH
3
i -CH
2
-
1231
drgania walencyjne C-OH
1107
drgania walencyjne Si-O
1038
drgania walencyjne C-O-C
839
drgania walencyjne C-C grupy izobutylowej
743
drgania walencyjne Si-C
T a b e l a 4. Interpretacja widma
1
H NMR PHIPOSS
T a b l e 4. Interpretation of
1
H NMR spectrum
Rodzaj protonu struktury
[por. wzór (IV)]
Oznaczenie
protonów
wg wzorów
(IV) i (V)
Przesuniêcie
chemiczne
sygna³u
d
ppm*
)
Si-CH
2
-CH-(CH
3
)
2
m
0,640; 0,649;
0,654; 0,663
Si-CH
2
-
n
0,983; 0,986;
0,996; 0,999
Si-CH
2
-CH-(CH
3
)
2
p
1,868—1,949
Si-CH
2
-CH
2
-CH
2
-O-CH
2
-
q
y
2,766; 2,798
Si-CH
2
-CH
2
-CH
2
-O-CH
2
-CH-
b
3,445—3,933
*)
Sygna³
d = 2,1 ppm pochodz¹cy od grup CH
3
acetonu (rozpusz-
czalnika) pominiêto.
T a b e l a 5. Interpretacja widma
13
C NMR PHIPOSS*
)
T a b l e 5. Interpretation of PHIPOSS
13
C NMR spectrum
Rodzaj atomu wêgla
Oznaczenie
atomów C wg
wzorów (IV) i (V)
Przesuniêcie
chemiczne
sygna³u
d, ppm
Si-CH
2
-CH-(CH
3
)
2
15
23,103; 23,160
Si-CH
2
-CH
2
-CH
2
-O-CH
2
-
-CH-Si-CH
2
-CH-(CH
3
)
2
16,18
24,686; 24,714
Si-CH
2
-CH-(CH
3
)
2
17
26,003; 26,012
19’,19
70,887; 70,994
Si-CH
2
-CH
2
-CH
2
-O-CH
2
-
20
72,514
*
)
W widmie wystêpuj¹ tak¿e sygna³y atomów C pochodz¹cych od
grupy C=O acetonu u¿ytego do rozpuszczenia POSS (przy
d =
73,886 ppm), natomiast sygna³y grup CH
3
acetonu wystêpuj¹ w ob-
szarze sygna³ów wêgla nr 15 grupy izobutylowej.
T a b e l a 6. Interpretacja uzyskanych na podstawie chromato-
gramów GPC krzywych RMC PHIPOSS oraz zawieraj¹cych go
kationomerów poliuretanowych
T a b l e 6. Interpretation of RMC curves based on GPC chroma-
tograms for PHIOPOSS and polyurethane cationomers
Nr próbki
wg tabeli 2
M
z
M
w
M
n
P
d
= M
n
/M
w
PHIPOSS
1340
1200
650
1,846
0
27 300
18 400
10 200
1,804
1
32 400
17 000
3610
4,709
2
29 200
19 300
7240
2,666
3
27 800
18 000
9200
1,957
4
18 100
11 000
4450
2,472
POLIMERY 2010, 55, nr 6
445
13,0
10,4
7,8
5,2
2,6
0,0
2,12
2,35
2,58
2,81
3,04
3,27
M
w
:1200
M
n
:650
[log
M ]
W
M
z
: 1340
W/
M
fW
[d
log
]
Rys. 4. Krzywa RMC PHIPOSS
Fig. 4. PHIPOSS RMC curve
-0,45
-0,40
-0,35
-0,30
-0,25
-10
-5
0
5
10
15
20
25
30
35
T, °C
egzo
W·g
-1
Rys. 5. Termogram DSC PHIPOSS
Fig. 5. PHIPOSS DSC thermogram
CH
2
CH CH
2
OH
y
OH
y
CH
2
CH CH
2
OH
OH
CH
2
CH CH
2
OH
OH
Kationomery
Opisane poni¿ej badania metodami IR, NMR i GPC
mia³y na celu potwierdzenie oczekiwanej budowy che-
micznej otrzymanych kationomerów i zjawiska wbudo-
wania funkcjonalizowanego POSS do ³añcucha prepoli-
meru uretanowo-izocyjanianowego jeszcze przed utwo-
rzeniem struktur jonowych.
Widma IR
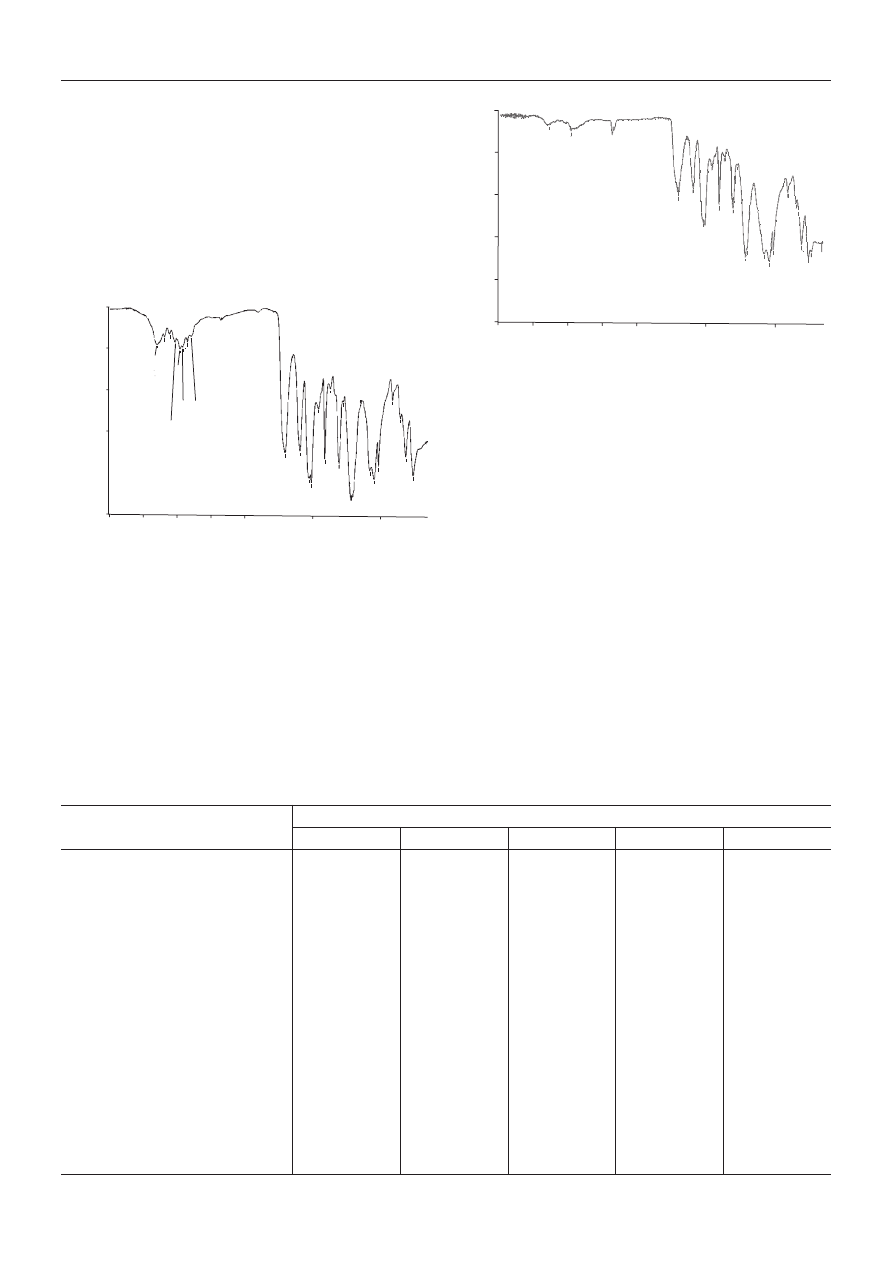
Na rysunku 6 przedstawiono widmo IR niemodyfiko-
wanego kationomeru, na rys. 7 dla przyk³adu widmo IR
kationomeru z dodatkiem 9 % mas. PHIPOSS a w tabeli 7
dokonano szczegó³owych interpretacji i porównania
widm IR wszystkich badanych próbek kationomerów.
Potwierdzaj¹ one obecnoœæ fragmentów typowych dla
kationomerów PUR. We wszystkich widmach w zakresie
1701—1706 cm
-1
pojawia siê mianowicie tzw. I pasmo
amidowe, odpowiadaj¹ce drganiom rozci¹gaj¹cym C=O
grupy karbonylowej uretanów oraz — w zakresie 1523—
1540 cm
-1
tzw. II pasmo amidowe, obecne zawsze w PUR
a pochodz¹ce od drgañ deformacyjnych N-H. Obecnoœæ
ugrupowania jonowego w kationomerach potwierdza
pasmo wystêpuj¹ce w przedziale 1458—1463 cm
-1
cha-
rakterystyczne dla grup -CH
2
-N
+
<. Pasmo w zakresie
743 cm
-1
(tabela 3), charakterystyczne dla wi¹zania C-Si,
które potwierdza wbudowanie siê PHIPOSS w strukturê
446
POLIMERY 2010, 55, nr 6
100
0
80
60
40
20
transmitancja,
%
4000
3000
2000
1500
1000
liczba falowa, cm
-1
763,0
815,1
855,4
915,7
1016,0
1017,1
1073,5
1307,5
1412,0
1510,1
1526,6
1596,2
1705,5
1463,1
1373,0
1277,7
3298,5
3186,7 31
12,0
3031,1
2960,6
2920,6
2851,4
2796,8
3500
2500
Rys. 6. Widmo IR niemodyfikowanego kationomeru PUR
Fig. 6. IR spectrum of unmodified polyurethane cationomer
1000
1500
2000
2500
3000
3500
4000
0
20
40
60
80
100
transmitancja,
%
3280,7
3127,7
2955,0
1701,0
1597,8
1523,0
1462,5
141
1,6
1307,2
1277,9
1324,8
1216,3 1209,7
1082,7
1045,0
1016,0
915,1
854,1
813,4
763,5
743,0
liczba falowa, cm
-1
Rys. 7. Widmo IR kationomeru modyfikowanego dodatkiem
9 % mas. PHIPOSS (próbka 4 wg tabeli 2)
Fig. 7. IR spectrum of polyurethane cationomer modified with
9 wt. % PHIPOSS (sample 4 in Table 2)
T a b e l a 7. Interpretacja widm IR syntetyzowanych kationomerów poliuretanowych
T a b l e 7. Interpretation of IR spectra of polyurethane cationomers
Rodzaj drgania oraz odpowiadaj¹ce im
ugrupowania
Po³o¿enie pasma (
n, cm
-1
) w próbkach okreœlonych numerami wg tabeli 2
0 (por. rys. 6)
1
2
3
4 (por. rys. 7)
N-H + O-H walencyjne
3187—3299
3113—3298
3112—3544
3114—3298
3112—3597
Pasmo drgañ walenc. grup CH
3
i CH
2
2797—2961
2849, 2920, 2967
2867, 2928, 2956,
3030
2871—3031
2870—3032
Pasmo drgañ walenc. C=O
I pasmo amidowe
1653, 1705,5
1646, 1706
1652, 1700, 1706
1705
1654, 1676, 1686,
1697, 1701, 1705,
1718
Walenc. C-H w pierœcieniach
aromatycznych
1596
1598
1597
1598, 1512
1511—1598
II pasmo amidowe
1527
1529
1527
1532, 1530
1540
CH
3
def. antysym. CH
2
def.
1463,1
1463
1463
1463
1465
CH
3
def. sym.
1373
1374
1374
1374
1374
Drgania def. C-O-H
1412
1411
1412, 1308
1412, 1308
1412, 1307
Drgania C-O w eterach
1204, 1215, 1277
1216
1216, 1204
1277, 1218
1278, 1216
Drgania Si-O
brak
1048
1080
1084
1083
Drgania Si-C
brak
brak
brak
763
743
Drgania wahad³owe grup CH
2
i CH
3
763
815
815
815
813

kationomeru, jest widoczne dopiero w widmie kationo-
meru z dodatkiem 9 % mas. funkcjonalizowanego POSS,
a w pozosta³ych widmach jest niewidoczne najprawdo-
podobniej z powodu niewielkiej iloœci tego sk³adnika.
Za³o¿on¹ przez nas budowê otrzymanego modyfikowa-
nego kationomeru ilustruje wzór (VI) i jego fragmenty a),
b) oraz c).
Widma NMR
Widma
1
H i
13
C NMR przedstawione odpowiednio na
rys. 8—11 dodatkowo potwierdzaj¹ budowê chemiczn¹
otrzymanych kationomerów i wbudowanie PHIPOSS do
³añcuchów prepolimerów uretanowo-izocyjanianowych.
W tabelach 8 i 9 przedstawiono szczegó³ow¹ interpreta-
cjê zarejestrowanych widm [20]. W ten sposób wszyst-
kim sygna³om widm NMR syntezowanych kationome-
rów przyporz¹dkowano okreœlone fragmenty budowy
chemicznej przedstawione wzorami (VI).
W toku dalszych badañ sprawdzono obecnoœæ sygna-
³ów pochodz¹cych od PHIPOSS w widmach
1
H NMR ka-
tionomerów modyfikowanych tym nanonape³niaczem.
Ich wyniki przedstawiono w tabeli 10, analogiczne zaœ
dane dotycz¹ce widm
13
C NMR zawiera tabela 11. Z tabel
tych wynika, ¿e nast¹pi³o trwa³e (chemiczne) wbudowa-
nie PHIPOSS do kationomeru, na co wskazuj¹ dodatko-
wo pojawiaj¹ce siê sygna³y protonów typu n i m (tabela 4)
w próbkach modyfikowanych kationomerów. Sygna³ów
tych nie obserwuje siê w samych kationomerach. Poœred-
nim dowodem na wbudowanie siê PHIPOSS jest te¿ bar-
POLIMERY 2010, 55, nr 6
447
R
izobutyl
NH
NH
O
O
CH CH
2
O
CH
3
O
NH
C
O
NH
O
O
N
+
O
CH
3
H
O
O
O C N...
H
O
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
Si
O
O
O
O
R
R
R
R
R
R
R
n
m
(VI)
(VIc)
(VIa)
(VIb)
C
13
O O C
8
H
2
e
C
7
H
2
b
NH
+z
C
7
H
2
b
C
6
H
3
c
O H
y
C
14
OO
-
NH
x
C
21
H
2
d
NH
x
C
13
O
10,l 1 1,k
9
12
10,l 1 1,k
11,k 10,l
12
11,k 10,l
C
13
O O C
8
H
2
e
C
5
H
b
(O
C
1
H
3
a
C
4
H
2
b
C
5
H
b
)
n
O C
5
H
b
C
4
H
2
b
C
1
H
3
a
O C
4
H
2
b
C
2
H
b
O H
y
C
1
H
3
a
C
1
H
3
a
O C
5
H
b
C
3
H
2
b
O H
y
C
1
H
3
a
d, ppm
z
d
b
a
x
e
k
l
c
1
2
3
4
5
6
7
8
9
10
Rys. 8. Widmo
1
H NMR niemodyfikowanego kationomeru
PUR [por. wzory (VI)]
Fig. 8.
1
H NMR spectrum of unmodified polyurethane cationo-
mer
dziej z³o¿ona struktura widma
1
H NMR w zakresie
d =
3,31—3,52 ppm charakterystycznym dla protonów typu
b
grup CH
2
i CH po³¹czonych z atomami tlenu eterowego
lub grupami -OH (por. tabela 10). Wbudowanie PHI-
POSS do kationomeru PUR mo¿e potwierdzaæ tak¿e
obecnoœæ sygna³ów protonów typu p i q wewnêtrznych
apolarnych grup CH
2
i CH rodnika izobutylowego nie
wystêpuj¹cych w kationomerze niemodyfikowanym.
T a b e l a 8. Interpretacja widma
1
H NMR (rys. 8) niemodyfiko-
wanego kationomeru PUR (próbka 0 wg tabeli 6)
T a b l e 8. Interpretation of
1
H NMR spectrum of unmodified
polyurethane cationomer (Fig. 8.) (Sample 0)
Oznaczenie protonu wg wzoru (VI)
Po³o¿enie sygna³u
d, ppm
a
1,014—1,056
THF
1,743—1,769
c
2,293
DMSO
2,50
H
2
O in DMSO
2,669
b
3,526—3,613
d
3,767
e
4,133—4,156
y
—
k
7,064—7,097
l
7,345—7,361
z
8,167
x
9,527
NH mocznikowe
10,093
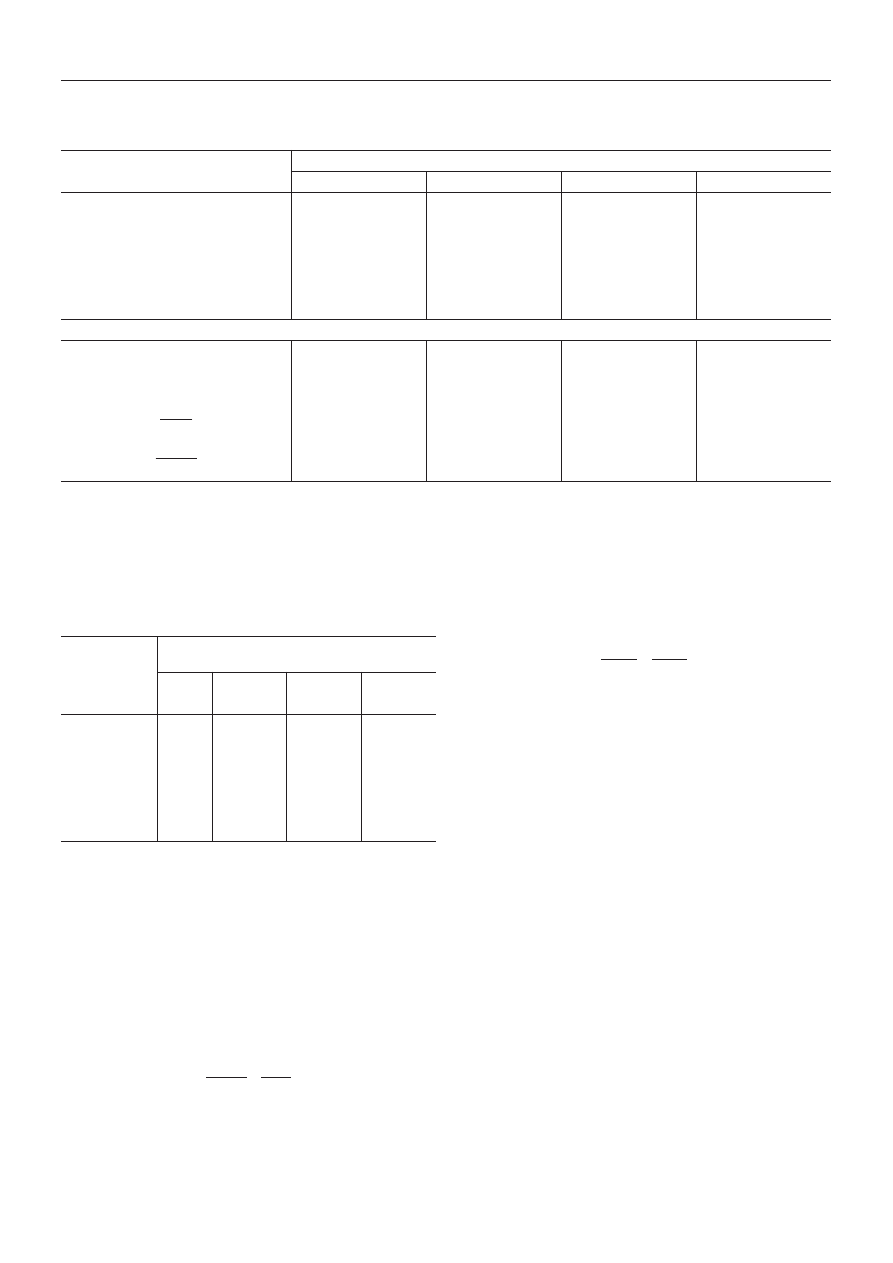
T a b e l a 9. Interpretacja widma
13
C NMR (rys. 9) niemodyfiko-
wanego kationomeru PUR (próbka 0 wg tabeli 6)
T a b l e 9. Interpretation of
13
C NMR spectrum (Fig. 9) of unmo-
dified polyurethane cationomer (Sample 0)
Oznaczenie atomów wêgla
wg wzoru (VI)
Po³o¿enie sygna³u
d, ppm
1
17,152
THF
»25
21
»40
DMSO
40,5
6
42,170
7
55,669
3
61,701
2
66,922
4
74,411
5,8
10
118,197—118,289
11
128,7159—129,375
9
136,684—136,962
12
137,622
13
153,400
14
163,139
448
POLIMERY 2010, 55, nr 6
160
140
120
100
80
60
40
20
d, ppm
17
15
1
16, 18
6
7
3
2
10
14
11
12g
4, 5, 8
19, 20
13
Rys. 11. Widmo
13
C NMR kationomeru PUR modyfikowanego
dodatkiem 9 % mas. PHIPOSS [próbka 4 wg tabeli 2, por. wzo-
ry (VI)]
Fig. 11.
13
C NMR spectrum of polyurethane cationomer modi-
fied with 9 wt. % PHIPOSS (Sample 4 in Table 2, Formula VI)
1
2
3
4
5
6
7
8
9
10
d, ppm
x
z
d
l
k
e
b, b’
q, p
a
m
n
c
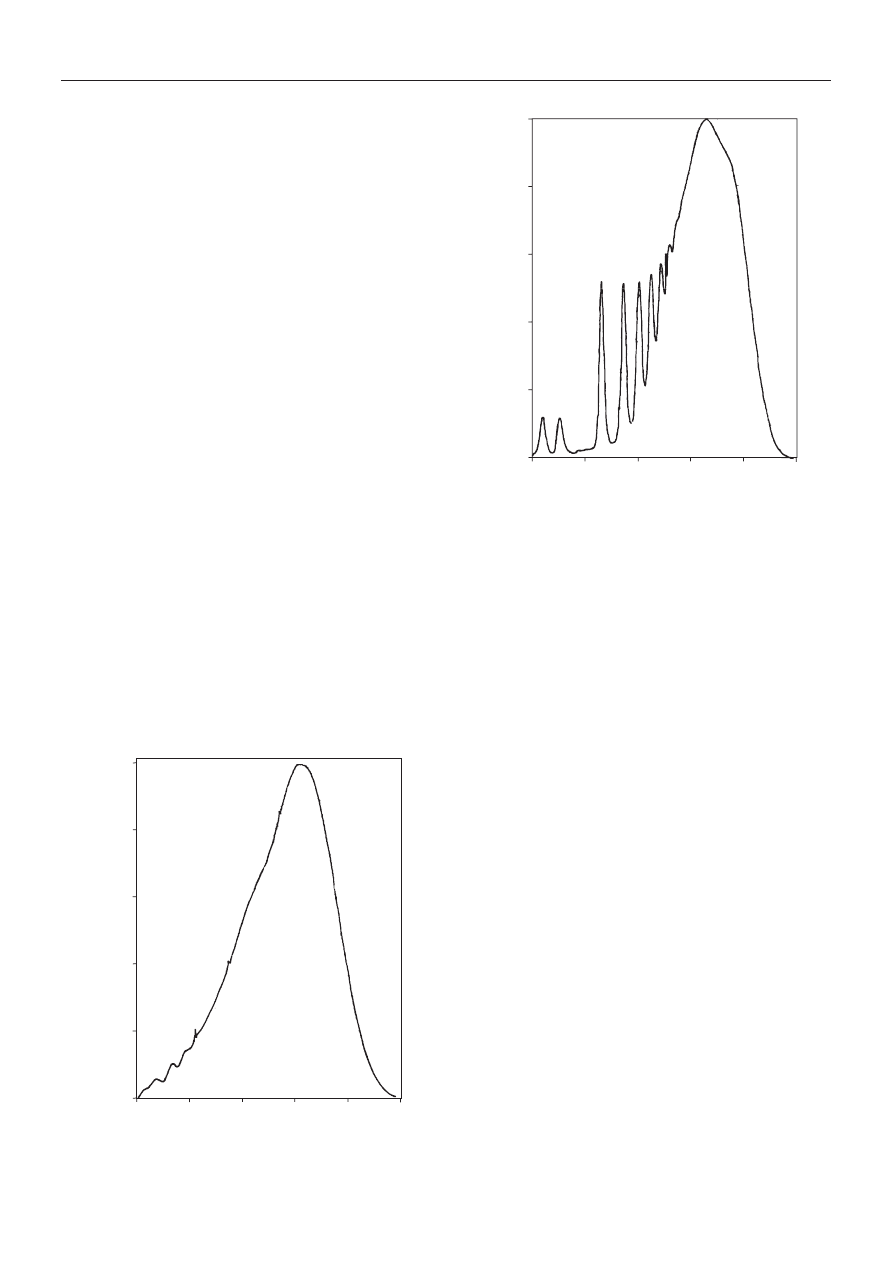
Rys. 10. Widmo
1
H NMR kationomeru PUR modyfikowanego
dodatkiem 9 % mas. PHIPOSS [próbka 4 wg tabeli 2, por. wzo-
ry (VI)]
Fig. 10.
1
H NMR spectrum of polyurethane cationomer modi-
fied with 9 wt. % PHIPOSS (Sample 4 in Table 2, Formula VI)
20
40
60
80
100
120
140
160
14
13
12 9
10
4, 5, 8
2
3
7
6
1
11
d, ppm
Rys. 9. Widmo
13
C NMR niemodyfikowanego kationomeru
PUR [por. wzory (VI)]
Fig. 9.
13
C NMR spectrum of unmodified cationomer (Formula
VI)
T a b e l a 11. Dodatkowe pochodz¹ce od wbudowanego PHI-
POSS sygna³y w widmach
13
C NMR kationomerów poliuretano-
wych
T a b l e 11. Additional
13
C NMR signals in spectra observed for
in-built PHIPOSS in the polyurethane cationomers
Oznaczenie
atomów wêgla
wg tabeli 2
oraz wzorów
(IV) i (V)
Przesuniêcie chemiczne sygna³u (
d, ppm) w
próbkach okreœlonych numerami wg tabeli 2
1
2
3
4 (rys. 11)
15
brak
23,381
23,390
23,390
16, 18
25,026
25,037—
25,236
25,043—
25,188
25,042—
25,241
19
brak
70,815
70,832—
71,013
70,841—
71,012
20
brak
72,051—
72,250
72,265
72,265
Podobny wniosek nasuwa siê z analizy widm
13
C
NMR (por. tabela 11). O wbudowaniu siê PHIPOSS do
³añcuchów kationomeru œwiadcz¹ tu sygna³y wêgli nr 15
(pocz¹wszy od 3-proc. zawartoœci POSS), 16, 18, 19 i 20
[wzór (IV)]. Natomiast nie obserwuje siê sygna³u wêgla
nr 17, charakterystycznego dla grupy Si-CH
2
.
Nastêpnie porównano stosunki molowe MDI do
NMDEA w syntetyzowanych poliuretanach wykorzys-
tuj¹c w tym celu krzywe ca³kowe widm
1
H NMR:
(8)
Uwzglêdniono fakt, ¿e w cz¹steczce NMDA wystêpu-
j¹ 3 protony w grupie CH
3
-N a w cz¹steczce MDI 4 proto-
ny aromatyczne typu „k”. Wyniki tych obliczeñ przedsta-
wiono w tabeli 10. Wynika z nich, ¿e na 1 mol MDI w syn-
tetyzowanych kationomerach przypada od 0,78 do 0,82
moli NMDA.
Z kolei porównano stosunki molowe PHIPOSS do
NMDA wykorzystuj¹c w tym celu krzywe ca³kowe tych
samych widm
1
H NMR:
(9)
Przyjêto, ¿e w cz¹steczce PHIPOSS obecnych jest 8
grup Si-CH
2
(16 protonów) [wzory (IV) i (V)]. Wyniki
tych obliczeñ przedstawiono we wspomnianej ju¿ tabeli
10. Widaæ wyraŸnie, ¿e w kolejnych analizowanych prób-
kach zgodnie z oczekiwaniem wzrasta stosunek molowy
PHIPOSS do NMDA; tak wiêc, na przyk³ad, w próbce 4
o zawartoœci 9 % PHIPOSS 1 mol tego nanonape³niacza
przypada na niemal 10 moli NMDA, podczas gdy w
próbce 1 zawieraj¹cej 1 % PHIPOSS 1 jego mol przypada
na ponad 60 moli NMDA.
Krzywe GPC
Wieloetapowy proces poliaddycji diizocyjanianu
i poliolu prowadzi zazwyczaj do uzyskania polimeru
o znacznej polidyspersyjnoœci — zarówno w odniesieniu
do sk³adu chemicznego, jak i do rozk³adu ciê¿arów cz¹s-
teczkowych. Zjawisko to zaobserwowaliœmy ju¿ we
wczeœniejszych naszych badaniach aczkolwiek zale¿noœ-
ci stechiometryczne reakcji syntezy PUR pozwalaj¹ tak
ukierunkowaæ proces, aby wytworzyæ okreœlony pro-
dukt poœredni (prepolimer uretanowo-izocyjanianowy
lub uretanowo-hydroksylowy) [21, 22]. T³umaczyæ to na-
le¿y stopniowym charakterem etapu wzrostu ³añcucha,
kiedy to, na przyk³ad, obok oczekiwanej reakcji przedsta-
wionej równaniem (1) w warunkach nadmiaru diizocyja-
POLIMERY 2010, 55, nr 6
449
T a b e l a 10. Dodatkowe pochodz¹ce od wbudowanego PHIPOSS sygna³y w widmach
1
H NMR kationomerów poliuretanowych*
)
T a b l e 10. Additional
1
H NMR signals in spectra observed for in-built PHIPOSS in the polyurethane cationomers
Znaczenie protonów
wg wzorów (IV) i (V)
Przesuniêcie chemiczne sygna³u (
d, ppm) w próbkach okreœlonych numerami wg tabeli 6
1
2
3
4 (rys. 10)
m
brak
0,580; 0,593
0,582; 0,595
0,581; 0,595
n
0,903; 0,930
0,907—0,933
0,909—0,935
0,909—0,935
p, q (sygna³y niereprezentatywne,
mog¹ bowiem pochodziæ od resztek
nieodparowanego THF)
1,744—1,770
1,728—1,782
1,741—1,781
1,741—1,782
Dodatkowe sygna³y typu b niewys-
têpuj¹ce w widmie kationomeru
3,313—3,517
3,294—3,413
3,318—3,415
3,318—3,415
Analiza integracji sygna³ów
I
n
0,1084
0,2698
0,5075
0,6818
I
c
1,2688
1,2596
1,2778
1,2036
I
k
2,1497
2,0574
2,0695
2,0690
n
n
NMDA
MDI
0,787
0,816
0,823
0,776
n
n
PHIPOSS
MDI
0,0160
0,0402
0,0745
0,1062
*)
I
n
, I
c
, I
k
— intensywnoœci sygna³ów pochodz¹cych, odpowiednio, od protonów typu n, c oraz k wg wzorów (IV) i (VI).
·
3
·
4
k
c
MDI
NMDA
I
I
n
n
=
·
16
·
3
c
n
MDA
POSS
I
I
n
n
=
nianu proces mo¿e przebiegaæ tak¿e w nastêpuj¹cych
alternatywnych kierunkach:
A + 2 B
® BAB
(10)
2 BAB + X
® BABXBAB
(11)
X + 2 B
® BXB
(12)
Ponadto, izocyjanian w tych warunkach mo¿e two-
rzyæ dodatkowe struktury allofanianowe lub biuretowe.
Powoduje to bardziej z³o¿on¹ budowê ³añcuchów katio-
nomerów powstaj¹cych na kolejnych etapach. Praktycz-
nie bior¹c, nie ma wiêc mo¿liwoœci uzyskania ³añcucha
o regularnej budowie (zreszt¹ nie jest to celowe) i prowa-
dzi do zró¿nicowania sk³adu chemicznego oraz do po-
szerzenia rozk³adu ciê¿arów cz¹steczkowych (wartoœci
RMC
) otrzymywanych liniowych kationomerów PUR.
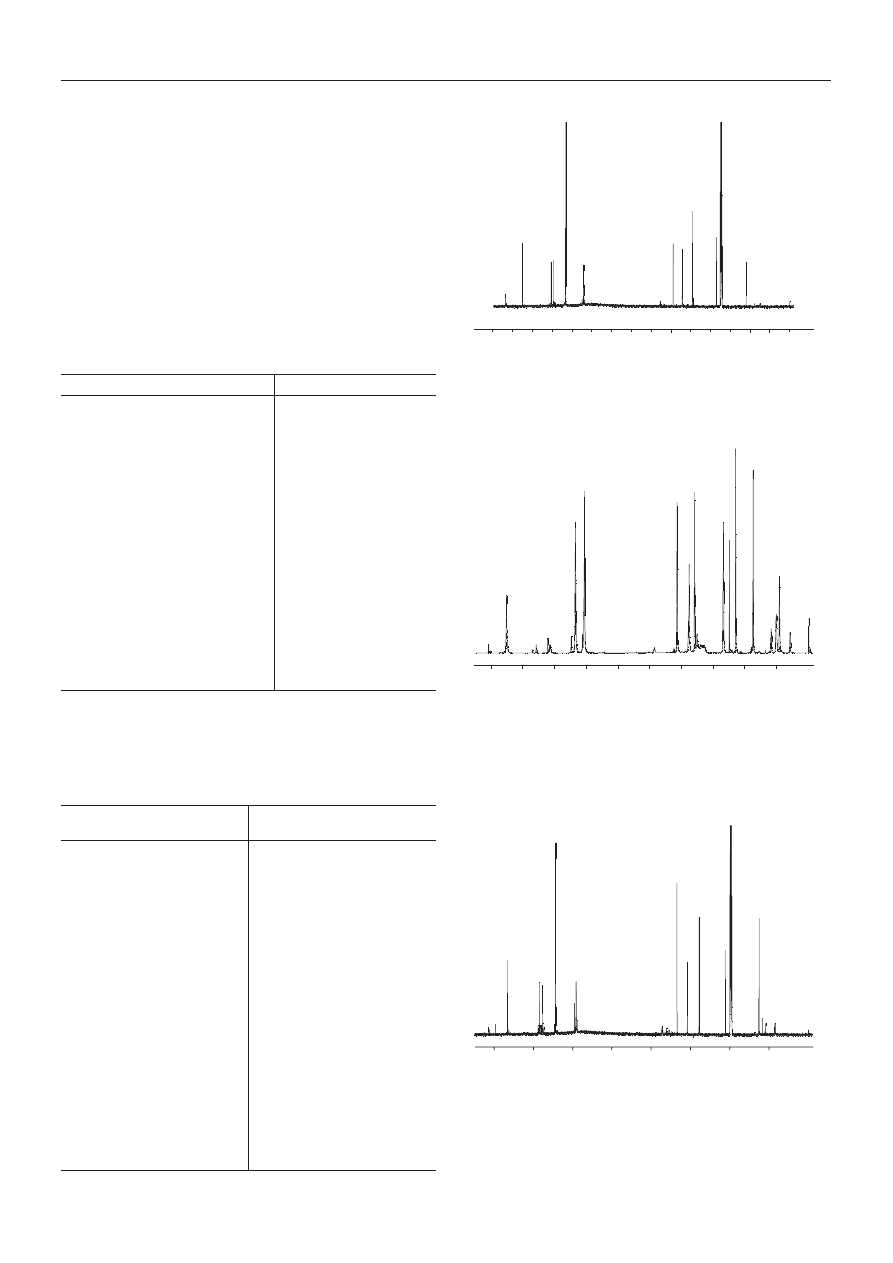
Rysunki 12 i 13 przedstawiaj¹, odpowiednio, krzywe ró¿-
niczkowe RMC kationomeru niemodyfikowanego i ka-
tionomeru zawieraj¹cego 1 % PHIPOSS. Krzywa RMC
niemodyfikowanego kationomeru z rys. 12 œwiadczy o
znacznym stopniu polidyspersyjnoœci (P
d
), czyli o szero-
kim rozk³adzie ciê¿arów cz¹steczkowych otrzymanego
poliuretanu i w pe³ni potwierdza powy¿sze rozumowa-
nie dotycz¹ce przebiegu poliaddycji. Zarejestrowane
krzywe RMC kationomerów modyfikowanych funkcjo-
nalizowanym POSS pozwalaj¹ na stwierdzenie, ¿e wsku-
tek jego wbudowania nastêpuje z regu³y wzrost polidys-
persyjnoœci modyfikowanych kationomerów ju¿ nawet
w przypadku jego niewielkiej (1 %) iloœci (por. rys. 13).
Nie iloœæ modyfikatora odgrywa tu jednak najwa¿niejsz¹
rolê, lecz sposób jego wbudowania do ³añcuchów katio-
nomerów. Analizuj¹c mianowicie polidyspersyjnoœæ mo-
dyfikowanych kationomerów w œwietle zjawiska niemal
monodyspersyjnoœci PHIPOSS (rys. 4, tabela 6) nale¿y
s¹dziæ, ¿e nie wynika ona z fizycznych domieszek mody-
fikatora, ale ze sposobu jego wbudowania siê do ³añcu-
chów kationomerów w postaci odga³êzieñ bocznych
[wzór (VI)]. Powoduje to obserwowany wzrost —
zw³aszcza wartoœci M
z
— modyfikowanych kationome-
rów, natomiast w mniejszym stopniu decyduje o stopniu
ich polidyspersyjnoœci P
d
, poniewa¿ takich rozga³êzieñ
jest niewiele.
PODSUMOWANIE
Wyniki opisanych powy¿ej badañ uzasadniaj¹ stwier-
dzenie, ¿e u¿ycie N-metylodietanoloaminy jako dodat-
kowego substratu hydroksylowego do otrzymywania
prepolimeru uretanowo-izocyjanianowego wytworzone-
go w reakcji MDI i oligo(oksypropyleno)glikolu oraz wy-
korzystanie na kolejnym etapie tej aminy jako przed³u¿a-
cza ³añcuchów tak wytworzonych prepolimerów, stwa-
rza mo¿liwoœæ wbudowania trwa³ych ugrupowañ katio-
nowych do ³añcucha poliuretanu. Warunkiem jest wy-
tworzenie czwartorzêdowych grup amoniowych, np.
w reakcji segmentów aminowych prepolimeru z kwasem
organicznym. Ugrupowania takie umo¿liwiaj¹ z kolei
wytworzenie trwa³ych dyspersji wodnych bez stosowa-
nia dodatkowych œrodków powierzchniowo-czynnych.
Nie zaistnia³a te¿ koniecznoœæ stosowania dodatkowych
przed³u¿aczy ³añcuchów otrzymanych prepolimerów
zawieraj¹cych resztkowe koñcowe grupy izocyjaniano-
we, poniewa¿ grupy te w warunkach dyspergowania
450
POLIMERY 2010, 55, nr 6
1,26
1,01
0,76
0,50
0,25
0,00
3,06
3,45
3,85
4,24
4,63
5,02
[log
]
M
w
WM
fw
/[dlog
]
M
w
: 18 400
M
z
: 27 300
M
n
: 10 200
Rys. 12. Krzywa RMC niemodyfikowanego kationomeru
Fig. 12. MWD curve of unmodified polyurethane cationomer
8,62
6,90
5,17
3,45
1,72
0,00
2,09
2,72
3,36
3,99
4,62
5,25
[log
]
M
w
WM
fw
/[dlog
]
M
w
: 17 000
M
z
: 32 400
M
n
: 3 610
Rys. 13. Krzywa RMC kationomeru modyfikowanego 1 % iloœ-
ci¹ PHIPOSS (próbka 1 wg tabeli 2)
Fig. 13. RMC curve of polyurethane cationomer modified with
1 % PHIPOSS

reaguj¹ z wod¹, tworz¹c liniowe struktury przed³u¿ane
poprzez wi¹zania mocznikowe.
Steruj¹c zale¿noœciami stechiometrycznymi reakcji
mo¿na czêœæ wspomnianych wolnych grup izocyjaniano-
wych — jeszcze przed etapem dyspergowania kationo-
meru w wodzie — wykorzystaæ do szczepienia poprzez
wi¹zania uretanowe, np. w wyniku wprowadzenia za-
wieraj¹cego grupy OH 1-[1-(2,3-dihydroksypropo-
ksy)butylo]-3,5,7,9,11,15-heptaizobutylopentacyklo[9.5.
1.1.(3,9).1(5,5).1(7,13)]oktasiloksanu (PHIPOSS). Prze-
strzenna struktura PHIPOSS pozwala na wytworzenie
w ten sposób nowych nanokompozytów poliuretano-
wych.
Kluczow¹ kwesti¹ w przedstawionej pracy by³o zwe-
ryfikowanie oczekiwanej budowy chemicznej syntetyzo-
wanych kationomerów oraz potwierdzenie pe³nego
wbudowania PHIPOSS do ³añcuchów poliuretanowych,
czego dokonano metodami spektroskopowymi IR,
1
H NMR i
13
C NMR oraz metod¹ chromatografii ¿elowej.
Praca naukowa finansowana ze œrodków na naukê w latach
2009—2011 jako projekt badawczy nr N N507 329636.
LITERATURA
1. Bruce X. Fu, Hsiao B. S., White H., Rafailovich M., Mather
P. T., Jeon H. G., Philips S., Lichtenhan J., Schwab J.: Polym.
Internat.
2000, 49, 437.
2. Liu Y. R., Huang Y. D., Liu L.: Composites Sci. Technol. 2007,
67, 2864.
3. Liu L., Tian M., Zhang W., Zhang L., Mark J. E.: Polymer
2007, 48, 3201.
4. Zhang Z., Gu A., Liang G., Ren P., Xie J., Wang X.: Polym.
Degrad. Stability
2007, 92, 1986.
5. Fu B. X., Hsiao B. S., Pagola S., Stephens P., White H., Rafai-
lovich M., Sokolov J., Mather P. T.: Polymer 2001, 42, 599.
6. Bliznyuk V. N., Tereshchenko T. A., Gumenna M. A., Gomza
Yu P., Shevchuk A. V., Klimenko N. S.: Polymer 2008, 49,
2298.
7. Janowski B., Pielichowski K.: Czasopismo Techniczne, Wyd.
Politechniki Krakowskiej 2006, z. 6-M, 235.
8. Devaux E., Rochery M., Bourbigot S.: Fire Mat. 2002, 26, 149.
9. Janowski B., Pielichowski K.: Thermochim. Acta 2008, 478, 51.
10. Janowski B., Pielichowski K.: Polimery 2008, 53, 87.
11. Król P., Król B.: Polimery 2004, 49, 615.
12. Król P., Król B.: Polimery 2007, 52, 427.
13. Król P., Król B.: Colloid Polym. Sci. 2008, 286, 1111.
14. Król P., Król B.: Colloid Polym. Sci. 2008, 286, 1243.
15. Król P., Król B.: Colloid Polym. Sci. 2009, 287, 189.
16. Zg³osz. pat. USA nr US2008108773 (A1) (2008).
17. Pat. chiñski nr CN101250375 (A) (2008).
18. www.hybridplastics.com
19. Stagg H. E: The Analyst 1966, 71, 557.
20. Pham Quang Tho: „Proton and Carbon NMR Spectra of
Polymers”, John Wiley & Sons, Inc., Chichester, 2003.
21. Król P., Pilch-Pitera B.: Polymer 2003, 44, 5075.
22. Król P., Król B., Holler P., Telitsyna N.: Colloid Polym. Sci.
2006, 284, 1107.
Otrzymano 7 IX 2009 r.
POLIMERY 2010, 55, nr 6
451
Wyszukiwarka
Podobne podstrony:
Materiały powłokowe
Sprawko Materiały kompozytowe Otrzymywanie
Materiały metalowe, otrzymywanie, właściwości i zastosowanie (Monika Kanik)
Materiały, Tworzywa sztuczne, Tworzywa sztuczne, zwane także plastomerami, są tworzywami na podstawi
druk Materiały niemetalowe i pow łoki ochronne(polimery), Studia, SiMR, II ROK, III semestr, Powłoki
POWŁOKI NIKLOWE, Chemia materiałów
Otrzymywanie wapna palonego, materiały naukowe do szkół i na studia, technologia chemiczna sprawozda
Otrzymywanie ZnO z materiałów zachlorowanych(1)
11 12 Otrzymywanie materialow
otrzymanie żywicy fenolowo-formaldehydowej, materiały naukowe do szkół i na studia, technologia chem
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
Analiza ilościowa (miareczkowa) Oznaczanie podstawowych kationów występujących w materiałach budowla
Analiza jakościowa kationów, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Laborki
Zasada rozbudowy powłok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
15. Otrzymywanie polistyrenu metoda perelkowa, materiały naukowe do szkół i na studia, technologia c
materialoznawstwo architektura krajobrazu, Drewno, Drewno - to surowiec otrzymywany ze ściętych drze
więcej podobnych podstron