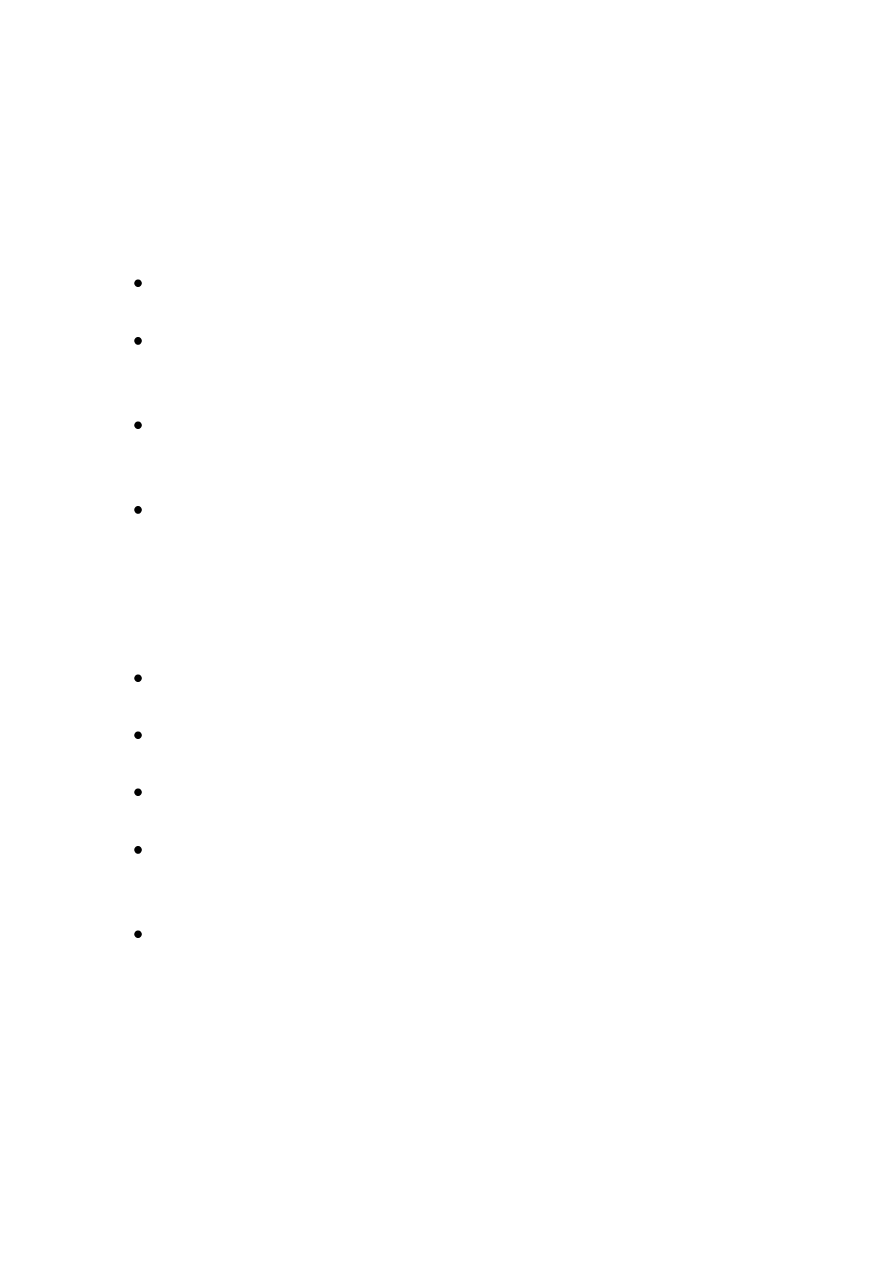
BIOCHEMIA
Wykład 5
WĘGLOWODANY
Węglowodany są związkami o charakterze aldehydoalkoholi lub keto
alkoholi wielowodorotlenowych.
Monosacharydy, czyli cukry proste zawierają od trzech do siedmiu
atomów węgla. Wyróżniamy triozy, tetrozy, pentozy, heksozy i
heptozy.
Cukry, których najwyżej utlenioną grupą funkcyjną jest grupa
aldehydowa, noszą nazwę aldoz, natomiast te, których najwyżej utlenioną
grupą funkcyjną jest grupa ketonowa, noszą nazwę ketoz.
Obecność grup aldehydowych lub ketonowych oraz grup hydroksylowych
sprawia, iż cukry wykazują reakcje charakterystyczne dla aldehydów lub
ketonów i alkoholi.
FUNKCJE BIOLOGICZNE CUKRÓW PROSTYCH
Cukry proste, a szczególnie heksozy, są głównymi substratami
zużywanymi do produkcji energii.
Pośrednie produkty przemiany cukrów stają się substratami zużywanymi
do różnych syntez, np. tłuszczów i niektórych aminokwasów.
Ryboza i deoksyryboza są składnikami nukleozydów, nukleotydów i
kwasów nukleinowych.
Pochodne cukrów prostych: amino heksozy i kwasy uronowe tworzą
wielkocząsteczkowe połączenia zwane glikozoaminoglikanami –
składniki macierzy pozakomórkowej.
Zarówno monosacharydy, jak i ich pochodne wiążą się z białkami lub z
lipidami tworząc połączenia zwane (odpowiednio) glikoproteinami lub
glikolipidami.

CZĄSTECZKA GLUKOZY
METABOLIZM GLUKOZY
Glukoza jest głównym, a dla niektórych komórek jedynym (erytrocyty)
lub prawie jedynym (komórki mózgu) substratem energetycznym.
Przemiana glukozy do CO
2
i H
2
O jest procesem wieloetapowym.
Pierwszym z nich jest glikoliza, a jej produktem jest pirogronian. Ten, w
kolejnym etapie, ulega oksydacyjnej dekarboksylacji do acetylo~S-
KoA. Reszty acetylowi spalają się do CO
2
i H
2
O w cyklu Krebsa.
Każdy z tych etapów generuje energię magazynowaną w postaci ATP.
GLIKOLIZA
Jest cytoplazmatycznym szlakiem metabolicznym, przekształcającym
glukozę (i inne heksozy) do pirogronianu, w celu dostarczenia komórce
energii oraz substratów do innych szlaków metabolicznych.
Jest centralnym punktem przemiany cukrów, ponieważ prawie wszystkie
z nich (np. fruktoza, galaktoza) przekształcają się poprzez glukozę.
GLIKOLIZA TLENOWA
Pirogronian jest produktem końcowym glikolizy w komórkach
posiadających mitochondria i zaopatrywanych w tlen. Proces ten nosi
nazwę glikolizy tlenowej, ponieważ może zachodzić tylko w warunkach
tlenowych. W przebiegu glikolizy zużywa się NAD
+
(cytosolowy), a

tlen jest potrzebny do jego reoksydacji (odtworzenia), ponieważ
NAD
+
jest niezbędny do dalszego funkcjonowania glikolizy.
Przemiana glukozy do pirogronianu przebiega poprzez 10 kolejno po
sobie następujących reakcji. Pierwszy etap glikolizy, obejmujący 5
reakcji, zachodzi kosztem energii zainwestowanej w ten proces (2
cząsteczki ATP). Drugi etap generuje energię.
Duży wkład w poznanie glikolizy wniósł prof. Jakub Parnas.
GLIKOLIZA 1:
Heksokinaza cechuje się wysokim powinowactwem do glukozy. Pozwala to na
efektywną fosforylację i wydajne przekształcanie glukozy nawet wtedy, gdy jej
stężenie w komórce jest niewielkie. Odwrotnie działa glukokinaza w wątrobie –
ma to znaczenie regulacyjne.
GLIKOLIZA 2
GLIKOLIZA 4
GLIKOLIZA 6
GLIKOLIZA 7
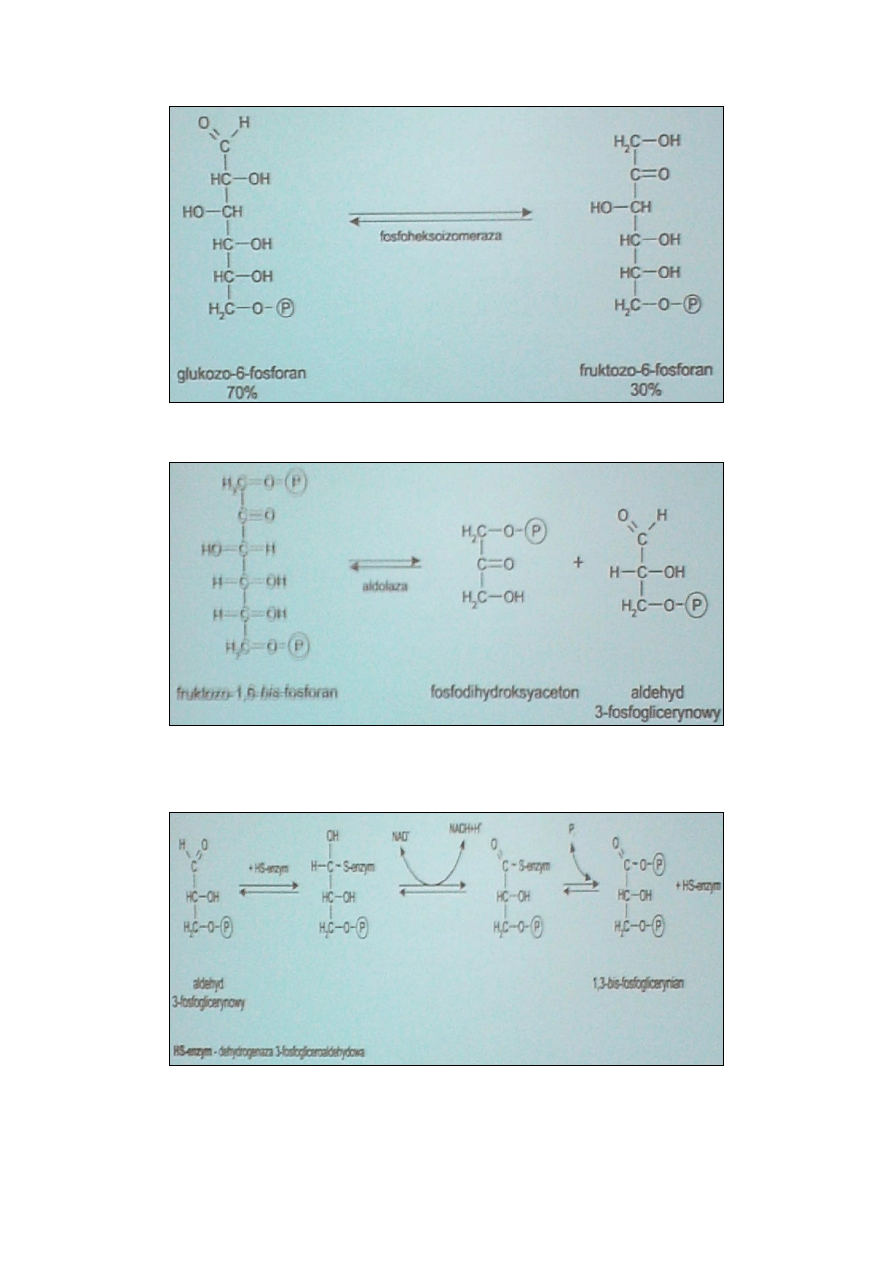
GLIKOLIZA 9
GLIKOLIZA 10
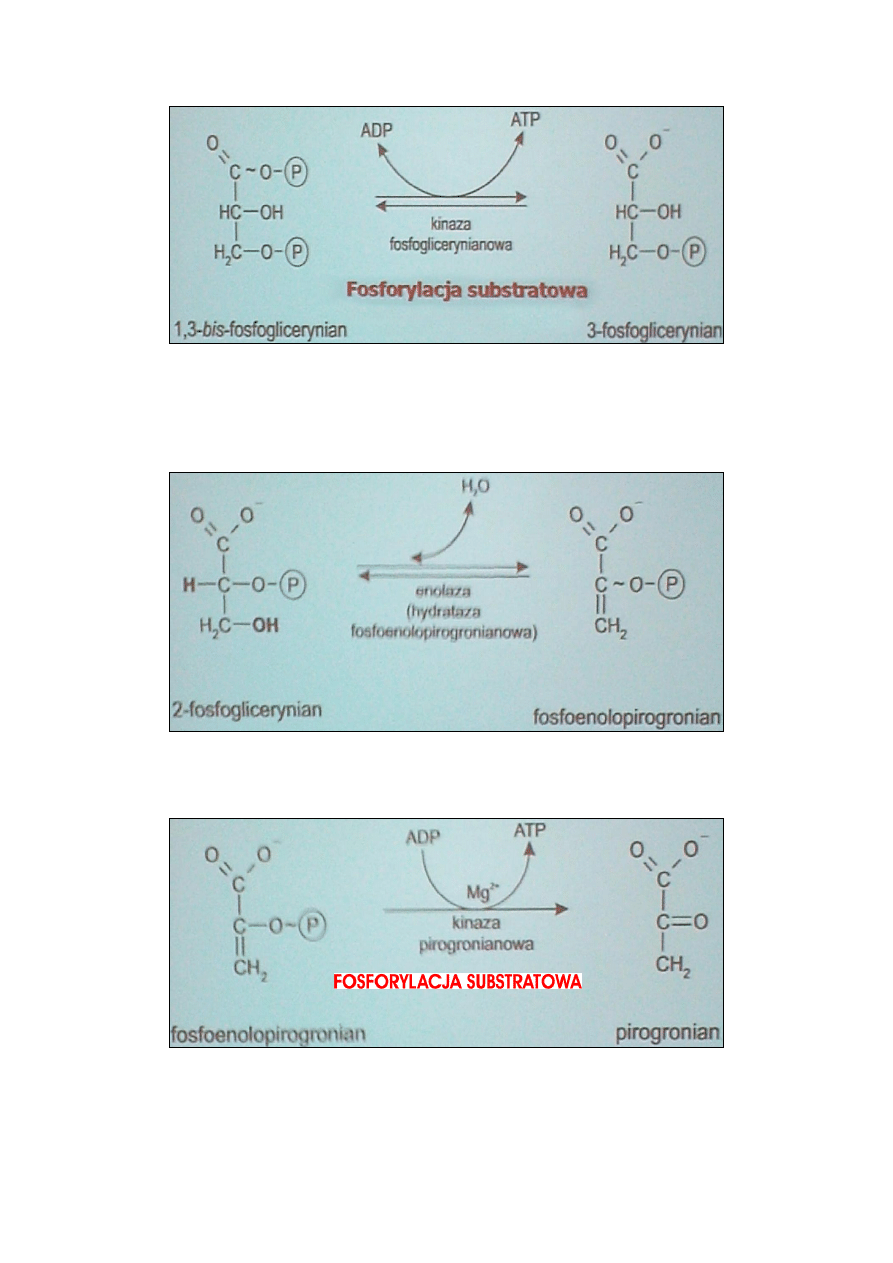
BILANS ENERGETYCZNY GLIKOLIZY TLENOWEJ:
Przemiana 1 cząsteczki glukozy do 2 cząsteczek pirogronianu dostarcza
(netto) dwu cząsteczek ATP (w sumie 4 ATP, ale 2 ATP są zużywane) na
drodze
fosforylacji
substratowej.
Uwzględniając
utlenienie
powstających w tym procesie 2 cząsteczek NADH+H
+
bilans wzbogaca
się dodatkowo o 6 (2 x 3) cząsteczek ATP, powstających na drodze
fosforylacji oksydacyjnej.
Jedna cząsteczka glukozy, utleniająca się do dwóch cząsteczek
pirogronianu, dostarcza 8 cząsteczek ATP.
Pirogronian zachowuje większość energii zawartej w glukozie, która
uwalnia się w kolejnych etapach rozpadu pirogronianu.
REGULACJA GLIKOLIZY:
Istotną rolę regulacyjną odgrywają efektory allosteryczne, regulują
aktywność trzech enzymów glikolizy.
1. Heksokinazy/ glukokinazy
Heksokinaza jest enzymem mało swoistym, hamowanym przez glukozo-
6-fosforan – produkt reakcji. Cechuje się wysokim powinowactwem do
glukozy. Pozwala to na wydajne przekształcenie glukozy nawet wtedy,
gdy jej stężenie w komórce jest niewielkie.
Glukokinaza nie jest swoista wobec glukozy. Wykazuje niższe
powinowactwo do glukozy. Funkcjonuje gdy stężenie glukozy w
komórkach wątrobowych jest dostatecznie wysokie. Taka sytuacja
metaboliczna występuje po posiłku bogatym w węglowodany – enzym
zapobiega przechodzeniu nadmiaru glukozy do krążenia ogólnego.
2. Fosfofruktokinaza jest hamowana przez wysoki poziom ATP oraz przez
cytrynian (dostatek energii). Wysoki poziom AMP (brak energii) wywiera
efekt allosteryczny dodatni. Najsilniejszy jednak efekt dodatni wywiera
fruktozo-2,6-bis-fosforan – powstaje on z fruktozo-6-fosforanu, przy
udziale fosfofruktokinazy 2.
3. Kinaza pirogronianowa jest aktywowana przez fruktozo-1,6-bis-fosforan.
Wzrost aktywności fosfofruktokinazy skutkuje wzrostem produkcji
fruktozo-1,6-bis-fosforan, co aktywuje kinazę.
Proces glikolizy jest również precyzyjnie regulowany przy udziale insuliny (+) i
glukagonu (-). Insulina indukuje syntezę: glukokinazy, fosfofruktokinazy i
kinazy pirogronianowej. Glukagon hamuje glikolizę pobudzając fosforylację
kinazy pirogronianowej (insulina działa odwrotnie).
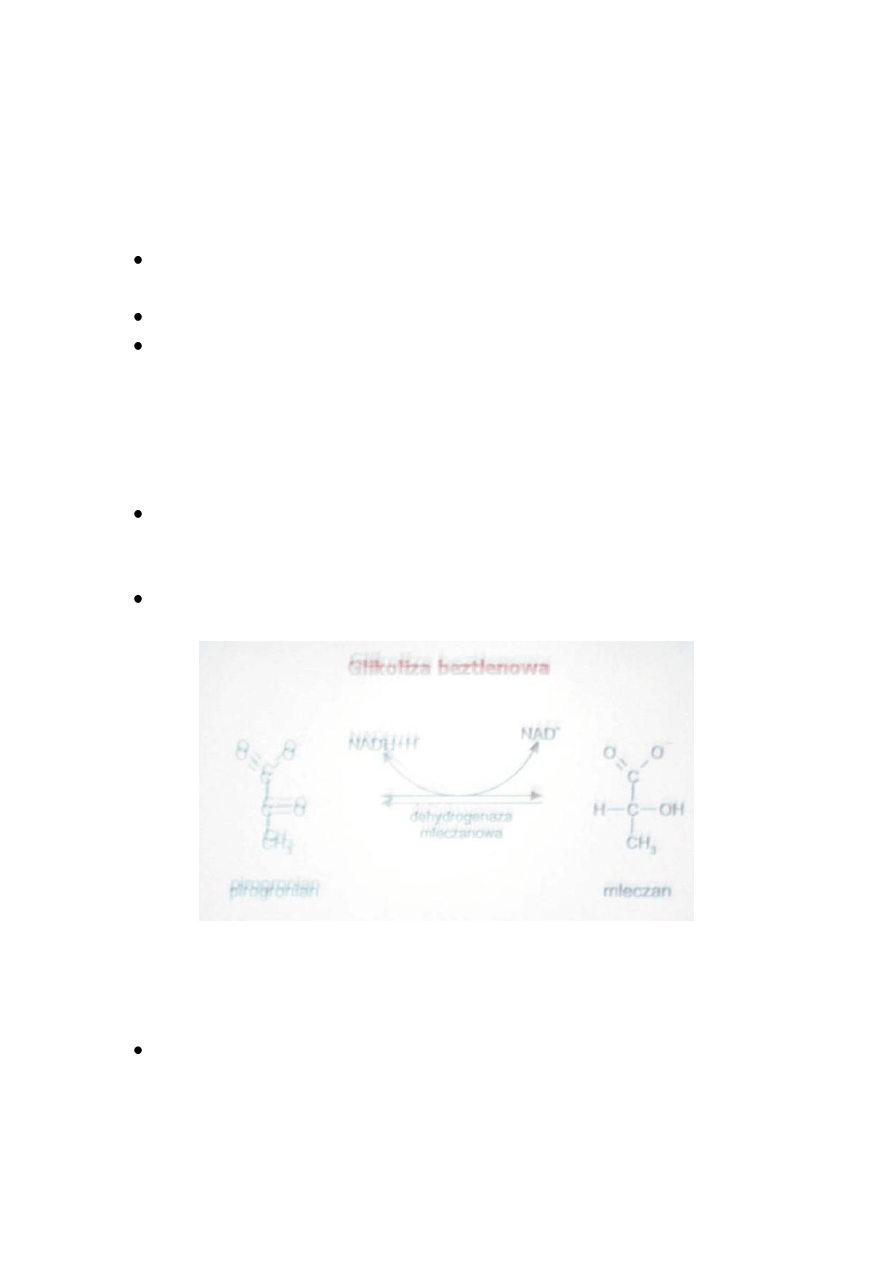
GLIKOLIZA BEZTLENOWA
Dotyczy komórek nie posiadających mitochondriów oraz komórek
niedostatecznie zaopatrywanych w tlen.
Przekształcenie glukozy w mleczan nosi nazwę glikolizy beztlenowej.
Reakcję redukcji pirogronianu przez NADH+H
+
do mleczanu katalizuje
dehydrogenaza mleczanowa. Proces ten zachodzi przede wszystkim w
krwinkach czerwonych i w mięśniach szkieletowych w okresie wysiłku.
Wprawdzie mięśnie szkieletowe posiadają mitochondria, to jednak ilość
NADH+H
+
w pracującym mięśniu przewyższa możliwości jego utleniania
przez łańcuch oddechowy.
Reakcja katalizowana przez dehydrogenazę mleczanową jest odwracalna.
Kierunek jej przebiegu zależy od wartości stosunku pirogronian/mleczan i
NADH+H
+
/NAD
+
.
Mleczan z mięśni przenika do krwi, w wątrobie utlenia się do
pirogronianu.
KWASICA MLECZANOWA
Podwyższone stężenie mleczanu w osoczu, zwane kwasicą mleczanową,
zachodzi przy niewydolności układu krążenia lub układu oddechowego.
Tkanki nie są wówczas w wystarczającym stopniu zaopatrywane w tlen.

Niedobór tlenu sprawia, iż funkcjonowanie łańcucha oddechowego jest
upośledzone. Jedynym źródłem ATP staje się glikoliza beztlenowa i
związana z jej przebiegiem fosforylacja substratowa. Jakkolwiek
proces ten dostarcza niewielkiej ilości ATP, to może ocalić życie komórki
przez okres potrzebny do poprawy warunków utlenowania krwi, bądź
zwiększenia jej dopływu do niedotlenionej tkanki.
Pomiar stężenia mleczanu w osoczu krwi jest stosowany jako miernik
niedotlenienia tkanek.
BILANS ENERGETYCZNY GLIKOLIZY BEZTLENOWEJ
Glikoliza beztlenowa jest mniej wydajna pod względem energetycznym
niż glikoliza tlenowa.
Glukoza + 2 Pi + 2 ADP 2 mleczan + 2 ATP + 2 H
2
O
Przemiana jednej cząsteczki glukozy do 2 cząsteczek mleczanu dostarcza
jedynie 2 cząsteczek ATP. Obydwie powstają drogą fosforylacji
substratowej.
WRODZONE DEFEKTY GLIKOLIZY
Najczęściej spotykanym, wrodzonym defektem glikolizy jest niedobór
kinazy pirogronianowej.
Skutki niedoboru enzymów glikolizy są najbardziej dotkliwe dla krwinek
czerwonych.
Rozwija się zespół objawów zwany niedokrwistością (anemią)
hemolityczną.
MEATBOLICZNE LOSY PIROGRONIANU
Produkt
glikolizy
–
pirogronian
ulega
wielokierunkowym
przekształceniom.
Większość ulega oksydacyjnej dekarboksylacji z wytworzeniem
acetylo~S-KoA, które są substratem energetycznym włączanym do cyklu
Krebsa lub mogą być użyte do syntezy kwasów tłuszczowych,
cholesterolu (a pośrednio innych steroidów).
W wątrobie dominującym szlakiem wykorzystania pirogronianu jest jego
karboksylacja, prowadząca do powstania szczawiooctanu i jego
włączenie do procesu glukoneogenezy (syntezy glukozy ze składników
niecukrowych).
Część pirogronianustaje się akceptorem grup –NH
2
przechodząc w
alaninę.
Drożdże i niektóre bakterie przekształcają pirogronian w alkohol etylowy.
Proces ten nosi nazwę fermentacji alkoholowej.
OKSYDACYJNA DEKARBOKSYLACJA PIROGRONIANU
Jest
katalizowana
przez
kompleks
wieloenzymatyczny,
zwany
dehydrogenazą
pirogronianową,
zlokalizowany
w
macierzy
mitochondrialnej. Enzym ten jest kompleksem:
dekarboksylazy
pirogronianowej, transacetylazy dihydroliponianowej i dehydrogenazy
dihydroliponianowej.
Dehydrogenaza pirogronianowa współdziała z 5 koenzymami, które
pełnią funkcję przenośników lub utleniaczy. Są to: pirofosforan tiaminy
(TPP), NAD
+
, FAD, KoA-SH oraz lipinian.
Utlenianie powstałego NADH przez łańcuch oddechowy dostarcza 3
cząsteczek ATP, w przeliczeniu na jedną cząsteczkę pirogronianu.
Sumaryczny
zysk
energetyczny
oksydacyjnej
dekarboksylacji
pirogronianu, pochodzącego z jednej cząsteczki glukozy wynosi 6
cząsteczek ATP.
CYKL KWASÓW TRIKARBOKSYLOWYCH
Cykl kwasów tri karboksylowych, zwany cyklem Krebsa lub cyklem
kwasu cytrynowego, odgrywa kluczową rolę w metabolizmie. Jego
zasadnicza funkcja polega na utlenianiu acetylo~S-KoA do CO
2
i
H
2
O. Acetylo~S-KoA pochodzi z metabolizmu cukrów, kwasów
tłuszczowych i szkieletów węglowodorowych aminokwasów.
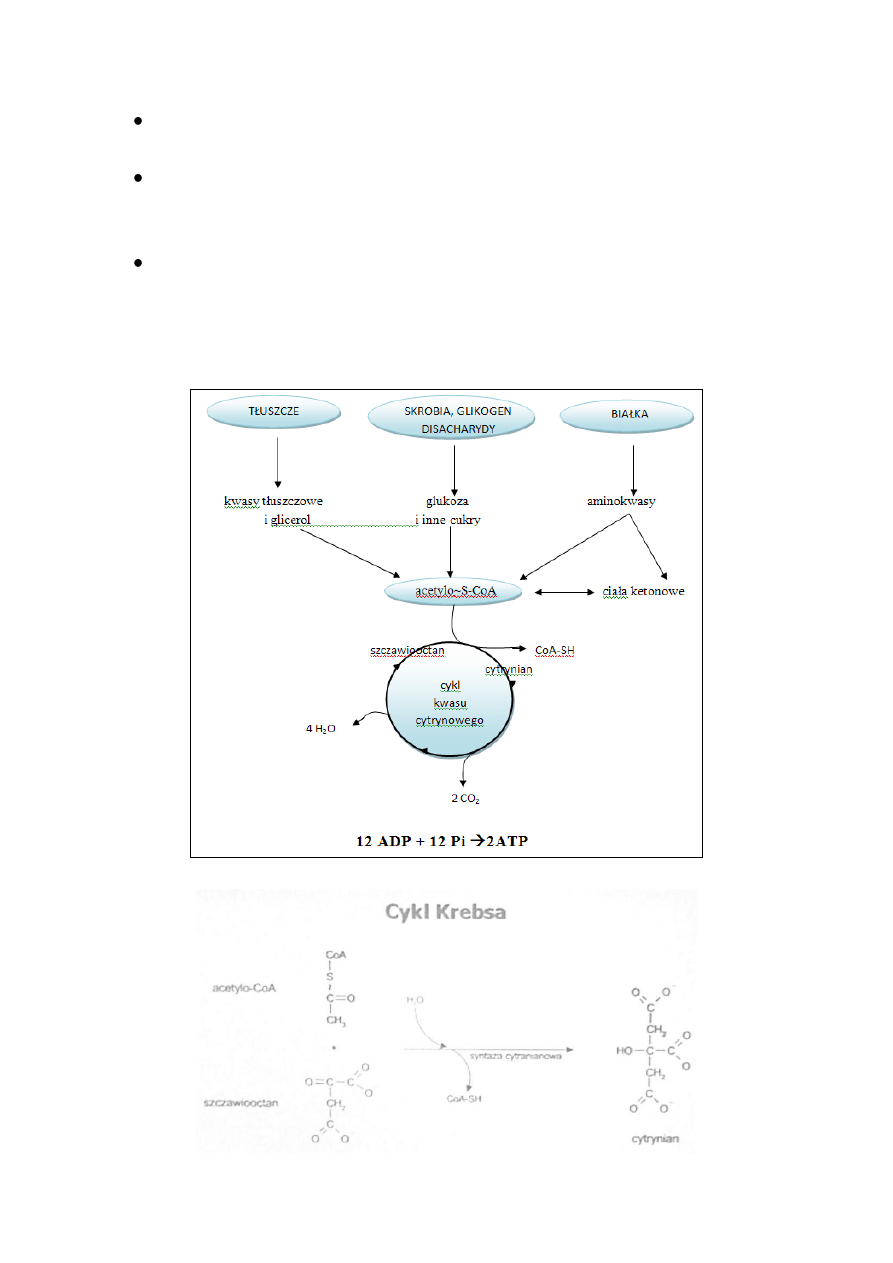
Utlenianie acetylo~S-KoA przez cykl Krebsa zużywa 2/3 całkowitej
ilości tlenu i dostarcza 2/3 ATP powstającego w organizmie człowieka.
Ponadto cykl Krebsa dostarcza substratów do różnych syntez, np.
dostarcza α-ketokwasów do reakcji transami nacji i syntezy
aminokwasów.
Cykl funkcjonuje wyłącznie w mitochondriach i jest sprzężony z
reakcjami fosforylacji oksydacyjnej.
CENTRALNE MIEJSCE acetylo~S-CoA I CYKLU KWASU
CYTRYNOWEGO W METABOLIZMIE ENERGETYCZNYM
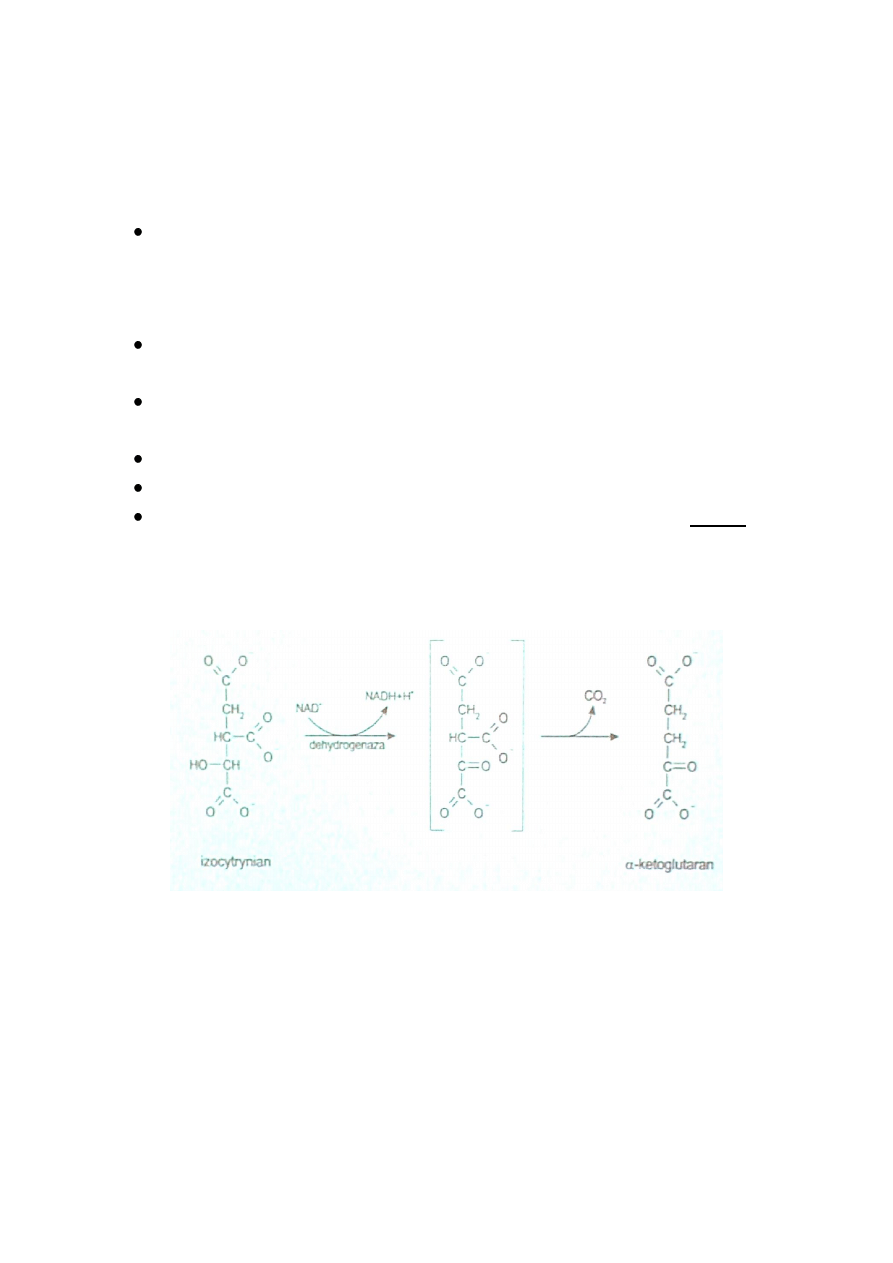
BILANS CYKLU KWASÓW TRIKARBOKSYLOWYCH
Do cyklu wchodzą dwa atomy węgla w postaci reszty acetylowej. Cztery
pary elektronów są przenoszone na akceptory; trzy pary na NAD
+
, który
redukuje się do NADH+H
+
i jedna para na FAD, który redukuje się do
FADH
2
.
Łącznie, w wyniku procesów oksydoredukcyjnych, powstaje
jedenaście cząsteczek ATP.
Dodatkowo powstaje jedna cząsteczka GTP lub ATP na drodze
fosforylacji substratowej.
3 NADH + 3 H
+
+ 9 ADP + 9 Pi
3 NAD
+
+
9 ATP
FADH
2
+ 2 ADP 2 Pi
FAD
+
2 ATP
GTP + ADP
GDP
+
1 ATP
Łącznie 12 ATP
CYKL KREBSA (cd)
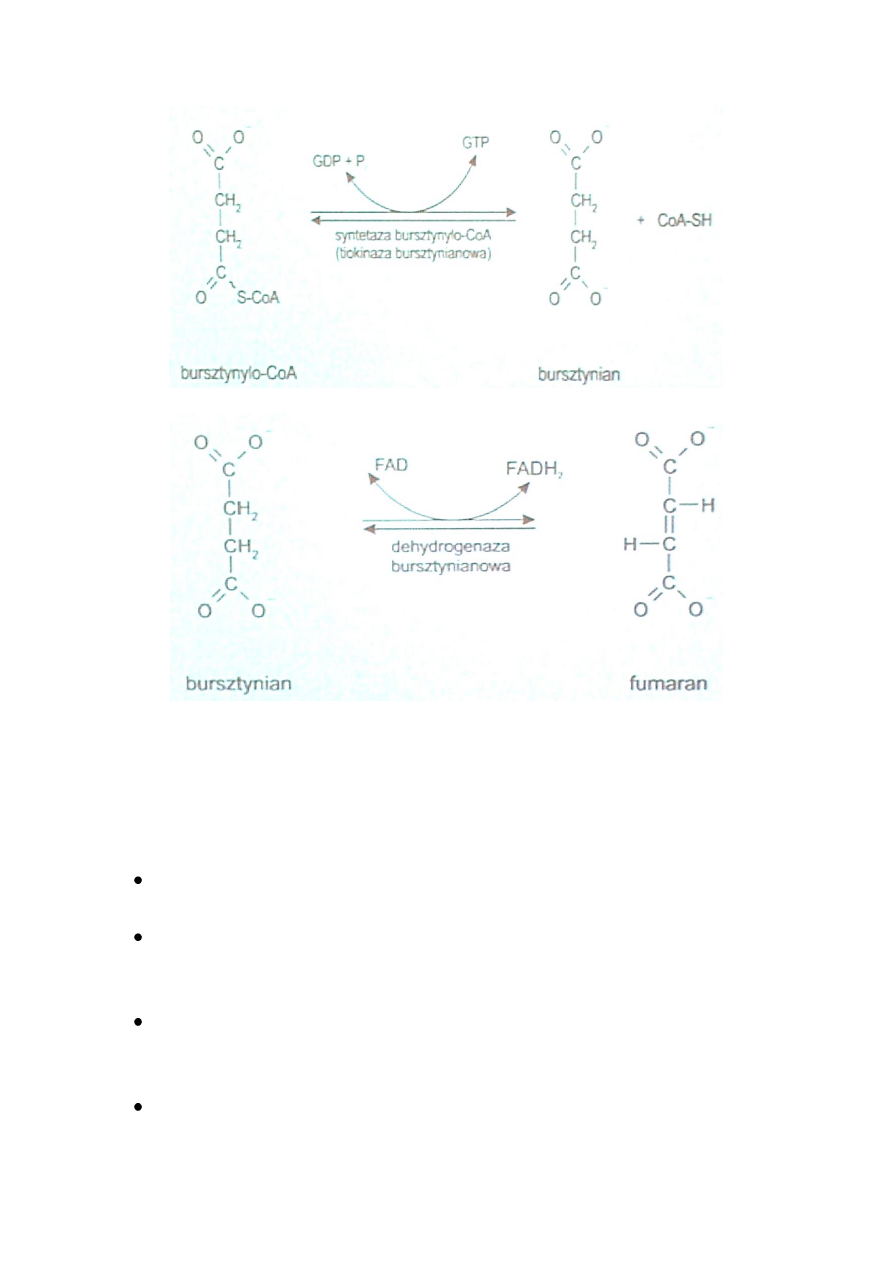
REGULACJA CYKLU KWASÓW TRIKARBOKSYLOWYCH
Cykl Krebsa jest głównym źródłem energii, podlega precyzyjnej regulacji.
Dostatek energii w komórce,, cechujący się wysoką zawartością ATP,
GTP i NADH+H
+
, jest sygnałem do spowolnienia cyklu Krebsa.
Niedobór energii, objawiający się ubytkiem tych nukleotydów z
równoczesnym wzrostem zawartości ADP, GDP i NAD
+
nasila ten
proces.
Regulacja przez dostępność substratu – zwiększa efektywność
o acetylo~S-CoA, powstaje w oksydacyjnej dekarboksylacji
pirogronianu i β-oksydacji kwasów tłuszczowych.
Regulacja przez aktywację i inhibicję enzymów

o syntazy
cytrynianowej,
dehydrogenazy
izocytrynianowej,
dehydrogenazy α-ketoglutaranowej
Aktywuje enzymy ADP, Ca
2+
, hamuje ATP, NADH
Regulacja poprzez dostępność ADP i utlenionych koenzymów
o
Wzrost zawartości ADP przyspiesza jego zużycie w reakcjach
produkujących ATP. Jeżeli zawartość ADP (lub Pi) w komórce jest
obniżona, to tworzenie ATP drogą fosforylacji oksydacyjnej
maleje. Szybkość oksydacyjnej fosforylacji jest proporcjonalna do
iloczynu stężeń ADP i Pi, a odwrotnie proporcjonalna do stężenia
ATP.
o Akumulacja zredukowanego NAD i FAD (odpowiednio maleje
ilość NAD
+
i FAD) powoduje zahamowanie cyklu Krebsa.
POWIĄZANIE CYKLU KREBSA Z INNYMI PRZEMIANAMI
Do każdego obrotu cyklu Krebsa włączają się dwa substraty: reszta
acetylowi i szczawiooctan, ten drugi odtwarza się. W praktyce pewne
metabolity „wypadają” z cyklu Krebsa i włączają się do innych przemian,
a produkty innych szlaków zasilają cykl swoimi metabolitami.
Ketokwasy, będące metabolitami tego cyklu, stają się akceptorami grup
aminowych i przechodzą w aminokwasy. Część cytrynianu opuszcza
mitochondriom przenosząc reszty acetylowi (octanowe) do cytosolu,
gdzie służą one jako substraty do syntezy kwasów tłuszczowych i
cholesterolu. Znaczna
ilość
szczawiooctanu
włącza
się
do
glukoneogenezy.
Cykl Krebsa jest zasilany przez metabolity powstające w wyniku transami
nacji i deaminacji aminokwasów.
BILANS ENERGETYCZNY PRZEMIANY GLUKOZY DO CO
2
i H
2
O
Cząsteczka glukozy, utleniając się do 6 cząsteczek CO
2
i 12 cząsteczek H
2
O,
dostarcza 38 cząsteczek ATP.
C
6
H
12
O
6
+ 6O
2
+ 38 ADP + 38 Pi 6 CO
2
+ 6 H
2
O + 38 ATP
Glikoliza
8 ATP
Oksydacyjna dekarboksylacja pirogronianu
2x3=
6 ATP
Cykl Krebsa
2x12=
24ATP

Jeżeli w transporcie równoważników redukcyjnych z cytoplazmy do
mitochondriom uczestniczy mostek glicerofosforanowy, współdziałający z
FAD, wtedy zysk energetyczny w przeliczeniu na jedną cząsteczkę glukozy
wyniesie 36 cząsteczek ATP.
Mózg, rdzeń nerki, pracujący mięsień, a także krwinki czerwone
wymagają stałego dopływu glukozy jako substratu energetycznego. W
sytuacji, gdy stężenie glukozy we krwi maleje, następuje uruchomienie
glikogenolizy (rozpad glikogenu), która dostarcza glukozy do krwi, a
poprzez krew do innych tkanek. Glikogen wątrobowy może zaspokoić
potrzeby energetyczne przez okres 10 do 18 godzin. Po tym okresie
zasoby glikogenu w wątrobie zostają wyczerpane.
Wówczas zostaje uruchomiona synteza glukozy z substratów nie
będących cukrami. Proces ten nosi nazwę glukoneogenezy.
Glukoneogeneza nie jest prostym odwróceniem glikolizy. Miejscem
glukoneogenezy jest przede wszystkim wątroba, gdzie powstaje około
90% glukozy i w niewielkim stopniu nerka.
Mięśnie są wielkim „konumentem”, a nie „producentem” glukozy.
Zachodzi w nich glikoliza, nie zachodzi glukoneogeneza.
Wyszukiwarka
Podobne podstrony:
biochemia3 id 86647 Nieznany (2)
Biochemia(1) id 86587 Nieznany
biochemia id 86123 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
biochemia4 id 86651 Nieznany
biochemia 6 id 86300 Nieznany (2)
biochemia0001 id 86614 Nieznany
biochemia0008 id 86628 Nieznany (2)
biochemia0005 id 86622 Nieznany (2)
biochemia0003 id 86618 Nieznany (2)
biochemia 8 id 86302 Nieznany (2)
biochemia0002 id 86616 Nieznany
biochemia 4 2 id 86296 Nieznany (2)
biochemia 3 2 id 86285 Nieznany (2)
biochemia5 id 86653 Nieznany (2)
biochemia0006 id 86624 Nieznany (2)
biochemia3 2 id 86648 Nieznany
więcej podobnych podstron