54
repetytorium
Wiązania chemiczne. Budowa cząsteczki
55
repetytorium
Wiązania chemiczne. Budowa cząsteczki
Należy pamiętać, że im wyżej krotne jest wiązanie, tym jego długość jest mniejsza, a energia
większa.
Na podstawie różnicy elektroujemności można określić typ/rodzaj wiązania chemicznego:
umownie przyjęto, że wiązanie kowalencyjne powstaje, gdy różnica elektroujemności ∆E
atomów pierwiastków tworzących cząsteczkę jest niewielka lub równa zero (∆E < 0,4). Wią-
zanie kowalencyjne spolaryzowane tworzy się pomiędzy atomami pierwiastków, dla któ-
rych różnica elektroujemności ∆E przyjmuje wartości 0,4 ≤ ∆E < 1,7, a wiązanie jonowe
powstaje między pierwiastkami znacznie różniącymi się elektroujemnością (∆E ≥ 1,7).
Wiązanie kowalencyjne (atomowe) polega na uwspólnieniu odpowiedniej liczby elektro-
nów walencyjnych, czyli utworzeniu odpowiedniej liczby wiążących par elektronowych.
Uwspólniona para lub pary elektronowe znajdują się między rdzeniami atomów, a zatem
w równym stopniu oddziałują na nie jądra obu atomów. Jeżeli uwspólniono jedną parę elek-
tronową, to wiązanie nazywamy pojedynczym, jeżeli uwspólniono dwie pary elektronowe –
podwójnym, a trzy – potrójnym. Krotność wiązania wynosi odpowiednio: jeden, dwa, trzy,
np.
cząsteczka fluoru
cząsteczka azotu
N N
F F
Jedna wspólna para elektronowa:
wiązanie pojedyncze
▪
krotność wiązania jest równa 1
▪
Trzy wspólne pary elektronowe:
wiązanie potrójne
▪
krotność wiązania jest równa 3
▪
Wiązanie kowalencyjne może być spolaryzowane. Polaryzacja wiązania polega na przesu-
nięciu wspólnej pary elektronowej w kierunku atomu o większej elektroujemności, gdyż
rdzeń tego atomu silniej oddziałuje na wiążącą parę elektronową. Konsekwencją tego jest
rozdzielenie ładunku wewnątrz cząsteczki: atom bardziej elektroujemny zyskuje cząstkowy
ładunek ujemny (δ–), a atom mniej elektroujemny cząstkowy ładunek dodatni (δ+).
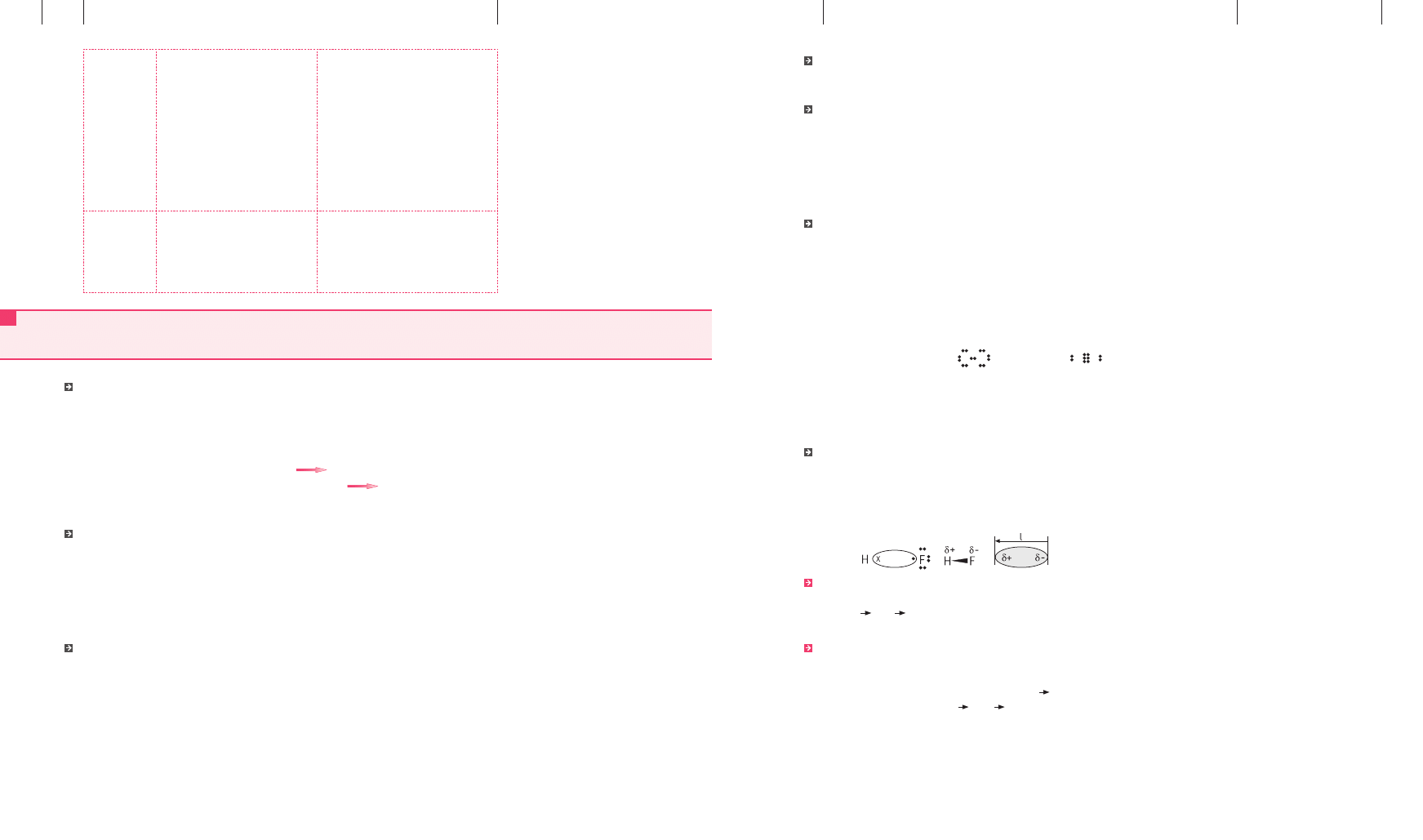
Cząsteczka HF jest dipolem. Dipol to układ dwóch ładunków elektrycznych q o jednakowej
wartości, lecz przeciwnych znakach, znajdujących się w niewielkiej odległości l.
μ = q · l [D] = [C · m]
Stopień polaryzacji wiązania można określić, podając moment dipolowy wiązania. Zgodnie
z umową jest to wektor o zwrocie od bieguna ujemnego do bieguna dodatniego. Jeżeli w czą-
steczce występuje kilka wiązań atomowych spolaryzowanych, to można (w pewnym uprosz-
czeniu) przyjąć, że moment dipolowy cząsteczki μ jest sumą wektorową momentów dipolo-
wych poszczególnych wiązań: μ =
∑
μ
i
i
.
1930
Robert S. Mulliken
(1896-1986), amerykański
fizyk. Nagroda Nobla (1966)
z chemii.
John Clarke Slater
(1900-1976), amerykański
fizyk i chemik.
Friedrich Hermann Hund
(1896-1997), niemiecki fizyk.
Teoria orbitali molekularnych.
1939
Linus Pauling
The Nature of the Chemical Bond
Usystematyzował wiedzę na temat
wiązań chemicznych; wyjaśnił teorię
hybrydyzacji, wiązań kowalencyjnych
i jonowych oraz elektroujemności.
Wiązania chemiczne i budowa cząsteczek
Wiązanie chemiczne to oddziaływanie pomiędzy elektronami atomów, szczególnie elektro-
nami walencyjnymi, prowadzące do powstania połączeń pomiędzy atomami.
Przyczyną tworzenia wiązań chemicznych pomiędzy atomami jest ich „dążenie” do
zmniejszenia energii i uzyskania trwałej walencyjnej konfiguracji elektronowej najbliż-
szego gazu szlachetnego:
helu – dwa elektrony na ostatniej powłoce
▪
dublet elektronowy (reguła dubletu);
neonu, itd. – osiem elektronów na ostatniej powłoce
▪
oktet elektronowy (reguła
oktetu).
Powyższe stwierdzenia stanowią podstawę elektronowej teorii wiązań Lewisa i Kossela. Pier-
wiastki mogą uzyskać trwałą, stabilną i gwarantującą niższy energetycznie stan układu kon-
figurację elektronową, w następujący sposób:
przez uwspólnienie elektronów poszczególnych atomów lub par elektronowych jednego
▪
atomu;
przez przeniesienie elektronów z atomu jednego pierwiastka do atomu innego pierwiastka.
▪
Wiązania chemiczne można klasyfikować ze względu na:
krotność wiązania (np. pojedyncze, podwójne, potrójne);
▪
długość wiązania (czyli odległość między środkami atomów lub odległość jąder połą-
▪
czonych atomów);
energię wiązania (czyli średnią wartość energii dysocjacji wiązania w fazie gazowej dla
▪
wszystkich wiązań tego samego typu w obrębie tego samego rodzaju chemicznego);
rodzaj/typ wiązania (np. atomowe, atomowe spolaryzowane, jonowe).
▪
4.1.

56
repetytorium
Wiązania chemiczne. Budowa cząsteczki
57
repetytorium
Wiązania chemiczne. Budowa cząsteczki
Wiązanie koordynacyjne może powstawać też pomiędzy dwiema cząsteczkami, np.
H
3
N
BF
3
Wiązanie koordynacyjne powstaje pomiędzy cząsteczką amoniaku, będącą donorem pary
elektronowej, a cząsteczką fluorku boru, będącą akceptorem pary elektronowej. Cząstecz-
ka BF
3
reprezentuje układ z tzw. niedoborem elektronów, gdyż atomy fluoru spełniają regułę
oktetu, a atom boru nie. Atom boru ma sześć elektronów walencyjnych, czyli do oktetu bra-
kuje mu dwóch elektronów, których pozyskanie możliwe jest dzięki utworzeniu z NH
3
wiąza-
nia koordynacyjnego.
Rozważmy także budowę innej cząsteczki, np. kwasu azotowego(V). W cząsteczce tego kwasu
wiązanie koordynacyjne powstaje pomiędzy atomem azotu i atomem tlenu:
H O N
O
O
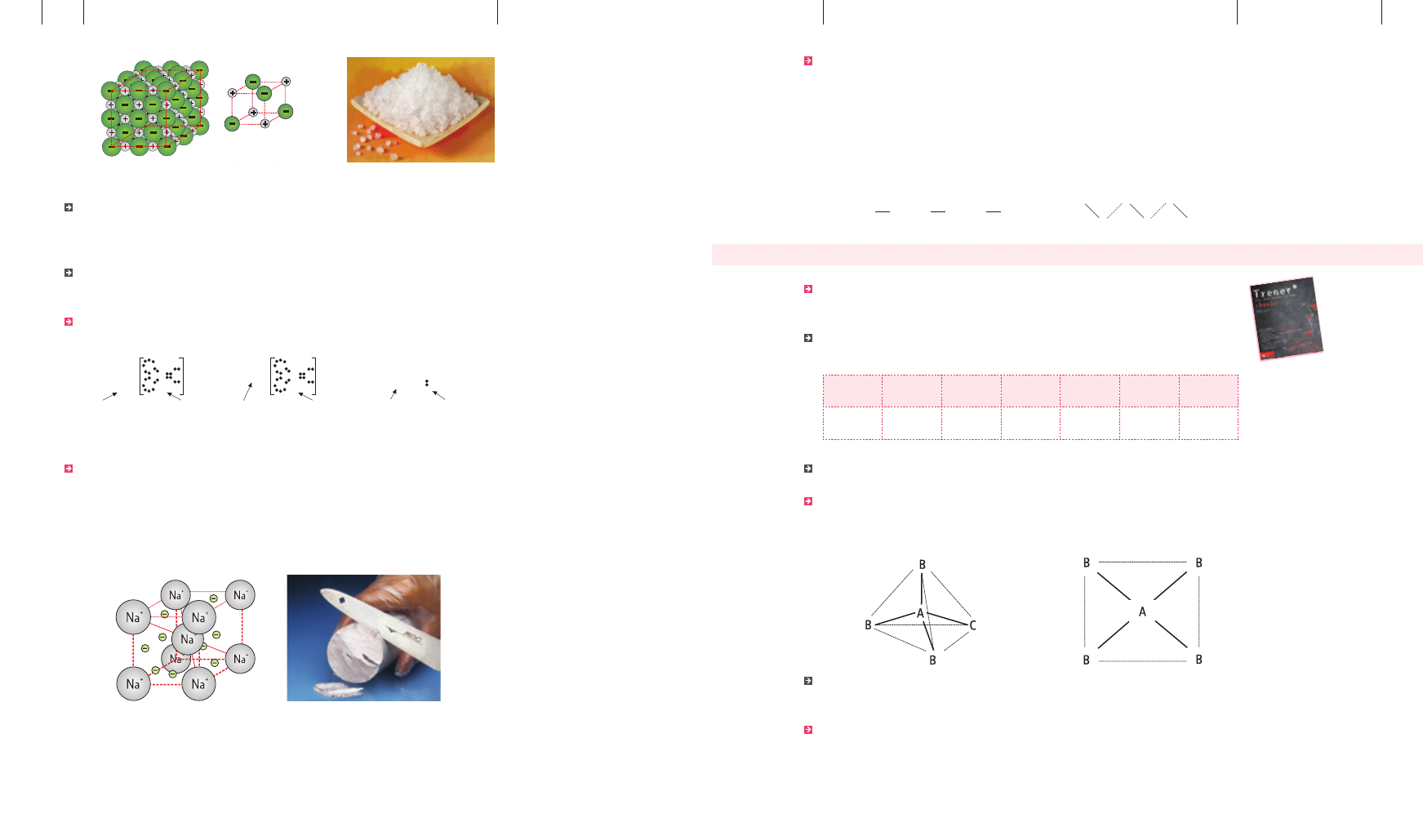
Istotą wiązania jonowego jest elektrostatyczne oddziaływanie między prze-
ciwnie naładowanymi jonami, powstającymi wskutek przeniesienia elektronu
(elektronów) z atomu pierwiastka mniej elektroujemnego do atomu pier-
wiastka bardziej elektroujemnego. Wiązanie jonowe występuje np. w tlenku
wapnia (CaO). W sieci krystalicznej tlenku wapnia kationy wapnia oddziałują
elektrostatycznie z anionami tlenkowymi:
20
Ca
–2e
–
20
Ca
2+
16
O
+2e
–
16
O
2–
[Ca
2+
][O
2-
]
W celu uzyskania walencyjnej konfiguracji elektronowej gazu szlachetnego atom wapnia
oddaje dwa elektrony walencyjne, tworząc Ca
2+
. Kation wapnia ma na ostatniej powłoce
elektronowej osiem elektronów, a więc oktet elektronowy. Atom tlenu przyjmuje dwa elek-
trony „oddane” przez atom wapnia i uzyskuje w ten sposób oktet elektronowy na ostatniej
powłoce (reguła oktetu zostaje spełniona).
Jednym z najlepiej znanych związków jonowych jest sól kuchenna, czyli chlorek sodu. Poni-
żej przedstawiono fragment sieci krystalicznej tego związku oraz mechanizm powstawania
oddziaływań pomiędzy tworzącymi ją jonami.
Cl
Cl
Na
Na
+
-
[
11
Na] = K
2
L
8
M
1
[
11
Na
+
] = K
2
L
8
= [Ne]
[
17
Cl] = K
2
L
8
M
7
[
17
Cl
–
] = K
2
L
8
M
8
= [Ar]
W zależności od rodzaju symetrii cząsteczki jej moment dipolowy może być równy zero (czą-
steczka symetryczna, w której istnieją elementy symetrii, takie jak np. środek symetrii,
płaszczyzna symetrii, itp.) albo różny od zera, np.
S
µ
1
½ δ-
δ-
µ
2
½ δ+
H
H
µ
1
µ
0
µ
µ
2
C
O
O
µ
1
δ-
δ-
2 δ+
µ
2
µ
1
µ
= 0
µ
2
Cząsteczka siarkowodoru ma budowę kątową (niesyme-
tryczny rozkład ładunków – cząsteczka jest dipolem).
Cząsteczka CO
2
ma budowę liniową (symetryczny rozkład
ładunków – cząsteczka nie jest dipolem).
Substancje polarne (µ 0) są zwykle dobrze rozpuszczalne w rozpuszczalnikach polarnych
(np. w wodzie), natomiast substancje niepolarne (µ = 0) słabo rozpuszczają się w rozpuszczal-
nikach polarnych.
SPRAWDŹ SIĘ
4.1.1. Określ rodzaj wiązań cząsteczki H
2
O oraz przedstaw schemat ich tworzenia, wzór
elektronowy kreskowy odzwierciedlający rzeczywisty kształt cząsteczki i kąt między
wiązaniami. Odpowiedz na pytanie: czy cząsteczka jest polarna?
Wiązanie koordynacyjne jest szczególnym przypadkiem wiązania kowalencyjnego. Wiąza-
nie to nazywane jest wiązaniem donorowo-akceptorowym, gdyż tworząca je para elektrono-
wa pochodzi od jednego z atomów, zwanego donorem. Atom, który ją przyjmuje, został na-
zwany akceptorem. Wiązanie to ilustruje się strzałką skierowaną od donora do akceptora:
+
N
H
H N H
H
+
+ NH
3
= [H
NH
3
]
+
lub
W powyższym równaniu, przedstawiającym tworzenie kationu amonowego, kation wodoru
„potrzebuje” dwóch elektronów do spełnienia reguły dubletu, atom azotu w cząsteczce amo-
niaku ma już osiem elektronów, czyli oktet elektronowy. Atom azotu, oddając swoją wolną
parę elektronową, czyli dwa z ośmiu elektronów, na „wspólne użytkowanie” z kationem wo-
doru, nie traci elektronów, dzięki czemu kation wodoru zyskuje dwa elektrony i spełniona
zostaje dla niego reguła dubletu. W jonie amonowym NH
4
+
występują cztery wiązania ato-
mowe spolaryzowane, w tym jedno koordynacyjne.
Trener – str. 6, 7, 8, 10
58
repetytorium
Wiązania chemiczne. Budowa cząsteczki
59
repetytorium
Wiązania chemiczne. Budowa cząsteczki
Wiązanie wodorowe należy do oddziaływań międzycząsteczkowych lub wewnątrzcząstecz-
kowych. Wiązanie takie wytwarza się pomiędzy cząsteczkami związków zbudowanych z ato-
mu wodoru i atomu innego silnie elektroujemnego pierwiastka, mającego niewiążące pary
elektronowe. Na atomie wodoru gromadzi się cząstkowy ładunek dodatni, a na atomie dru-
giego pierwiastka cząstkowy ładunek ujemny. Wiązanie wodorowe polega więc na elektro-
statycznym przyciąganiu pomiędzy atomem wodoru a wolną parą elektronową atomu pier-
wiastka silnie elektroujemnego. Atomy biorące udział w tworzeniu wiązania wodorowego
mogą należeć do tej samej cząsteczki lub różnych cząsteczek, np.
H CN … H CN … H CN
H
H
H
F
F
F
SPRAWDŹ SIĘ
4.1.2. Czy pomiędzy cząsteczkami NH
3
może się tworzyć wiązanie wodorowe? Odpowiedź
uzasadnij.
4.1.3. Na podstawie różnicy elektroujemności określ rodzaj/typ wiązania chemicznego
(wpisując jego nazwę do tabeli) w następujących substancjach:
H
2
S
Na
2
S
SiO
2
Li
2
O
Br
2
NH
3
CCl
4
4.1.4. Przedstaw wzory elektronowe następujących substancji: PH
3
, CS
2
, Br
2
O.
4.1.5. Czy przedstawione poniżej cząsteczki (przy założeniu, że tworzone wiązania są wią-
zaniami atomowymi spolaryzowanymi) mają zerowy czy niezerowy moment dipolo-
wy? Odpowiedź uzasadnij.
Rys. 1
Rys. 2
4.1.6. Jakie jony tworzą sieć krystaliczną wodorotlenku sodu? Przedstaw je za pomocą
wzorów elektronowych.
4.1.7. Przedstaw za pomocą wzorów elektronowych kwasy: chlorowy(I) i chlorowy(VII).
Trener – str. 18, 20, 25, 26
model kryształu chlorku sodu (NaCl)
próbka chlorku sodu (NaCl)
Należy pamiętać, że nie istnieją pojedyncze cząsteczki związku jonowego. Wzór sumaryczny
takiego związku (np. CaO, NaCl) określa rodzaj jonów w sieci krystalicznej oraz ich stosunek
ilościowy.
Wiązanie jonowe (niezależnie od wartości ∆E) występuje w tlenkach, wodorkach, wodoro-
tlenkach i solach metali aktywnych.
Przykłady innych związków jonowych:
węglan sodu (Na
2
CO
3
)
azotan(V) potasu (KNO
3
)
wodorek sodu (NaH)
O
O
C
Na
+
Na
+
O
kation prosty anion złożony
2–
N
K
+
kation prosty anion złożony
–
O
O
O
Na
+
[H ]
-
kation prosty anion prosty
Inne rodzaje wiązań
Wiązanie metaliczne występuje w kryształach metali, stopach metali i związkach między-
metalicznych. Polega na elektrostatycznym oddziaływaniu dodatnich rdzeni atomowych me-
tali ze swobodnie poruszającymi się elektronami (gaz elektronowy). Swobodne elektrony od-
powiedzialne są za wysokie przewodnictwo elektryczne i cieplne metali, ich połysk, kowalność
i ciągliwość. Poniżej znajduje się schematyczny rysunek obrazujący powstawanie wiązania
metalicznego sodu.
struktura krystaliczna sodu
próbka sodu
60
repetytorium
Wiązania chemiczne. Budowa cząsteczki
61
repetytorium
Wiązania chemiczne. Budowa cząsteczki
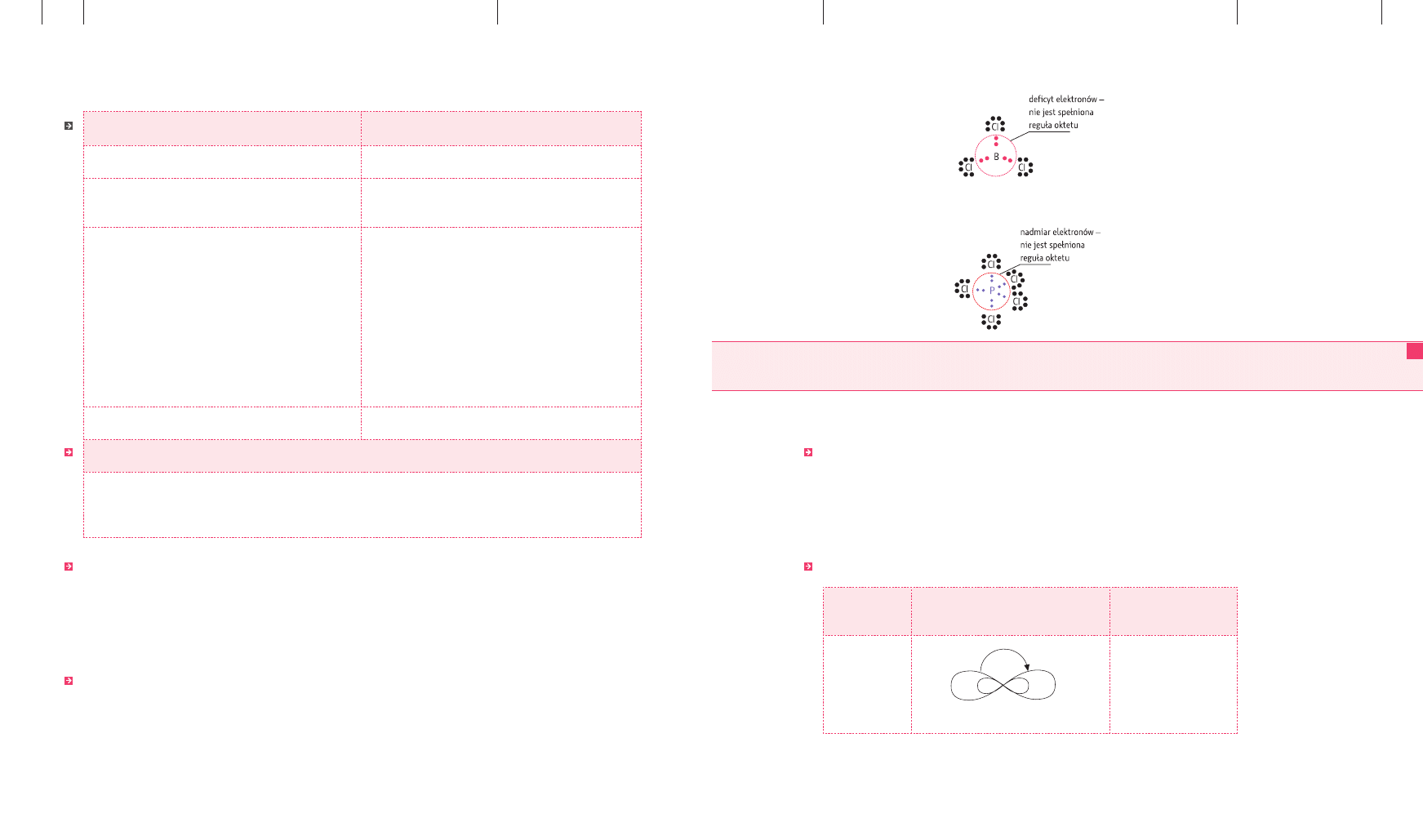
Związki glinu i boru należą do związków z deficytem elektronowym – dla atomu cen-
▪
tralnego nie jest spełniona reguła oktetu (na powłoce walencyjnej jest mniej niż osiem
elektronów), np. BCl
3
.
Związki fosforu należą do tzw. związków z nadmiarem elektronów atomu centralnego
▪
(powłoka walencyjna tego atomu zawiera więcej niż osiem elektronów), np. PCl
5
.
Budowa cząsteczki na gruncie teorii orbitali molekularnych
Hybrydyzacja orbitali atomowych
Hybrydyzacja to zabieg matematyczny polegający na kombinacji liniowej walencyjnych orbitali
atomowych tego samego atomu. Otrzymane zhybrydyzowane orbitale (hybrydy) charakteryzują
się jednakowym kształtem konturu i energią, co odróżnia je od orbitali, z których powstały.
Typ hybrydyzacji określa, które walencyjne orbitale atomowe zostały poddane matematyczne-
mu przekształceniu, a jednocześnie wyznacza rozmieszczenie przestrzenne powstałych hybryd.
Hybrydy są ułożone w przestrzeni w sposób gwarantujący ich minimalne oddziaływania.
Krótką charakterystykę typów hybrydyzacji przedstawia poniższa tabela.
Typ
hybrydyzacji
Ułożenie hybryd
Nazwa hybrydyzacji
sp
180°
dwie hybrydy ułożone liniowo
hybrydyzacja
dygonalna
4.2.
Porównanie właściwości substancji o budowie jonowej
i kowalencyjnej
Substancje jonowe
Substancje z wiązaniami kowalencyjnymi
Ciała stałe
Gazy, ciecze lub ciała stałe
Na ogół dobrze rozpuszczają się w rozpuszczalnikach po-
larnych, np. w wodzie, ulegając dysocjacji elektrolitycznej.
Bardzo słabo rozpuszczają się w wodzie, rozpuszczają się
w rozpuszczalnikach niepolarnych.
Jonowa sieć krystaliczna zawierająca rozmieszczone w spo-
sób uporządkowany jony.
Jony (kationy i aniony) oddziałują na siebie siłami elektro-
statycznymi.
Są to substancje stałe, mające wysokie temperatury top-
nienia, dużą wytrzymałość i twardość.
Jako ciała stałe mogą formować:
kryształy molekularne: tworzone zazwyczaj przez czą-
▪
steczki oddziałujące na siebie słabymi siłami van der
Waalsa; charakteryzują się niskimi temperaturami top-
nienia i wrzenia, niewielką twardością i małą wytrzyma-
łością mechaniczną; np. jod, tlen, zestalony metan;
kryształy kowalencyjne: tworzone są przez atomy połączo-
▪
ne wiązaniami kowalencyjnymi; charakteryzują się wyso-
kimi temperaturami wrzenia i topnienia, dużą twardością
i wytrzymałością mechaniczną; np. diament, SiO
2
.
W stanie stopionym i w roztworze wodnym przewodzą prąd.
Nie przewodzą prądu elektrycznego (z wyjątkiem grafitu).
Substancje metaliczne
Sieć krystaliczna jest utworzona przez dodatnie rdzenie atomowe oddziałujące ze swobodnie krążącymi elektronami;
cechują się połyskiem, kowalnością, ciągliwością, dobrym przewodnictwem ciepła i elektryczności;
mają wysokie temperatury topnienia.
Dla niektórych substancji można zaobserwować zjawisko zwane polimorfizmem. Polega
ono na tym, że substancja w zależności od warunków temperatury i ciśnienia może krystali-
zować w kilku odmianach krystalicznych (różniących się budową sieci przestrzennej). W przy-
padku substancji prostej zjawisko to nosi nazwę alotropii.
Cząsteczki z deficytem i nadmiarem elektronów
Cząsteczki niektórych substancji mogą być trwałe i mogą istnieć, mimo iż nie są dla nich speł-
nione reguły oktetu i dubletu. Na następnej stronie omówiono przykłady takich związków.
Wyszukiwarka
Podobne podstrony:
Persona, Dymara Chemia repetytorium Medyk Tom 1 i 2 (2012, 04)
Chemia repetytorium A Z
Persona, Dymara Chemia repetytorium Medyk Tom 1 i 2 (2012, 04)
Chemia repetytorium A Z
Chemia repetyorium matura A Z
chemia zadania i repetytorium ćw
PROTISTY(1), Podręczniki i repetytoria- biologia, chemia
repetytorium chemia cz 2
chemia zadania i repetytorium ćw
więcej podobnych podstron