
WPROWADZENIE
Najbardziej skutecznym sposobem leczenia z³oli-
wych guzów litych do dnia dzisiejszego jest ich chirur-
giczne usuniêcie w mo¿liwie najwczeniejszym stadium
rozwoju. Leczenie takie bardzo czêsto uzupe³niane jest
chemioterapi¹ i radioterapi¹. Od kilku lat trwaj¹ intensyw-
ne prace badawcze maj¹ce na celu wprowadzenie do te-
rapii leków hamuj¹cych angiogenezê. Wstêpne doniesie-
nia kliniczne s¹ doæ zachêcaj¹ce.
ANGIOGENEZA
W komórkach guza, którego rozmiar przekroczy³ 1 mm
3
,
wystêpuje hipoksja i hipoglikemia, poniewa¿ od¿ywianie
tych komórek wy³¹cznie drog¹ dyfuzji jest ju¿ niewystar-
czaj¹ce. Niedotlenienie komórek prowadzi do powstania
proteiny zwanej Hypoxia Inducible Factor-1 (HIF-1),
która wspólnie z produktami zmutowanych genów p53,
src, ras i raf stymuluje produkcjê jednej z g³ównych cyto-
kin proangiogennych czynnika wzrostu komórek ród-
163
Onkol. Pol. 2000, 3, 3: 163-167
ISSN 1505-6732
Prace pogl¹dowe
Hamowanie funkcji metaloproteinaz
mo¿liwoci zastosowania klinicznego
Matrix metalloproteinase inhibition posibility of clinical use
Krzysztof Ko³omecki
Klinika Chirurgii Endokrynologicznej i Ogólnej Instytutu Endokrynologii AM w £odzi
STRESZCZENIE
W rozwoju nowotworów, wród wielu czynników, znacz¹c¹ rolê odgrywaj¹ enzymy proteoli-
tyczne zwi¹zane z atomami Zn-metaloproteinazy (MMPs). Powoduj¹ one degradacjê b³ony
podstawnej naczyñ oraz macierzy zewn¹trzkomórkowej, co umo¿liwia wzrost guza i powsta-
wanie przerzutów. Udowodniono rolê MMPs w rozwoju wielu guzów z³oliwych oraz chorób
nienowotworowych. Naturalnymi inhibitorami MMPs s¹ a2-makroglobulina i tkankowe inhibi-
tory metaloproteinaz (TIMPs). Poziom MMPs w tkankach mo¿na obni¿aæ przez hamowanie
ich wytwarzania (blokowanie lub transfekowanie odpowiednich genów, dzia³anie rybozymu na
mRNA) lub hamowanie aktywacji MMPs (np. inhibitory aktywatorów plazminogenu). Istnieje
równie¿ mo¿liwoæ hamowania aktywnych postaci MMPs przez podawanie zwi¹zków chela-
towych. Zwi¹zkami takimi s¹ antybiotyki (pochodne tetracyklin i antybiotyków antracyklino-
wych), zwi¹zki karboksyalkilowe, hydroksamatowe (batimastat, marimastat), tiole i fosfona-
midy. Wyniki badañ klinicznych nad zastosowaniem wybranych zwi¹zków (np. marimastatu)
s¹ zachêcaj¹ce.
S£OWA KLUCZOWE:
angiogeneza, metaloproteinazy, inhibitory metaloproteinaz
ABSTRACT
Proteolityc enzymes, Zn ion dependent metaloproteases (MMPs), play significant role in the
development of neoplasms. They degrade the vascular basal membrane and extracellular ma-
trix (ECM) and, therefore, enable tumour growth and formation of distant metastases. The role
of MMPs in the development of malignant neoplasms and non-malignant diseases has been
confirmed. Natural MMPs inhibitors are: a2-macroglobulin and tissue MMPs inhibitors (TIMPs).
The MMP level in tissues can be decreased as a result of inhibiting production of MMPs (knoc-
king out the normal gene or transfecting it, as well as reducing the production of mRNA for
a specific MMP by means of antisense RNA or ribozimes) or their activation (inhibitors of pla-
sminogen activators). It is also possible to block active MMPs by chelating agents, including
antibiotics (tetracyclines or antracycline derivants), carboxyalkyl, hydroxamates agents (Ma-
rimastat), thiols and phosphonamidates compounds. The results of clinical research on the
use of some of these agents (for examole Marimastat) are encouraging.
KEY WORDS:
angiogenesis, metaloproteinases, inhibitors of metaloproteinases

b³onka (vascular endothelial growth factor VEGF).
VEGF wspólnie z innymi cytokinami, takimi jak czynnik
wzrostu fibroblastów (bFGF), ³o¿yskowy czynnik wzro-
stu (PlGF), nie tylko stymuluje komórki ródb³onka na-
czyniowego do proliferacji i migracji, ale równie¿ aktywu-
je gen bcl-2, którego produkt hamuje apoptozê. VEGF
wzmaga przepuszczalnoæ naczyñ (dzia³a 50 000 razy sil-
niej ni¿ histamina), umo¿liwiaj¹c przez to przenikanie do
przestrzeni pozanaczyniowej plazminogenu i fibrynogenu.
Wspólnie z innymi cytokinami aktywuje aktywatory pla-
zminogenu, takie jak aktywator urokinazowy (uPA) czy
tkankowy (tPA). Pod wp³ywem tych aktywatorów docho-
dzi do rozszczepienia plazminogenu i uwolnienia protea-
zy zwanej plazmin¹. Plazmina ods³ania centra aktywne
metaloproteinaz (MMPs) enzymów proteolitycznych
macierzy zewn¹trzkomórkowej (ECM) przez odszczepie-
nie cysteiny od regionu zawieraj¹cego atom cynku (1-4).
METALOPROTEINAZY
Metaloproteinazy s¹ enzymami proteolitycznymi od-
powiedzialnymi za degradacjê wielu bia³ek ECM. Jako je-
dyne trawi¹ kolagen typu IV, który stanowi szkielet b³o-
ny podstawnej naczyñ. Dopiero uszkodzenie tej b³ony
umo¿liwia migracjê komórek ródb³onka naczyniowego
do ECM i tworzenie nowych naczyñ, w przestrzeni rów-
nie¿ zdegradowanej przez MMPs. Przez uszkodzon¹ b³o-
nê podstawn¹ mog¹ migrowaæ nie tylko komórki ród-
b³onka, ale równie¿ komórki nowotworowe, co prowadzi
do powstawania przerzutów (3, 4).
MMPs s¹ endopeptydazami zwi¹zanymi z atomami
Zn, wykazuj¹cymi aktywnoæ w neutralnym pH i w obe-
cnoci jonów wapnia. Atomy Zn odgrywaj¹ rolê katali-
tyczn¹ oraz strukturaln¹ (4).
Poznano 20 MMPs, które podzielono na 4 podstawo-
we grupy: kolagenazy, gelatynazy, stromielizyny i tzw.
b³onowe MMPs (MT-MMPs). Poszczególne MMPs ró¿-
ni¹ siê miêdzy sob¹ budow¹ oraz substratami, na które od-
dzia³uj¹. Wydzielane s¹ w formie nieczynnych proen-
zymów i w takiej postaci znajduj¹ siê we wszystkich
tkankach ustroju. MMPs bior¹ udzia³ w wielu procesach
fizjologicznych, takich jak np. przebudowa endometrium
macicy w czasie cyklu miesi¹czkowego, przebudowa ko-
ci i chrz¹stek (odgrywaj¹ znacz¹c¹ rolê w osteoporozie),
uczestnicz¹ w gojeniu siê ran, a tak¿e owrzodzeñ ¿o³¹dka
i dwunastnicy (4, 5). Aktywacja MMPs polega na od-
szczepieniu cysteiny z fragmentu enzymu zwi¹zanego
z atomem Zn, co prowadzi do zmiany konformacji cz¹-
steczki i umo¿liwia proteolityczne odszczepienie frag-
mentu N-koñcowego, w wyniku czego dochodzi do ods³o-
niêcia centrum aktywnego z atomem Zn.
Uczestniczyæ w tym mog¹ inne MMPs; np. MMP-2
jest silnym aktywatorem MMP-9 (3). MMP-2, MMP-3,
MMP-7, MMP-9 s¹ enzymami degraduj¹cymi kolagen ty-
pu IV, bez strawienia którego nie mo¿e dojæ do uszko-
dzenia b³ony podstawnej naczynia. Z rozwojem ka¿dego
guza z³oliwego musi byæ zatem zwi¹zana chocia¿ jedna
z tych MMPs. Pozosta³e MMPs, takie jak MMP-1, MMP-8,
inne rodzaje kolagenu i bia³ka zawarte w ECM równie¿
przyczyniaj¹ siê do wzrostu nowotworu. MT-MMP bêd¹c
enzymami b³onowymi komórek nowotworowych aktywuj¹
inne MMPs; np. MT1-MMP aktywuje MMP-2, MMP-9,
MMP-13 (6, 7).
MMP-1 odgrywa rolê w rozwoju raka jelita grubego,
p³uca, trzustki, p³askonab³onkowych raków g³owy i szyi
oraz czerniaka. MMP-3 odgrywa rolê w rozwoju raków
urotelialnych, kory nadnercza, p³askonab³onkowych oraz
w chorobach nienowotworowych, takich jak choroba
Crohna i wrzodziej¹ce zapalenie jelita grubego. Nie po-
twierdzono udzia³u tego enzymu w rozwoju raka jelita
grubego oraz ¿o³¹dka. MMP-7 odgrywa rolê w rozwoju
raka ¿o³¹dka, jelita grubego, prostaty, a MMP-8 w raku
kory nadnercza i peridontozie. Potwierdzono znaczenie
MMP-9 w takich rakach, jak rak trzustki, rdzeniasty tar-
czycy, jelita grubego, sutka, nerki, prostaty (tylko w gu-
zach aneuploidalnych), kory nadnercza oraz w p³askona-
b³onkowych rakach g³owy i szyi. MMPs odgrywaj¹ rolê
w rozwoju ró¿nych guzów z³oliwych i dlatego tak wa¿-
ne jest stwierdzenie, które MMPs odgrywaj¹ rolê w roz-
woju poszczególnych nowotworów, gdy¿ tylko wówczas
mo¿e istnieæ mo¿liwoæ blokowania w³aciwych MMPs
dla danego guza (4, 7-9).
HAMOWANIE FUNKCJI MMPs
Naturalnymi inhibitorami MMPs s¹ tkankowe inhibi-
tory metaloproteinaz (TIMPs) oraz a2-makroglobulina.
Produkowana przez w¹trobê du¿a proteina (750 kDa)
a2-makroglobulina jest niespecyficznym inhibitorem
wszystkich MMPs, lecz du¿e rozmiary cz¹steczki obni¿a-
j¹ jej zdolnoæ do penetracji pozanaczyniowej, co ograni-
cza bardzo znacznie efekt hamowania MMPs. a2-makro-
globulina pod wp³ywem przy³¹czonej cz¹steczki MMP
zmienia swoj¹ strukturê i zamyka enzym w klatce swo-
jej cz¹steczki (4, 10).
Aktualnie znane s¹ cztery rodzaje TIMPs (TIMP-1,
TIMP-2, TIMP-3, TIMP-4). Mechanizm hamowania akty-
wacji MMPs polega na zablokowaniu przez TIMP, dome-
n¹ N-koñcow¹, mo¿liwoci odszczepienia przez aktywa-
tory N-koñcowego fragmentu MMP, co prowadzi³oby do
ods³oniêcia aktywnego centrum. Ponadto TIMP-2 ma do-
datkowo zdolnoæ blokowania MMP-2 i MMP-3, ponie-
wa¿ mo¿e wi¹zaæ siê z nimi równie¿ przez domenê C-koñ-
cow¹ (4). W tkankach najbardziej rozpowszechnione s¹
TIMP-1 i TIMP-2. Dzia³aj¹ one antyangiogennie równie¿
przez bezporednie hamowanie migracji i proliferacji ko-
mórek ródb³onka naczyniowego. TIMP-2 wykazuje tak-
¿e dzia³anie cytostatyczne na komórki guza, powoduj¹c
zamykanie ich w sieci ródmi¹¿szowego kolagenu (4, 11).
Zaobserwowano, ¿e TIMPs, mimo swoich w³aciwo-
ci hamuj¹cych MMPs, mog¹ równie¿ stymulowaæ roz-
wój nowotworów. Poziom TIMP-1 jest podwy¿szony
u chorych z zaawansowanym rakiem prostaty, w utkaniu
niektórych postaci raka sutka i jelita grubego. Podwy¿szo-
na aktywnoæ TIMP-1 i TIMP-2 w tkance nowotworo-
wej pogarsza rokowanie np. u chorych z rakiem pêcherza
moczowego. Mechanizm tego zjawiska jest do tej pory
niejasny. Stwierdzono jednak, ¿e TIMP-2 wi¹¿e siê
164
Onkol. Pol. 2000, 3, 3: 163-167
ISSN 1505-6732
Matrix metalloproteinase inhibition posibility of clinical use
Krzysztof Ko³omecki
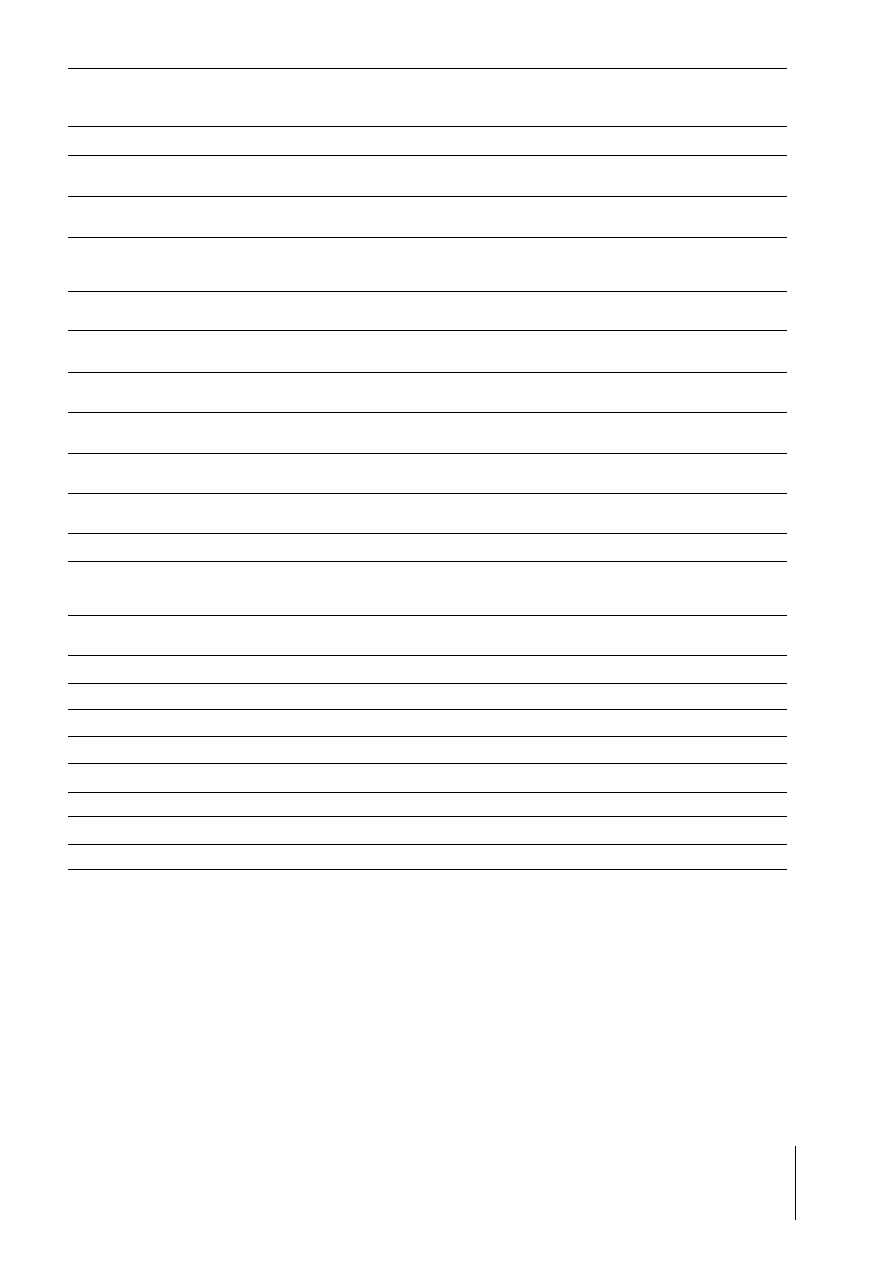
z proMMP-2 przez domenê C-koñcow¹ i z MT1-MMP
przez domenê N-koñcow¹.
Kompleks taki jest blisko zwi¹zany z powierzchni¹
komórki, na której licznie znajduj¹ce siê inne cz¹steczki
MT1-MMP aktywuj¹ cz¹steczkê MMP-2. Sugeruje siê, ¿e
cz¹steczki TIMPs mog¹ zachowywaæ siê jak ligandy dla
receptorów czynników wzrostu oraz cytokin i wp³ywaæ t¹
drog¹ na komórki guza niezale¿nie od wzajemnych inte-
rakcji z MMPs (12-14).
MMPs i TIMPs wystêpuj¹ w formach nieczynnych en-
zymatycznie kompleksów, które musz¹ ulec rozszczepie-
niu, ¿eby uwolniæ aktywne MMPs. Przyjmuje siê, ¿e o ak-
tywnoci proteolitycznej MMPs decyduje nie stopieñ ich
ekspresji, ale wzajemny stosunek miêdzy nimi a czynni-
kami hamuj¹cymi ich aktywnoæ. Zaburzenie tego wza-
jemnego stosunku w tkance nowotworowej prowadzi do
patologicznego zjawiska rozwoju guza z³oliwego (4).
MO¯LIWOCI OBNI¯ENIA POZIOMU MMPs
W TKANKACH
Na poziom aktywnych form MMPs mo¿na wp³yn¹æ
w dwojaki sposób blokuj¹c wytwarzanie MMPs lub ha-
muj¹c ich aktywnoæ.
Zablokowanie genów odpowiedzialnych za wytwarza-
nie odpowiednich MMPs spowodowa³oby oczywicie
spadek ich poziomu w tkankach. Podobny efekt mo¿na by
165
Onkol. Pol. 2000, 3, 3: 163-167
ISSN 1505-6732
Hamowanie funkcji metaloproteinaz mo¿liwoci zastosowania klinicznego
Krzysztof Ko³omecki
Nr / No.
1.
2.
3.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
20.
21.
22.
23.
24.
Nazwa / Name
kolagenaza 1, tzw. ródmi¹¿szowa
collagenase 1, interstitial
¿elatynaza A (72-kDa ¿elatynaza)
gelatinase A (72-kDa gelatinase)
stromelizyna 1
stromelysin 1
matrylizyna
matrilysin
kolagenaza 2, tzw. neutrofilowa
collagenase 2, neutrophil
¿elatynaza B (92-kDa ¿elatynaza)
gelatinase B (92-kDa gelatinase)
stromelizyna 2
stromelysin 2
stromelizyna 3
stromelysin 3
metaloelastaza makrofagowa
macrophage metalloelastase
kolagenaza 3 / collagenase 3
MT1-MMP
MT2-MMP
MT3-MMP
MT4-MMP
kolagenaza 4 / collagenase 4
enamelizyna / enamelysin
brak nazwy / no trivial name
brak nazwy / no name
brak nazwy / no name
MT5-MMP
G³ówne substraty / Substrates
kolagen I, II, III, VII, VIII, X, ¿elatyna, etaktyna, agrekan
collagen I, II, III, VII, VIII, X, gelatin, etaktyn, agrecan
kolagen I, IV, V, VII, X, XI, XIV, ¿elatyna, fibronektyna, laminina, agrekan, elastyna
collagen I, IV, V, VII, X, XI, XIV, gelatin, fibronectin, laminin, agrecan, elastin
kolagen III, IV, V, IX, X, XI, ¿elatyna, laminina, fibronektyna, elastyna, agrekan, kazeina,
tenascyna
collagen III, IV, V, IX, X, XI, gelatin, laminin, fibronectin, elastin, agrecan, cazein, tenascin
kolagen IV, X, ¿elatyna, laminina, fibronektyna, kazeina
collagen IV, X, gelatin, laminin, fibronectin, cazein
kolagen I, II, III, V, VII, VIII, X, proteoglikany, fibronektyna
collagen I, II, III, V, VII, VIII, X, proteoglycan, fibronectin
kolagen IV, V, VII, X, XIV, ¿elatyna, agrekan, elastyna, etaktyna, fibronektyna
collagen IV, V, VII, X, XIV, gelatin, agrecan, elastin, fibronectin
kolagen III, IV, V, ¿elatyna, kazeina, elastyna, laminina, agrekan, fibronektyna
collagen III, IV, V, gelatin, cazein, elastin, laminin, fibronectin
kolagen IV, fibronektyna, laminina, agrekan, kazeina, ¿elatyna
collagen IV, fibronectin, laminin, agrecan, cazein, gelatin
kolagen IV, elastyna, ¿elatyna, fibronektyna, witronektyna, laminina
collagen IV, elastin, gelatin, fibronectin, vitronectin, laminin
kolagen I, II, III / collagen I, II, III
kolagen III, ¿elatyna, fibronektyna, witronektyna, agrekan, perlekan, laminina, tenescyna,
nidogen
collagen III, gelatin, fibronectin, vitronectin, agrecan, perlecan, laminin, tenescin, nidogen
agrekan, perlekan, laminina, bronektyna, tenescyna, nidogen
agrecan, perlecan, laminin, bronectin, tenescin, nidogen
kolagen III, ¿elatyna / collagen III, gelatin
prekursory cytokin / precursors of cytokins
kolagen I, II, III / collagen I, II, III
amelogenin / amelogenin
nieznane / unknown
/
/
/
TABELA I. Metaloproteinazy
TABLE I.
Metalloproteinases

uzyskaæ przez transfekowanie genów odpowiedzialnych
za wytwarzanie TIMPs. Próbuje siê transfekowaæ cDNA
odpowiedzialne za produkcjê TIMP do komórek guza, u¿y-
waj¹c wektora retrowirusowego. U myszy transfekowanych
cDNA dla TIMP-2 uzyskano wzrost poziomu inhibitora
wystarczaj¹cy do zahamowania wzrostu guza. Trudnoci¹,
ograniczaj¹c¹ próby szerszego zastosowania tej metody,
jest problem w znalezieniu odpowiedniego wektora do
stosowania uogólnionego, a nie tylko miejscowego (12, 15).
Wytwarzanie mRNA dla w³aciwej MMP mo¿na zaha-
mowaæ przez stosowanie antisense RNA lub rybozymu (frag-
ment RNA maj¹cy w³aciwoci enzymu degraduj¹cego RNA).
Rybozymy mog¹ oddzia³ywaæ na wybrany rodzaj mRNA.
W warunkach laboratoryjnych uzyskano obni¿enie produkcji
MMP-3 i MMP-9 po zastosowaniu w³aciwych rybozymów.
Obni¿enie poziomu mRNA powoduj¹ równie¿ tetracy-
kliny, omówione szerzej w dalszej czêci pracy (16, 17).
Zwi¹zkami hamuj¹cymi ekspresjê genów MMPs s¹ reti-
noidy (np. witamina A), które stymuluj¹ blokowanie czê-
ci promotorowej genu przez bia³ka transkrypcyjne. Wy-
kazano kliniczn¹ skutecznoæ retinoidów w hamowaniu
rozwoju guzów, np. raków p³askonab³onkowych (18).
Obecnie nieznane s¹ zwi¹zki hamuj¹ce wydzielanie
MMPs z komórki, istniej¹ jednak doniesienia informuj¹ce,
¿e niektóre MMPs, takie jak MMP-3 i MT1-MMP, s¹ akty-
wowane przez furynê. Wydaje siê mo¿liwe, aby inhibito-
ry furyny mog³y zapobiegaæ aktywacji MMPs przed ich
opuszczeniem komórki lub powodowaæ wydzielanie nie-
czynnych enzymów (19).
Wydzielone z komórek proMMPs s¹ aktywowane
przez proteazy serynowe, g³ównie plazminê (pochodz¹c¹
z plazminogenu) oraz w mniejszym stopniu kalikreinê, ka-
tepsynê G i chymazy pochodz¹ce z komórek tucznych.
Próbuje siê blokowaæ geny odpowiedzialne za produkcjê
plazminogenu lub aktywatorów plazminogenu. Myszy
pozbawione plazminogenu nie wytwarza³y MMP-9, na-
wet gdy by³y do tego stymulowane (20).
Zauwa¿ono, ¿e komórki nacieku zapalnego, np. ma-
krofagi, mog¹ wp³ywaæ na poziom MMPs w tkankach.
Stosuj¹c niesteroidowe leki przeciwzapalne, takie jak blo-
kery cyklooksygenazy I i II (aspiryna, piroksykam i me-
loksykam), uzyskano zmniejszenie poziomu MMPs
w tkankach nowotworowych (21).
Wydaje siê, ¿e istnieje mo¿liwoæ wypierania MMPs
z ich po³¹czeñ z receptorami. Zaobserwowano, ¿e MMP-7
i MMP-13 jest wypierana z po³¹czeñ z receptorami przez
heparynê (22).
Zwi¹zki chelatowe blokuj¹ zarówno aktywacjê
proMMPs, jak i dzia³anie na substraty form MMPs ju¿ zak-
tywowanych przez wytwarzanie wi¹zañ chelatowych
z aktywnym centrum zawieraj¹cym jon Zn.
Zwi¹zkami chelatowymi s¹ niektóre antybiotyki,
zwi¹zki tiolowe, karboksyalkilowe, hydroksamatowe i fo-
sfonamidy. Zwi¹zki te nie wykazuj¹ specyficznoci i blo-
kuj¹ ka¿dy enzym zawieraj¹cy Zn, aczkolwiek stwierdzo-
no, ¿e niektóre z nich maj¹ wiêksze powinowactwo do
konkretnych MMPs (28).
Najwiêksz¹ uwagê skupiono obecnie na zwi¹zkach
hydroksamatowych. Niektóre z nich s¹ w II i III fazie prób
klinicznych. W trakcie prób klinicznych s¹ batimastat
(BB-94) i marimastat (BB2516). S¹ to podobne do siebie
zwi¹zki zbli¿one budow¹ do kolagenu. Poniewa¿ batimastat
mo¿e byæ stosowany wy³¹cznie dootrzewnowo, co ograni-
cza w istotny sposób mo¿liwoæ zastosowania go w klinice,
uwagê skupiono nad mo¿liwoci¹ klinicznego zastosowania
marimastatu. Marimastat mo¿e byæ stosowany doustnie. Obe-
cnie trwaj¹ kliniczne prace badawcze nad zastosowaniem te-
go zwi¹zku w leczeniu m.in. raków p³uca, jelita grubego, jaj-
ników, prostaty oraz trzustki. Obserwowano liczne objawy
uboczne u zwierz¹t dowiadczalnych, którym podawano
marimastat w dawce 100-500 mg/kg/dzieñ. By³y to owrzo-
dzenia przewodu pokarmowego, powik³ane czêsto krwa-
wieniem, znaczna utrata wagi, stany zapalne stawów kola-
nowych i ³okciowych oraz zaniki miêniowe. U ludzi stoso-
wano dawkê zredukowan¹ do 50-100 mg/kg/dzieñ i nie
stwierdzono objawów ubocznych poza zapaleniami wielo-
stawowymi, pojawiaj¹cymi siê u chorych przy stosowaniu
dawki 100 mg/kg/dzieñ przez okres powy¿ej 8 tygodni.
Stwierdzono, ¿e dawka 50 mg/kg/dobê jest wystarcza-
j¹ca do uzyskania efektu zahamowania aktywnoci MMP-2
i MMP-9 w raku p³uca przy jednoczesnym braku dzia³añ
ubocznych leku (4, 9).
Innym zwi¹zkiem z tej grupy, bêd¹cym w trakcie ba-
dañ klinicznych, jest preparat Trochate (Ro 32-3555).
Uzyskane wyniki s¹ zbli¿one do wyników uzyskiwanych
po zastosowaniu marimastatu (5).
Pochodn¹ karboksyalkilow¹ jest preparat oznaczony
jako AG 3340, który hamuje funkcjê MMP-2, MMP-9,
MMP-13 i MMP-14. Obecnie znajduje siê w trakcie prób
na zwierzêtach (23).
Sporód innych zwi¹zków do prób klinicznych wszed³
preparat bryostatin-1 lakton makrocykliczny. Jego me-
chanizm dzia³ania antynowotworowego do tej pory jest
niejasny, jednak¿e wykazano, ¿e ma wp³yw hamuj¹cy na
produkcjê MMP-1, MMP-3, MMP-9, MMP-10, MMP-11.
Próby kliniczne wykaza³y doæ dobr¹ tolerancjê bryosta-
tyny. U niektórych chorych stwierdzono dzia³anie niepo-
¿¹dane pod postaci¹ objawów grypopodobnych (4).
Firma Bayer testuje na modelach zwierzêcych po-
chodn¹ bifenolow¹ oznaczon¹ symbolem BAY 12-9566.
Zwi¹zek ten hamuje aktywnoæ przede wszystkim MMP-3
i w mniejszym stopniu MMP-2, MMP-8, MMP-9. Obe-
cnie rozpoczêto badania kliniczne nad zastosowaniem te-
go zwi¹zku u chorych z zapaleniami kostnostawowymi
w przebiegu choroby reumatycznej (24).
Istnieje du¿e prawdopodobieñstwo, ¿e lekami, które znaj-
d¹ miejsce w hamowaniu aktywnoci MMPs, bêd¹ antybio-
tyki. W trakcie przeprowadzonych badañ in vitro oraz in
vivo stwierdzono, ¿e tetracykliny, a przede wszystkim ich
pó³syntetyczne pochodne: doksycyklina i minocyklina, ha-
muj¹ funkcjê MMP-1, MMP-2 i MMM-12. Problemem
przy stosowaniu tych leków jest wystêpowanie bardzo do-
kuczliwych zaburzeñ jelitowych, spowodowanych zaburze-
niami flory jelitowej, przy d³ugotrwa³ym stosowaniu tych
antybiotyków (w celu hamowania funkcji MMPs nale¿y
je podawaæ przez wiele tygodni). W zwi¹zku z tym do
prób klinicznych wprowadzono obecnie pochodne tetracy-
klin, których cz¹steczka zosta³a pozbawiona fragmentu
odpowiedzialnego za dzia³anie antybakteryjne. Hamowa-
nie aktywnoci MMPs odbywa siê na skutek powstawa-
166
Onkol. Pol. 2000, 3, 3: 163-167
ISSN 1505-6732
Matrix metalloproteinase inhibition posibility of clinical use
Krzysztof Ko³omecki

167
Onkol. Pol. 2000, 3, 3: 163-167
ISSN 1505-6732
Hamowanie funkcji metaloproteinaz mo¿liwoci zastosowania klinicznego
Krzysztof Ko³omecki
Pimiennictwo
1. Bouck N., Stellmach V., Hsu S.C.: How tu-
mors become angiogenic. Adran. Cancer
Res. 1996, 69, 135-174.
2. Folkman J.: Clinical application of research
on angiogenesis. N. Engl. J. Med. 1995, 333,
1757-1763.
3. Ray J.M., Stetler-Stevenson W.G.: The role
of matrix metalloproteinases and their inhibi-
tors in tumor invasion, metastasis and angio-
genesis. Eur. Respir. J. 1994, 7, 2062-2072.
4. Wojtowicz-Praga S.M., Dickson R.B., Haw-
kins M.J.: Matrix metalloproteinase inhibi-
tors. Invest. New Drugs 1997, 15, 61-75.
5. Woessner J.F.Jr: Matrix metalloproteinase inhi-
bition. Ann. N. Y. Acad. Sci. 1999, 878, 388-403.
6. Kitagawa Y., Kunimi K., Ito H.: Expression and
tissue localization of membrane type 1, 2
and 3 matrix metalloproteinases in human
urothelial carcinomas. J. Urol. 1998, 160,
1540-1545.
7. Ko³omecki K., Stêpieñ H., Narêbski J.M.: Ma-
trix metalloproteinase serum levels in surgi-
cally treated adrenal tumours. J. Endocrinol.
Invest. 1999, 22 (supl. 7), 63.
8. Tomita T., Iwata K.: Matrix metalloproteinases
and tissue inhibitors of metalloproteinases in
some endocrine organs and their tumors.
Endocrin. Pathol. 1999, 10, 15-26.
9. Wojtowicz-Praga S., Torri J., Johnson M. i wsp.:
Phase I trial of marimastat (BB-2516), a no-
vel matrix metalloproteinase inhibitor admini-
stered orally to patients with advanced lung
cancer. J. Clin. Oncol. 1998, 16, 2150-2156.
10. Nagase H., Itoh Y., Binner S.: Interaction of
alpha 2-macroglobulin with matrix metallo-
proteinases and its use for identification of
their active forms. Ann. N. Y. Acad. Sci.
1994, 732, 294-302.
11. Montgomery A.M., Mueller B.M., Reisfeld
R.A. i wsp.: Effect of tissue inhibitor of the
matrix metalloproteinases-2 expression on
the growth and spontaneous metastasis of
a human melanoma cell line. Cancer Res.
1994, 54, 5467-5473.
12. Blavier L., Nenriet P., Imren S., DeClerck Y.A.:
Tissue inhibitors of matrix metalloproteinases
in cancer. Ann. N. Y. Acad. Sci. 1999, 878,
108-119.
13. Grignon D.J., Sakr W., Toth M. i wsp.: High le-
vels of tissue inhibitor of metalloproteinase-2
(TIMP-2) expression are associated with
poor outcome in invasive bladder cancer.
Cancer Res. 1996, 56, 1654-1659.
14. Lindsay C.K., Thorgeirsson V.P., Tsuda H.:
Expression of tisue inhibitor of metalloprote-
inase-1 and type IV collagenase/gelatinase
messenger RNAs in human breast cancer.
Hum. Pathol. 1997, 28, 359-366.
15. Imren S., Kohn D.B., Shimada H. i wsp.:
Overexpression of tissue inhibitor of metallo-
proteinases-2 in vivo by retroviral mediated
gene transfer inhibits tumor growth and inva-
sion. Cancer Res. 1996, 56, 2891-2895.
16. Flory C.M., Pavco P.A., Jarvis T.C. i wsp.:
Nuclease-resistant ribozymes decrease stro-
melysin mRNA levels in rabbit synovium fol-
lowing exogenous delivery to the knee joint.
Proc. Natl. Sci. USA 1996, 93, 754-758.
17. Hua J., Muschel R.J.: Inhibition of matrix me-
talloproteinase 9 expression by a ribozyme
blocks metastasis in a rat sarcoma model sy-
stem. Cancer Res. 1996, 56, 5179-5284.
18. Schoenermark M.P., Mitchell T.I., Rutter J.L.
i wsp.: Retinoid-mediated suppression of tumor
invasion and matrix metalloproteinase synthe-
sis. Ann. N. Y. Acad. Sci. 1999, 878, 466-485.
19. Maquoi E., Noel A., Frankenne F. i wsp.: In-
hibition of matrix metalloproteinase 2 matu-
ration and HT 1080 invasivenes by a synthe-
tic furin inhibitor. FEBS Lett. 1998, 424, 262-
-266.
20. Lijnen H.R., Vanhoef B., Lupu F. i wsp.: Fun-
ction of the plasminogen/plasmin and matrix
metalloproteinase systems after vascular in-
jury in mice with targeted inactivation of fibri-
nolytic system genes. Arterioscler. Thromb.
Vasc. Biol. 1998, 18, 1035-1045.
21. Greenwald R.A.: Thirty-six years in the clinic
without an MMP inhibitor. Ann. N. Y. Acad.
Sci. 1999, 878, 413-419.
22. Yu W.H., Woessner J.F.: Binding of matrylisin to
glycosaminoglycan. FASEB J. 1997, 9, A1227.
23. Shalinsky D.R., Brekken J., Zou H. i wsp.:
Broad antitumor and antiangiogenic activi-
ties of AG3340, a potent and selective MMP
inhibitor undergoing advanced oncology cli-
nical trials. Acad. N. Y. Sci. 1999, 878, 236-
-269.
24. Leff R.: Clinical trials of a stromelysin inhibi-
tor. Ann. N. Y. Sci. 1999, 878, 201-207.
25. Selzer M.G., Zhu B., Block N.L., Lokeshwar
B.L.: CMT-3, a chemically modified tetracyc-
line, inhibits bony metastases and delays the
development of paraplegia in a rat model of
prostate cancer. Ann. N. Y. Acad. Sci. 1999,
878, 678-688.
26. Karakiulakis G., Missirlis E., Maragoudakis
M.E.: Basement membrane collagen-degra-
ding activity from a malignant tumor is inhibi-
ted by anthracycline antibiotics. Biochim. Bio-
phys. Acta 1990, 1035, 218-222.
27. Ogita T., Sato A., Enokita R. i wsp.: Matlysta-
tins, new inhibitors of type IV collagenases
from Actinomadura atramentaria. Taxono-
my, fermentation, isolation and physico-che-
mical properties of matlystatin-group com-
pounds. J. Antibiot. 1992, 45, 1723-1732.
28. Mallya S.K., VanWart H.E.: Mechanism of in-
hibition of human neutrophil collagenase by
gold(I) chrysotherapeutic compounds. Inter-
action at a heavy metal binding site. J. Biol.
Chem. 1989, 264, 1594-1601.
29. Wauters P., Eeckhout Y., Vaes G.: Oxidation
products are responsible for the resistance to
the action of collagenase conffered on col-
lagen by catechin. Biochem. Pharmacol.
1986, 35, 2971-2973.
30. Nagase H.: Activation mechanisms of matrix
metalloproteinases. Biol. Chem. 1997, 378,
151-160.
31. Pinedo H.: Clinical anti-angiogenic treatment:
a change of mind. International Meeting on
Angiogenesis, Amsterdam 2000, 36-37.
Adres do korespondencji:
Dr n. med. Krzysztof Ko³omecki
Klinika Chirurgii Endokrynologicznej
i Ogólnej AM
S.S. im. M. Kopernika
ul. Pabianicka 62
93-513 £ód
Praca wp³ynê³a do Redakcji: 7.05.2000 r.
nia wi¹zania chelatowego miêdzy atomem C11 i C12 we
fragmencie cz¹steczki nieodpowiadaj¹cym za dzia³anie
antybakteryjne a centrum aktywnym MMPs. Tetracykliny
wp³ywaj¹ równie¿ na hamowanie funkcji mRNA w³aci-
wego dla MMP-1, MMP-2, MMP-3, MMP-8 (4, 5, 25).
Antybiotyki antracyklinowe (daunorubicyna, doksorubi-
cyna, epirubicyna) wykazuj¹ hamuj¹cy wp³yw na aktywnoæ
MMPs degraduj¹cych typ IV kolagenu i przez to dzia³aj¹
ochronnie na b³onê podstawn¹ naczyñ krwiononych (30).
Podobne dzia³anie wykazuj¹ tzw. matlystatyny, produ-
kowane przez szczepy Actinomadura atramentaria. Syn-
tetyczna pochodna zmodyfikowanej matlystatyny wyka-
za³a hamuj¹ce w³aciwoci na aktywnoæ MMP-9.
Szczepy Streptomyces wytwarzaj¹ nikotynaminê, hamuj¹-
c¹ aktywnoæ MMP-2 (5, 26, 27).
Sole z³ota, stosowane w leczeniu reumatycznego za-
palenia stawów, choroby równie¿ zwi¹zanej z nadczynno-
ci¹ MMPs, powoduj¹ zahamowanie aktywnoci MMPs
przez przy³¹czenie atomu z³ota do miejsca, w którym wy-
stêpuje atom cynku (28).
Inn¹ mo¿liwoci¹ hamowania MMPs jest blokowanie
miejsca rozszczepienia substratu przez MMP. Przyk³adem
tak dzia³aj¹cego zwi¹zku jest katechina (pochodna polife-
nolowa) (29). Tylko nieliczne z wymienionych zwi¹zków
chemicznych s¹ w trakcie prób klinicznych.
Spowodowanie obni¿enia funkcji kilku MMPs mo¿e
wywo³aæ obni¿enie poziomu innych aktywnych postaci
MMPs, poniewa¿ wiele MMP jest aktywowanych przez
inne, np. MMP-2 proMMP-13, MMP-3 proMMP-1,
MMP-7 proMMP-9, MMP-3 proMMP-9 (30).
Wydaje siê, ¿e zastosowanie inhibitorów MMPs w le-
czeniu chorych z nowotworami z³oliwymi mo¿e powo-
dowaæ nie tyle zmniejszenie masy guza, co zahamowanie
jego dalszego wzrostu i powstawanie przerzutów. Leki te
powinny byæ stosowane wraz z innymi, klasycznymi
cytostatykami, tym bardziej ¿e preparaty hamuj¹ce angio-
genezê znacznie zwiêkszaj¹ wra¿liwoæ komórek guza na
cytostatyki. Istnieje jednak niebezpieczeñstwo sumowania
siê dzia³añ toksycznych tych leków (5, 31).
Wyszukiwarka
Podobne podstrony:
Złożone konstrukcje metalowe
Konstrukcje metalowe egzamin1
Konstrukcje metalowe 1 Przyklad 8 Polaczenia srubowe
D semestr 5 konstrukcje metalowe wstępny Model (2
7 wyklad konstrukcji metalowych
Sprawko badanie twardosci, Studia, WIP PW, I rok, MATERIAŁY METALOWE I CERAMICZNE, SPRAWOZDANIA
sciaga egzam ULA, Studia, Konstrukcje metalowe I, Egzamin
CERAMIKA, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo
Konstrukcje metalowe - Tematy zajęć, Budownictwo S1, Semestr IV, Konstrukcje metalowe, Labolatorium
s1, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo
biegus, konstrukcje metalowe podstawy, Długości wyboczeniowe prętów
biegus, konstrukcje metalowe podstawy, Słupy złożone
instrukcja bhp czyszczenia mycia i dezynfekcji metalowych opakowan zwrotnych
Projekt konstrukcje metalowe
Konstrukcje Metalowe Danka Witczak
więcej podobnych podstron