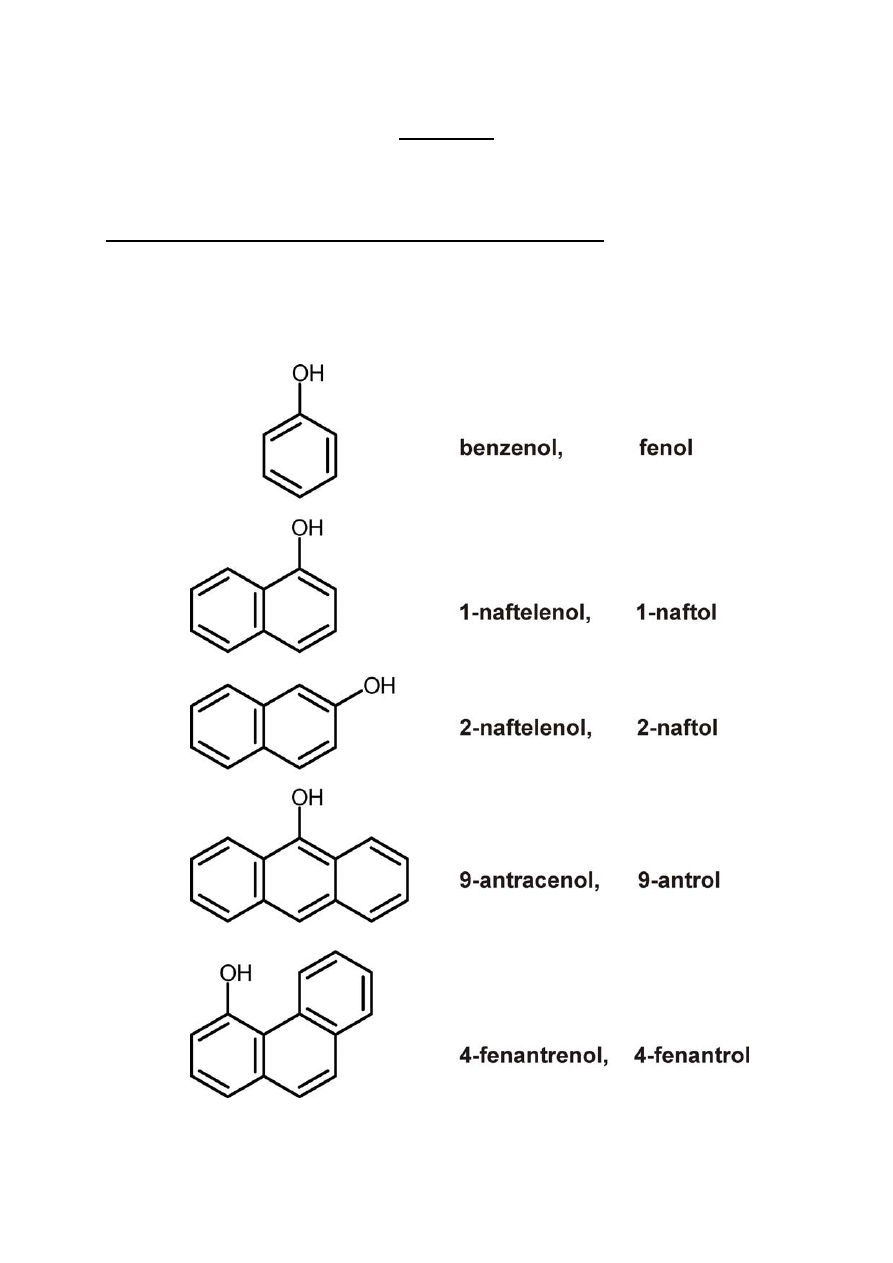
FENOLE
Dzielimy na jedno‐, dwu‐, trój‐ i wielowodorotlenowe.
Nazewnictwo fenoli jednowodorotlenowych
Nazwa macierzystego węglowodoru + ol
(częściej jednak używa się nazw zwyczajowych)
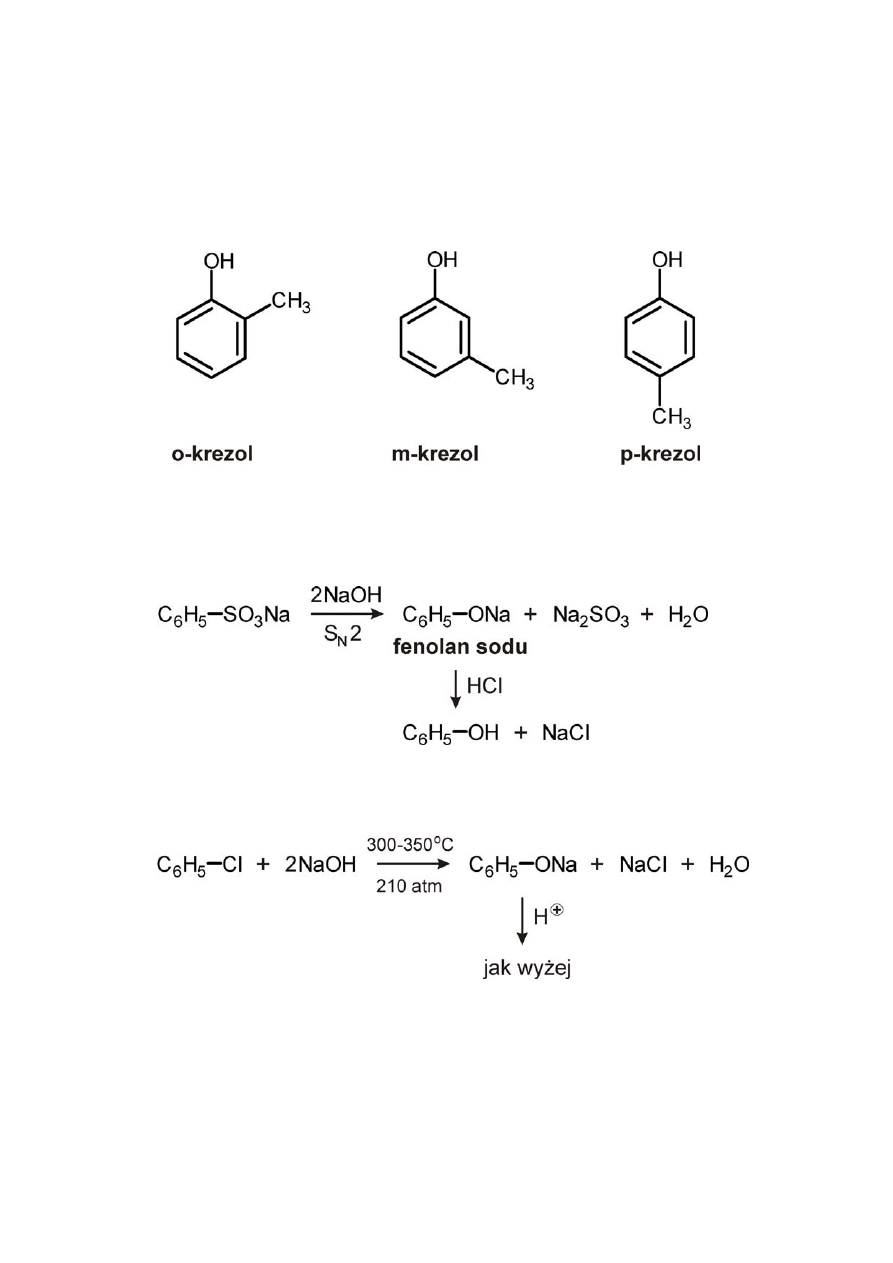
Metody otrzymywania fenolu:
I) fenol i jego pochodne, krezole, otrzymuje się ze smoły węgla
kamiennego na drodze destylacji
II) w przemyśle – na drodze hydrolizy
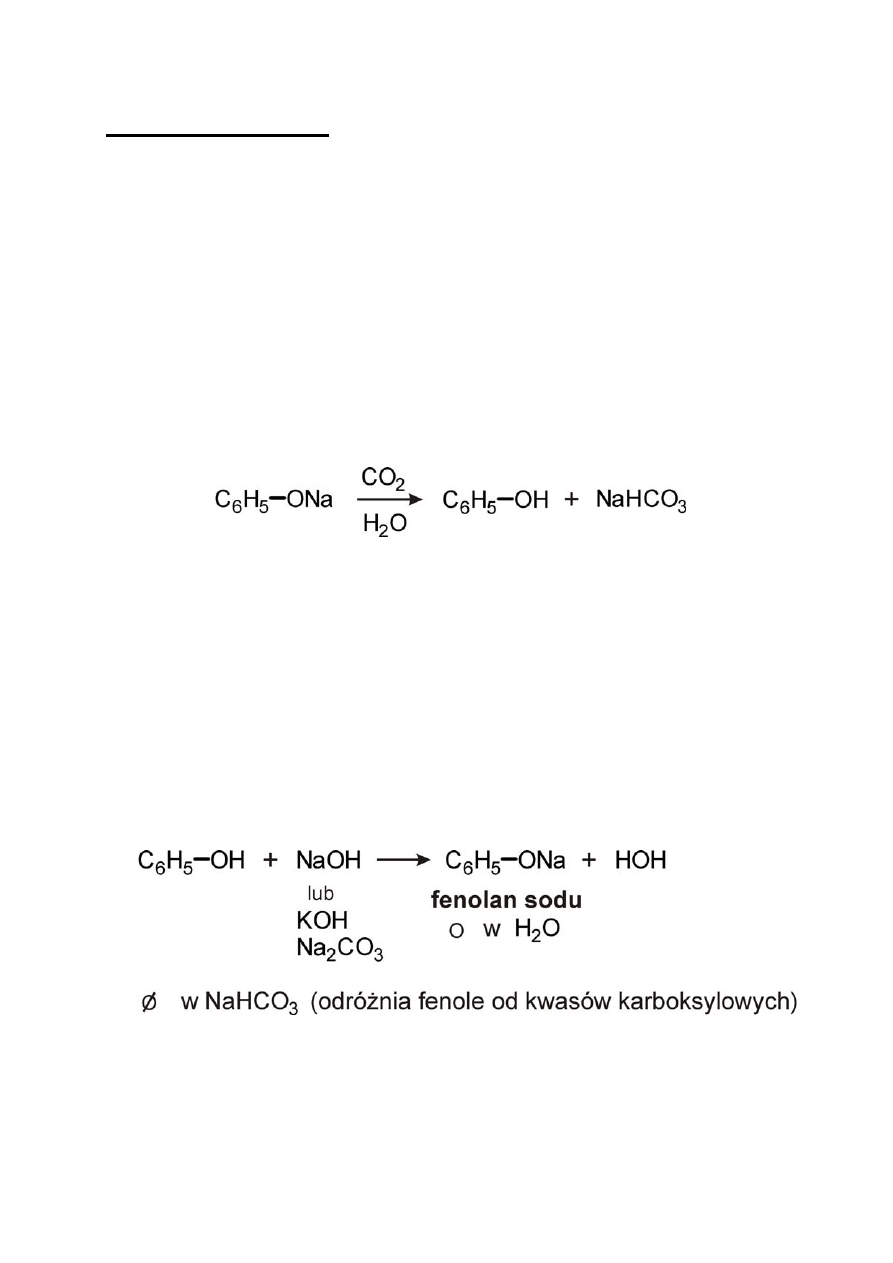
a) stapianie benzenosulfonianu sodu z NaOH
b) hydroliza chlorobenzenu
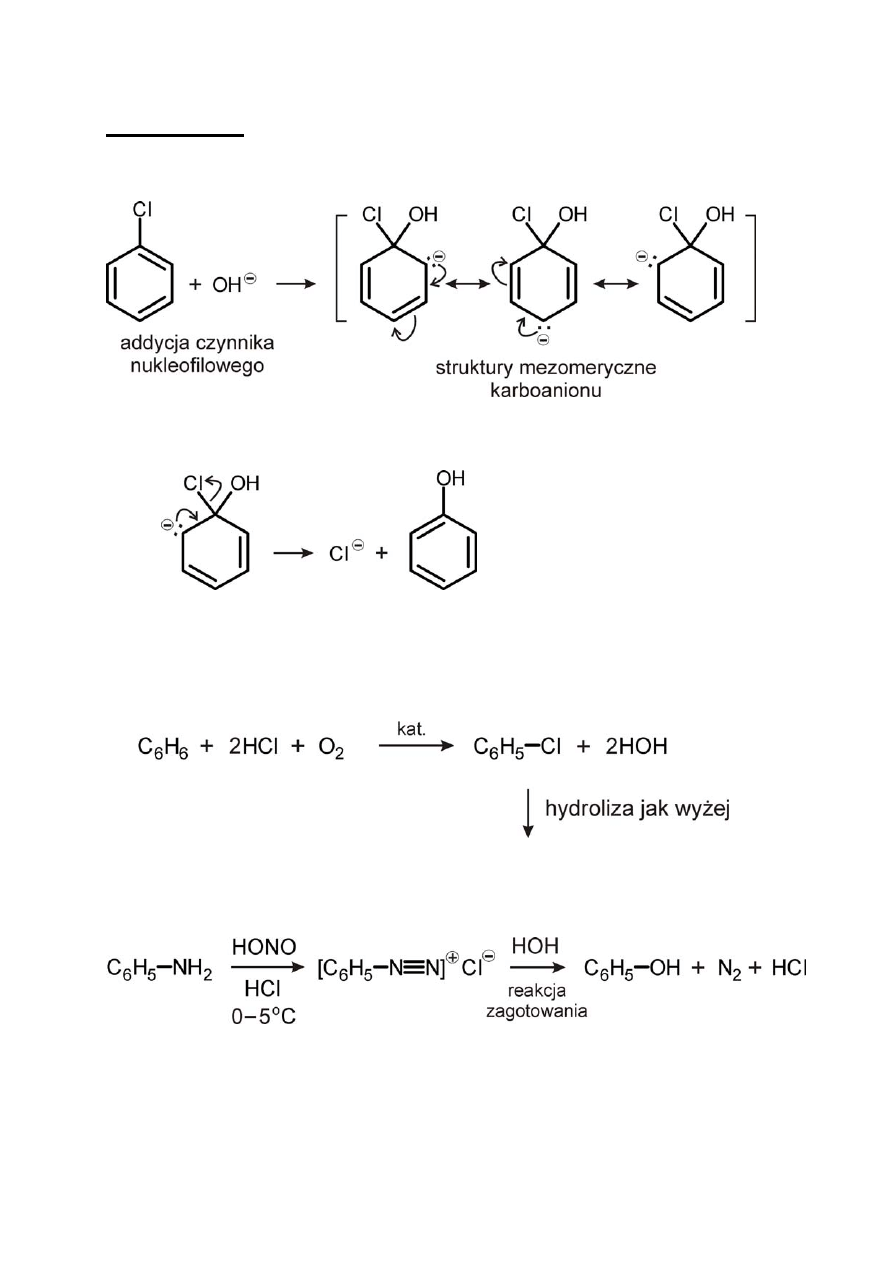
Mechanizm:
Etap 1
Etap 2
3) metoda Raschiga
– katalityczne chlorowanie benzenu w obecności tlenu
4) z I‐rzędowych amin aromatycznych
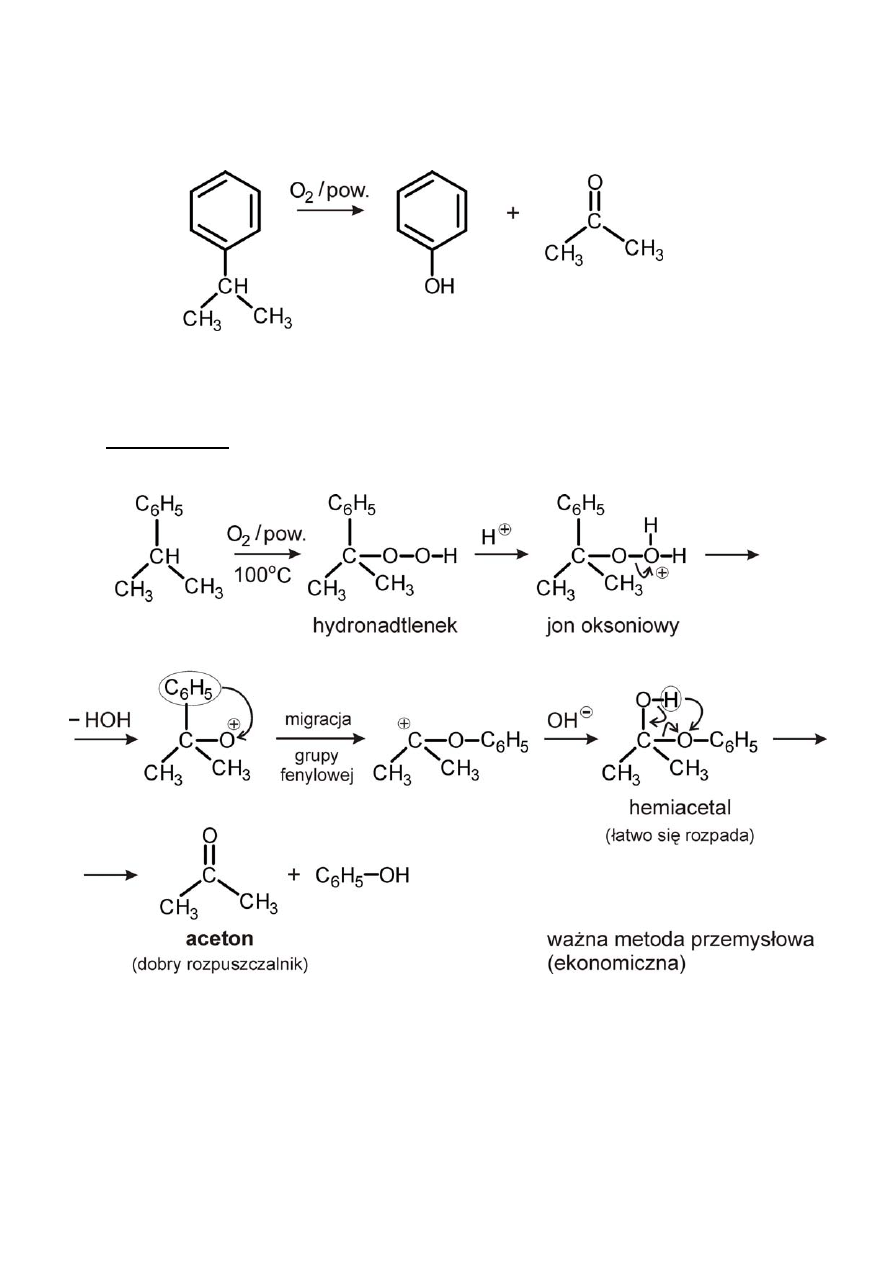
5) z izopropylobenzenu
Reakcja nie prowadzi do kwasu benzoesowego, a powinna.
Mechanizm:
Właściwości fenolu:
– substancja bezbarwna stała, różowieje, ciemnieje na
powietrzu,
– jest podatny na działanie czynników utleniających,
– z wodą miesza się w ograniczonym stopniu,
– jego rozpuszczalność wzrasta ze wzrostem temperatury
(w temp. 65˚C miesza się z H
2
O bez ograniczeń),
– posiada właściwości słabego kwasu (silniejszy od alkoholi,
słabszy niż kwas octowy).
Właściwości chemiczne fenolu:
I) W reakcji uczestniczy grupa OH.
II) W reakcji następuje podstawienie w pierścieniu
fenylowym.
Ad I
1) Reakcja tworzenia soli

2) Reakcje tworzenia eterów
3) Reakcje tworzenia estrów
4) Reakcje z P
2
S
5
5) Redukcja fenolu
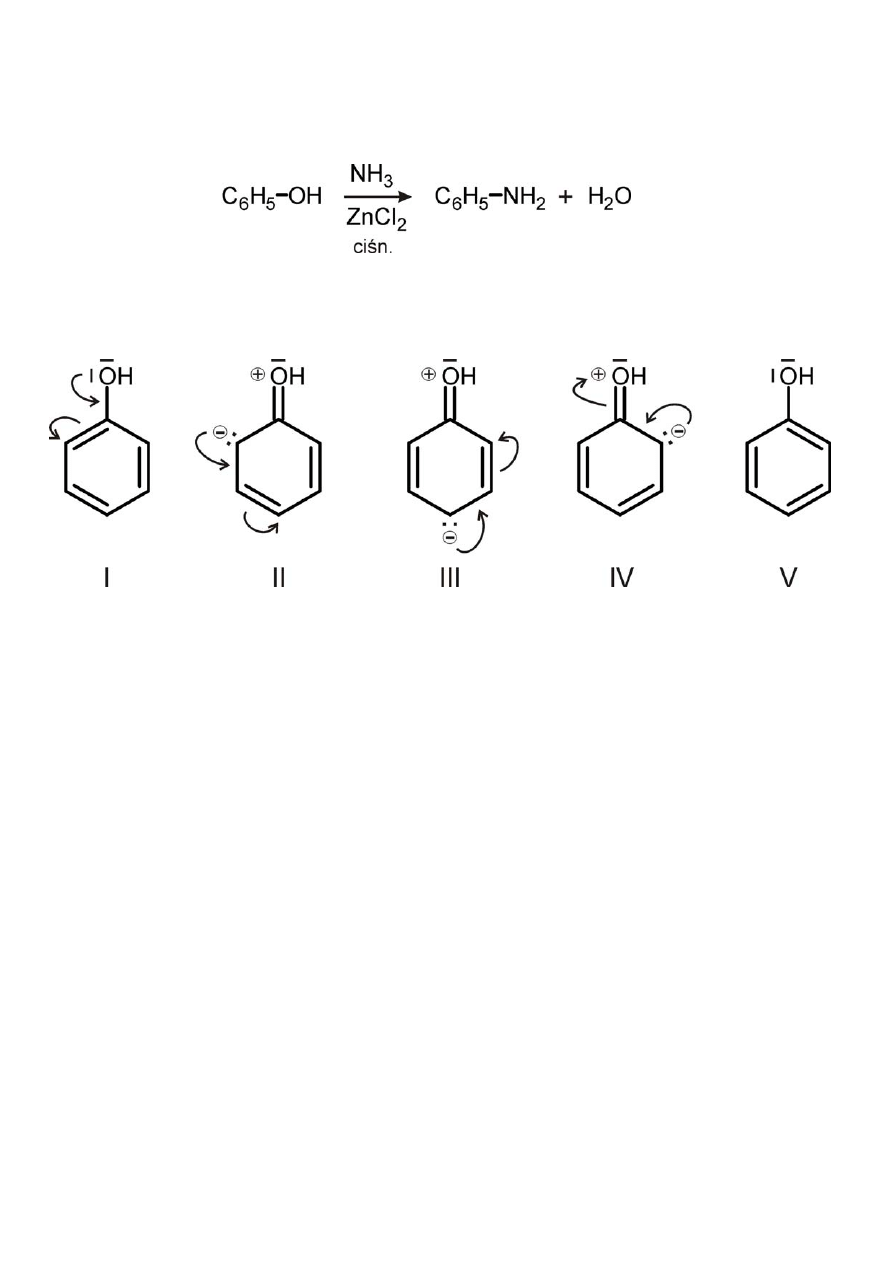
6) Reakcja z amoniakiem
Ad II. Reakcje podstawienia w pierścieniu fenylowym
W pierścieniu pozycje orto i para są wzbogacone w ładunek
elektronowy. Tym samym pozycje te łatwiej ulegają substytucji
elektrofilowej.
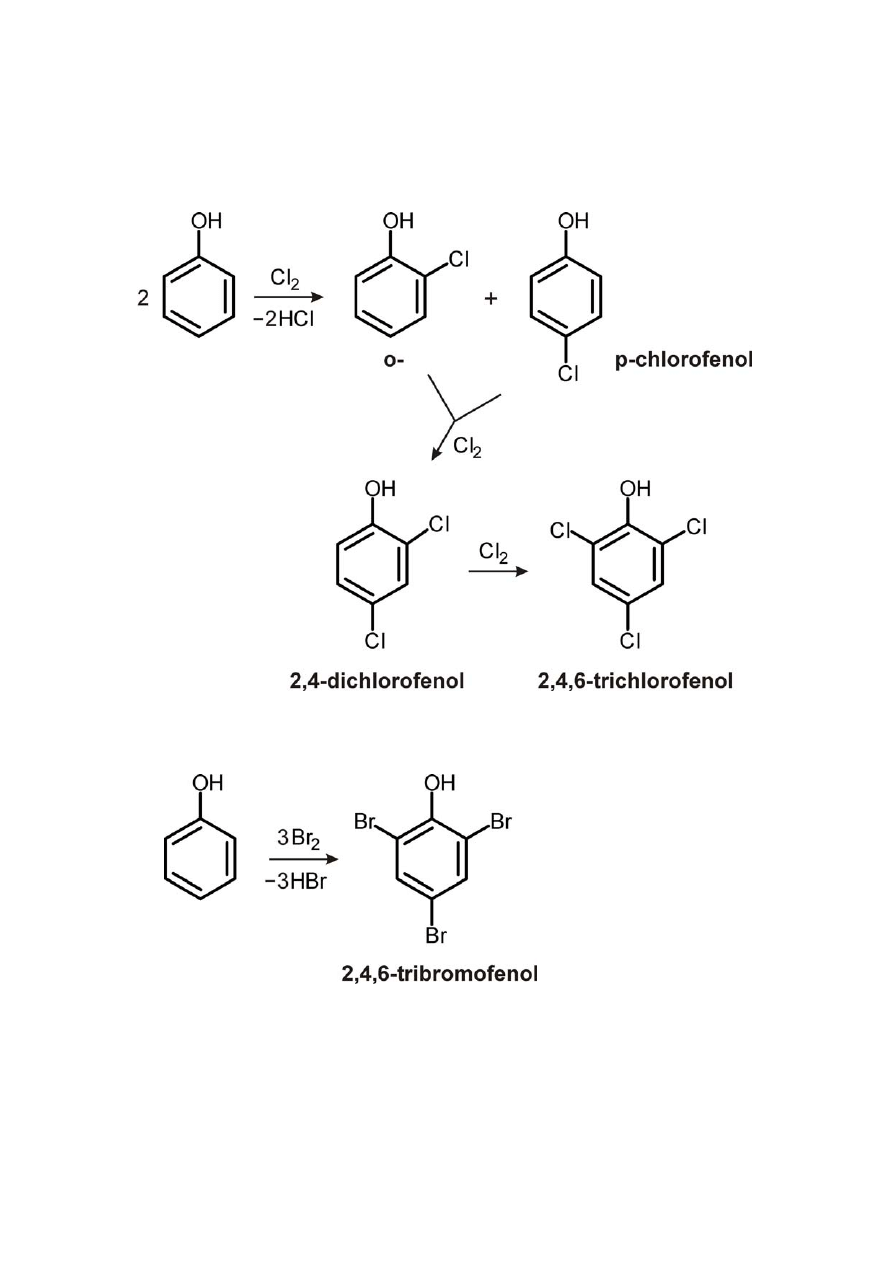
1) Reakcje fluorowcowania
a) reakcja chlorowania
b) reakcja bromowania
Reakcja jest wykorzystywana w analizie ilościowej. Tak samo
reaguje anilina, C
6
H
5
–NH
2
.
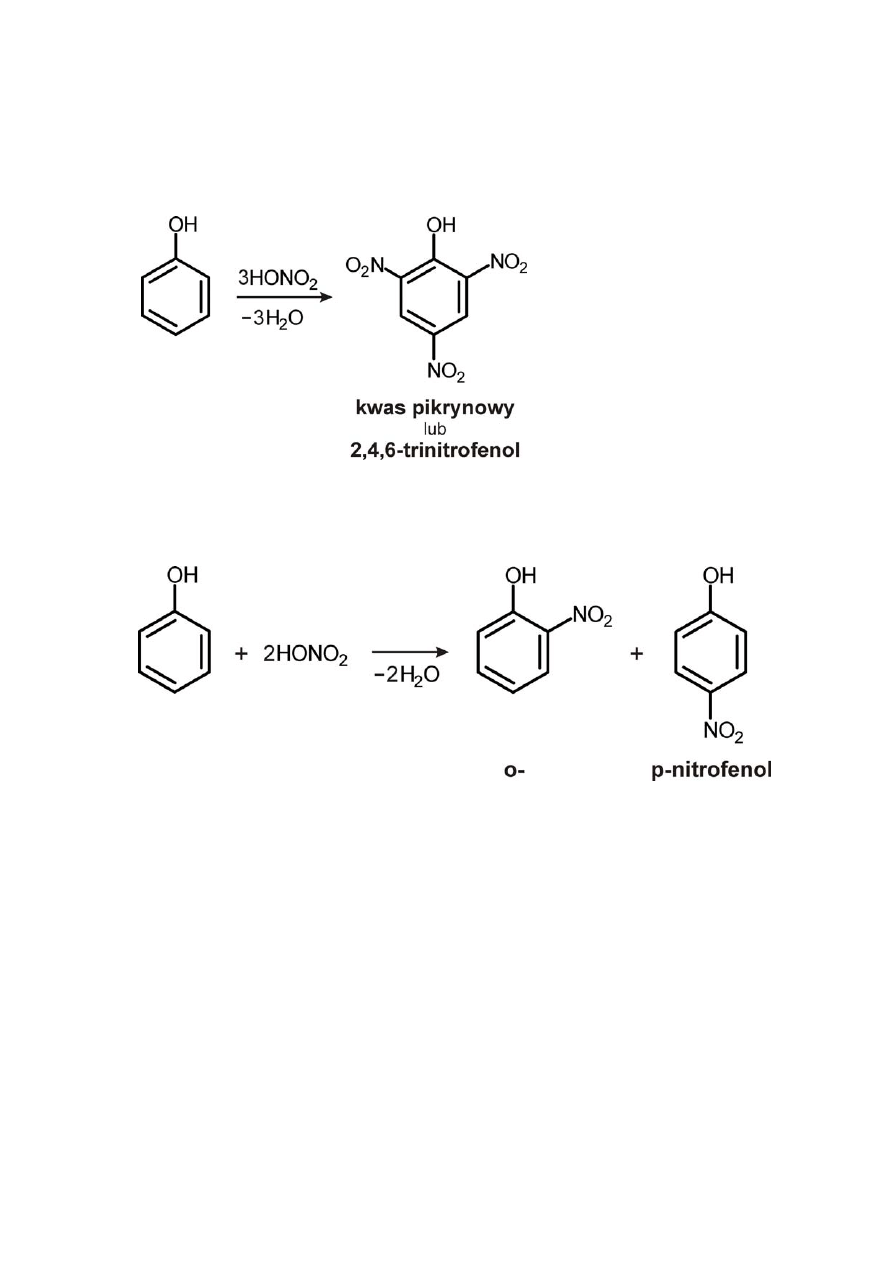
2) Reakcja nitrowania
a) za pomocą stęż. HONO
2
b) za pomocą rozc. HONO
2
(nitrozowanie, połączone z reakcją
utlenienia)
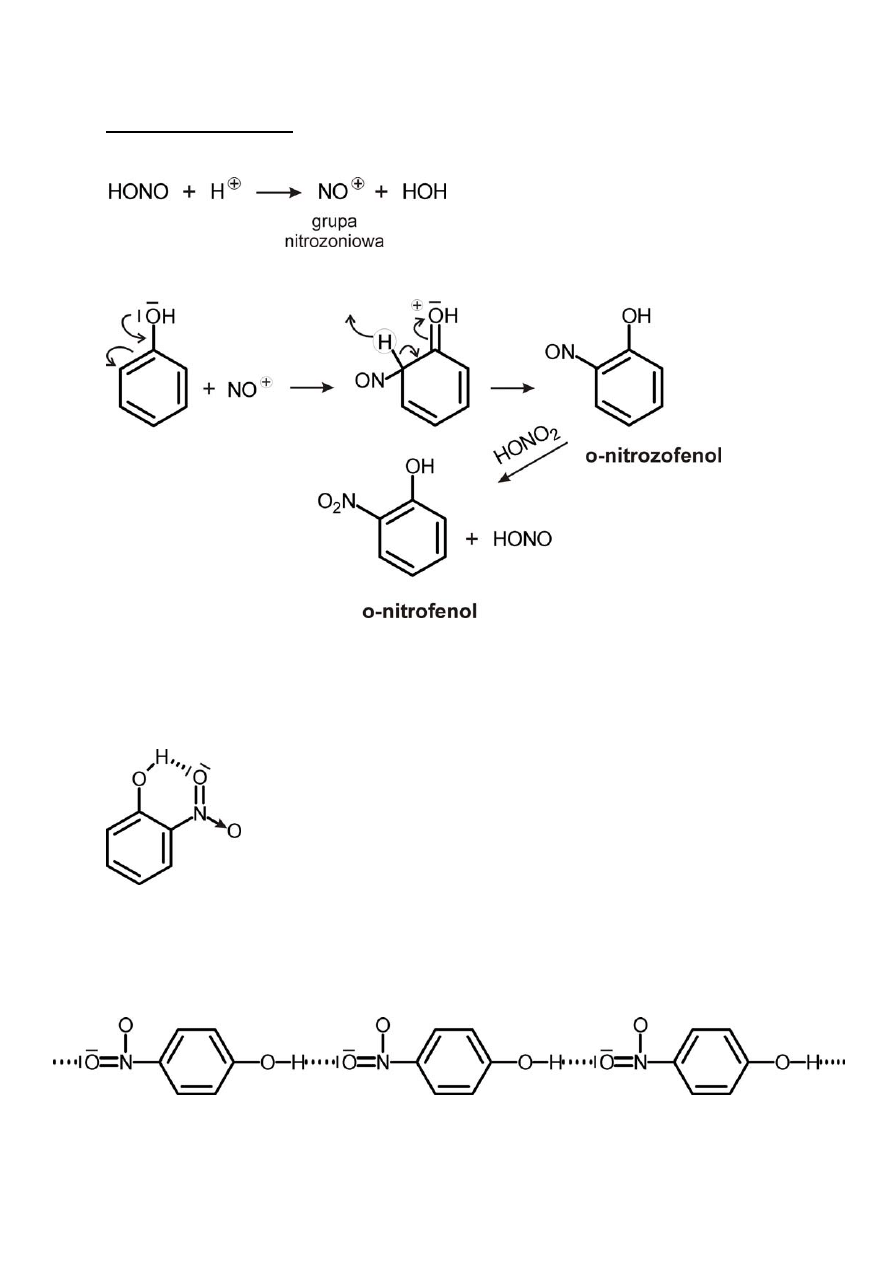
Mechanizm reakcji
Izomery o‐ i p‐nitrofenolu rozdzielamy na drodze destylacji z parą
wodną (o‐nitrofenol).
lotny z parą wodną ‐ żółty,
posiada postać monomeryczną z uwagi na zjawisko
chelacji – tworzenia się wewnątrzcząsteczkowego
wiązania wodorowego
bezbarwny izomer para, nielotny z uwagi na asocjację
międzycząsteczkową
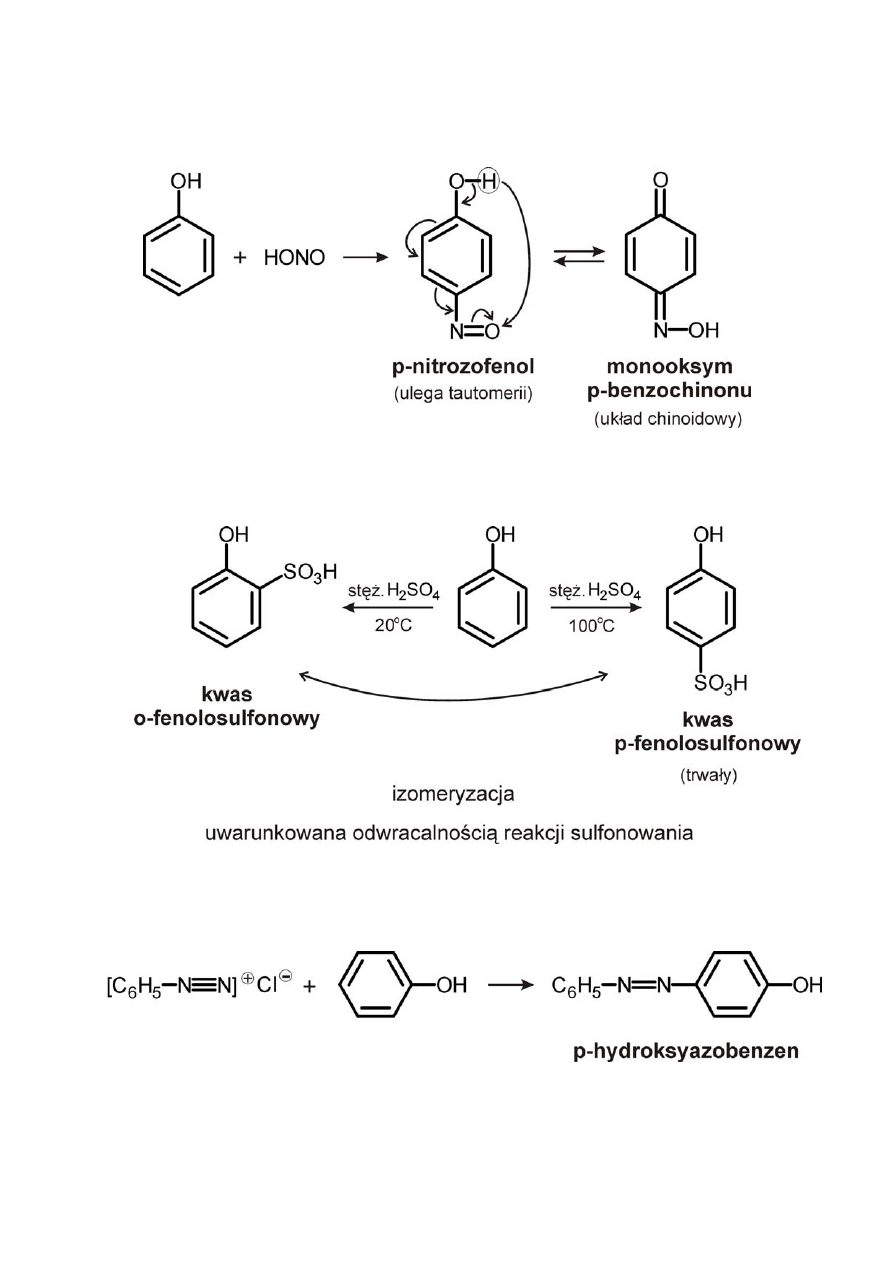
3) Reakcja nitrozowania fenolu
4) Reakcje sulfonowania
5) Reakcje sprzężenia z solami diazoniowymi
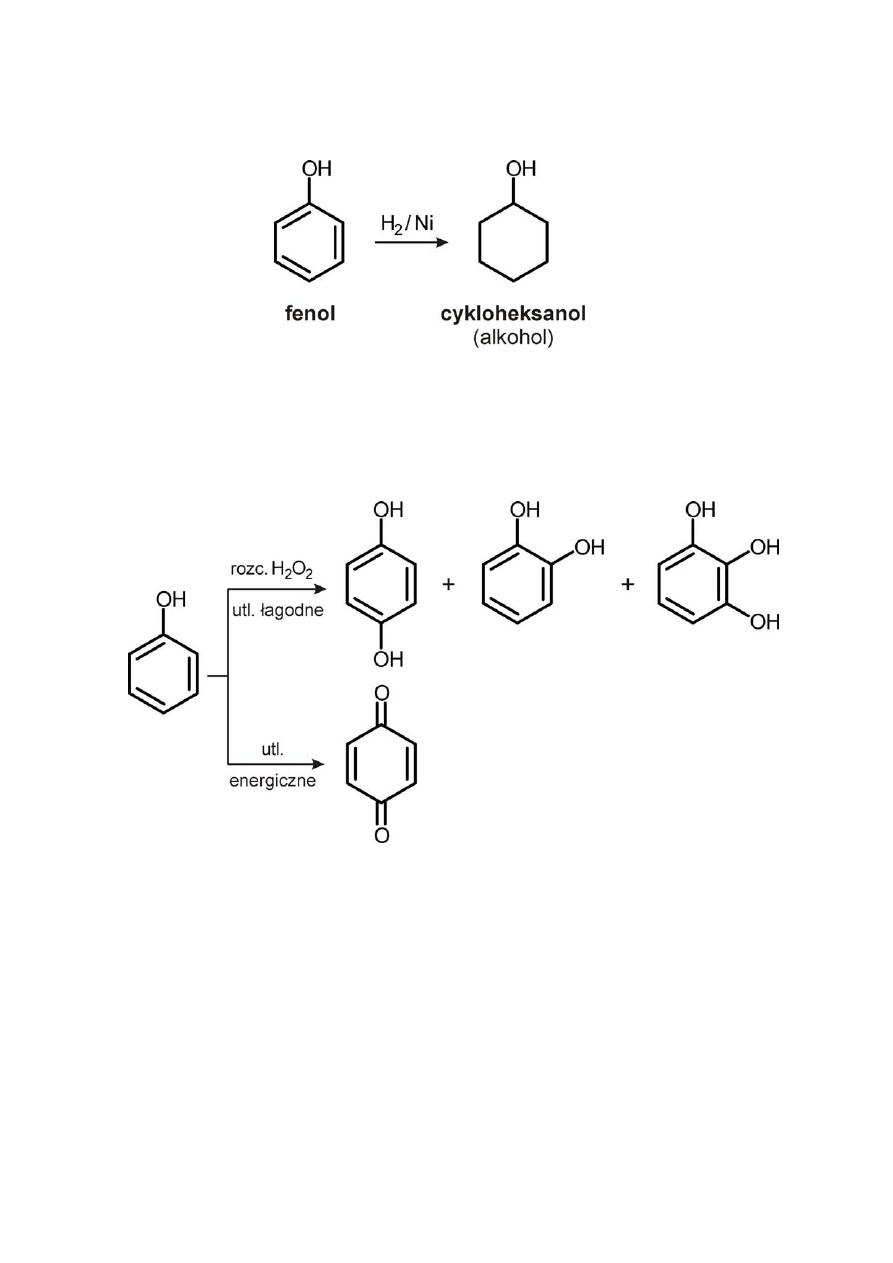
6) Redukcja katalityczna fenolu
7) Utlenianie fenoli
a) łagodne ‐ rozcieńczonym H
2
O
2
b) energiczne ‐ prowadzące do rozkładu fenolu
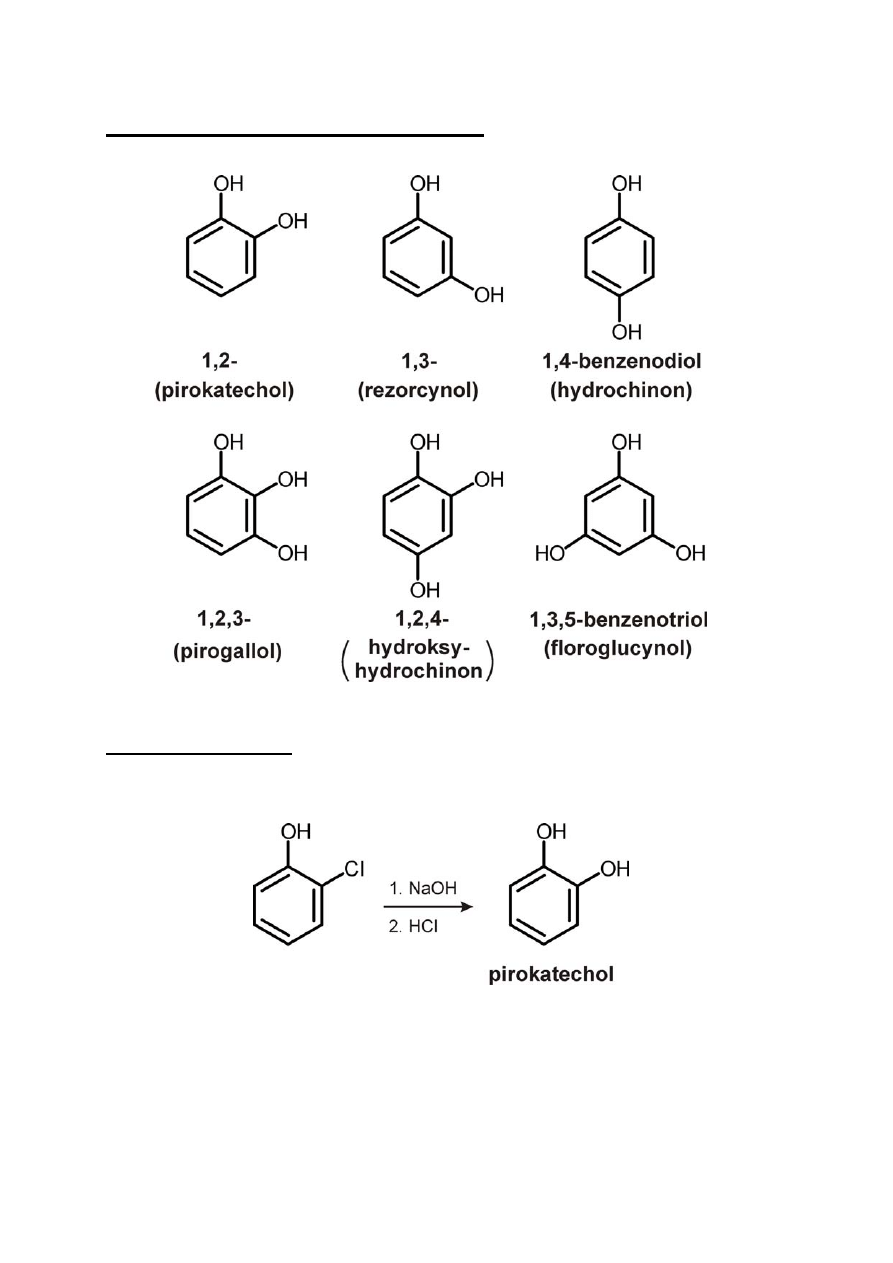
Fenole dwu‐ i trójwodorotlenowe
Przykłady syntez
1) Hydroliza o‐chlorofenolu
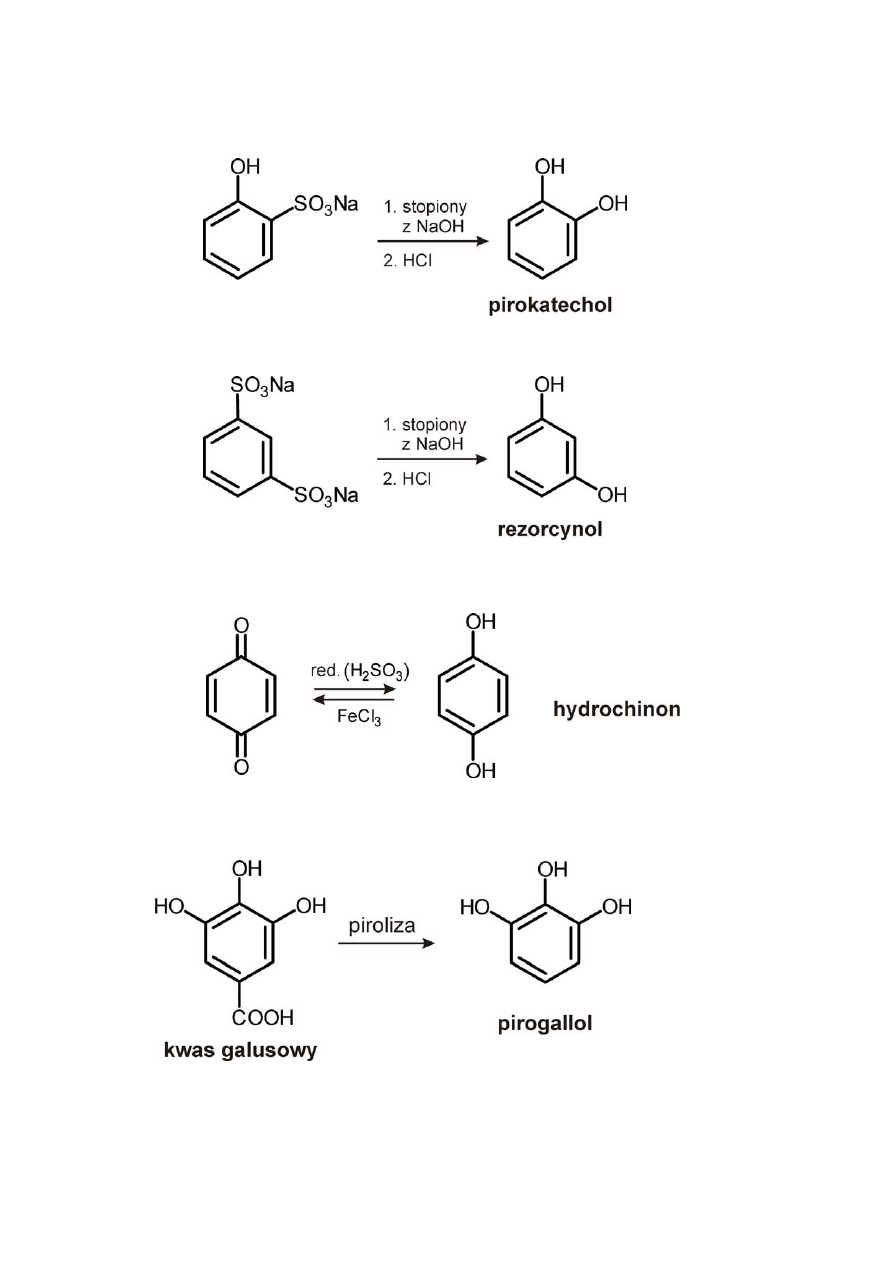
2) Stapianie kwasu o‐fenolosulfonowego z NaOH
3)
4)
5)
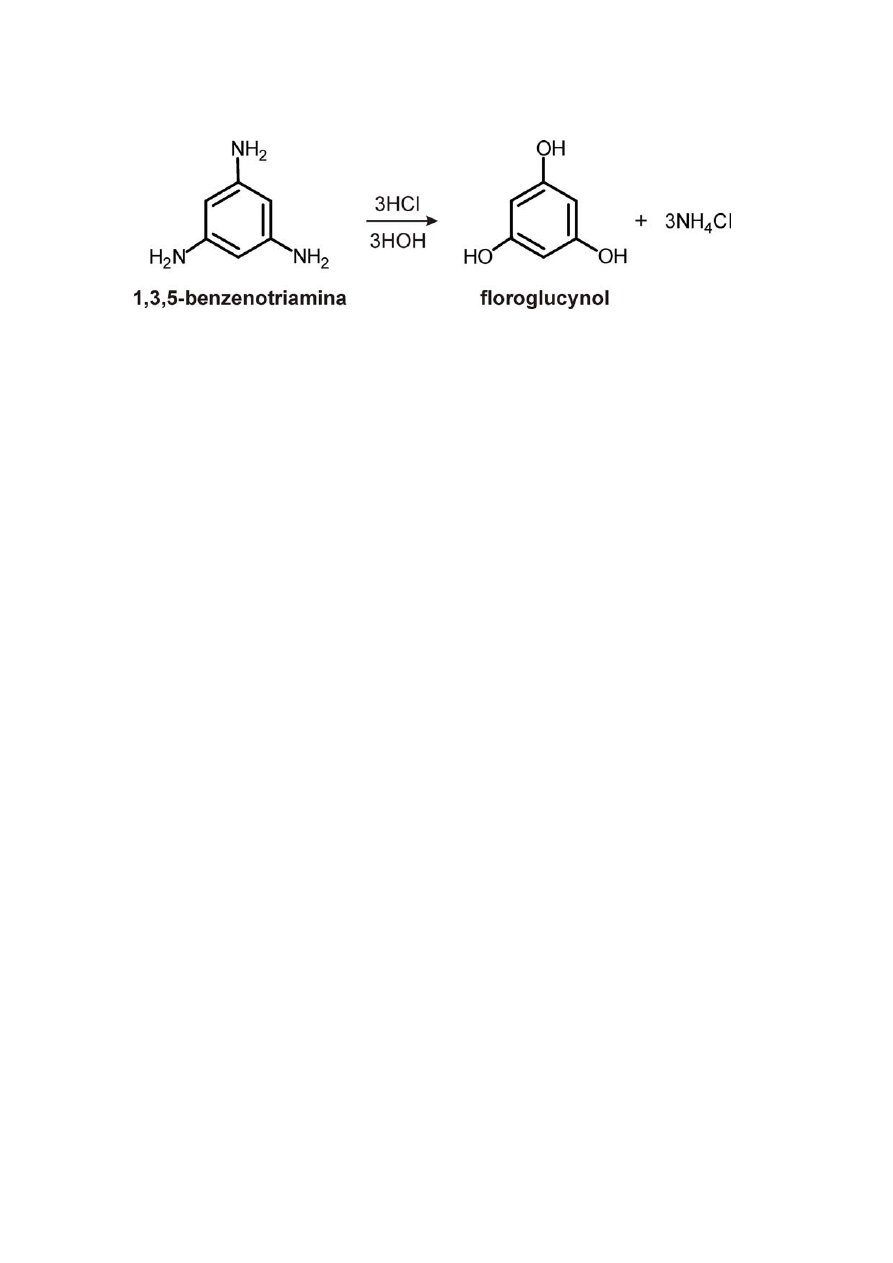
6)
Wyszukiwarka
Podobne podstrony:
do zrobienia 2012 wrzesień, IV rok, IV rok CM UMK, Patomorfologia, giełdy 2015, Giełdy do zrobienia
egz fizjologia 2012, Fizjoterapia CM UMK, Fizjologia
terminy zajęć wg. kolejności grup 2011-2012, IV rok Lekarski CM UMK, Dermatologia, Gablota, Sekretar
fizjologia 2012 egzamin fizjoterapii, Dietetyka CM UMK, Fizjologia
Histologia poprawa, II rok, II rok CM UMK, Giełdy, 2 rok, giełdy 2 rok zima 2012, histologia - giełd
Fizjologia-Egzamin 2012, Dietetyka CM UMK, Fizjologia
egzamin farmacja 2012, Fizjoterapia CM UMK, Fizjologia
Histologia szczegolowa, II rok, II rok CM UMK, Giełdy, 2 rok, giełdy 2 rok zima 2012, histologia - g
Histologia 2000 - 2007(1), II rok, II rok CM UMK, Giełdy, 2 rok, giełdy 2 rok zima 2012, histologia
gielda farma test luty 2012, IV rok, IV rok CM UMK, Farmakologia, 2014-15, Nowy folder, FARMA GIEŁDY
Patomorfologia 2012, IV rok Lekarski CM UMK, Patomorfologia, Pat.Egzamin!!!Nasze zebrane!!!WSKAZÓWKI
Histologia szczegółowa, II rok, II rok CM UMK, Giełdy, 2 rok, giełdy 2 rok zima 2012, histologia - g
test farmacja 2012, Łacina Farmacja CM UMK
histologia- egz. cząstkowy, II rok, II rok CM UMK, Giełdy, 2 rok, giełdy 2 rok zima 2012, histologia
więcej podobnych podstron