Strona 1
5.5. Mieszanie roztworów
2011-05-02 12:49:20
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/96-mieszanie-roztworow.html?tmpl=component&print=1&p...
Ocena u
ż
ytkowników:
/ 1
Słaby
Ś
wietny
Oce
ń
5.5. Mieszanie roztworów
Zobacz odpowiedzi
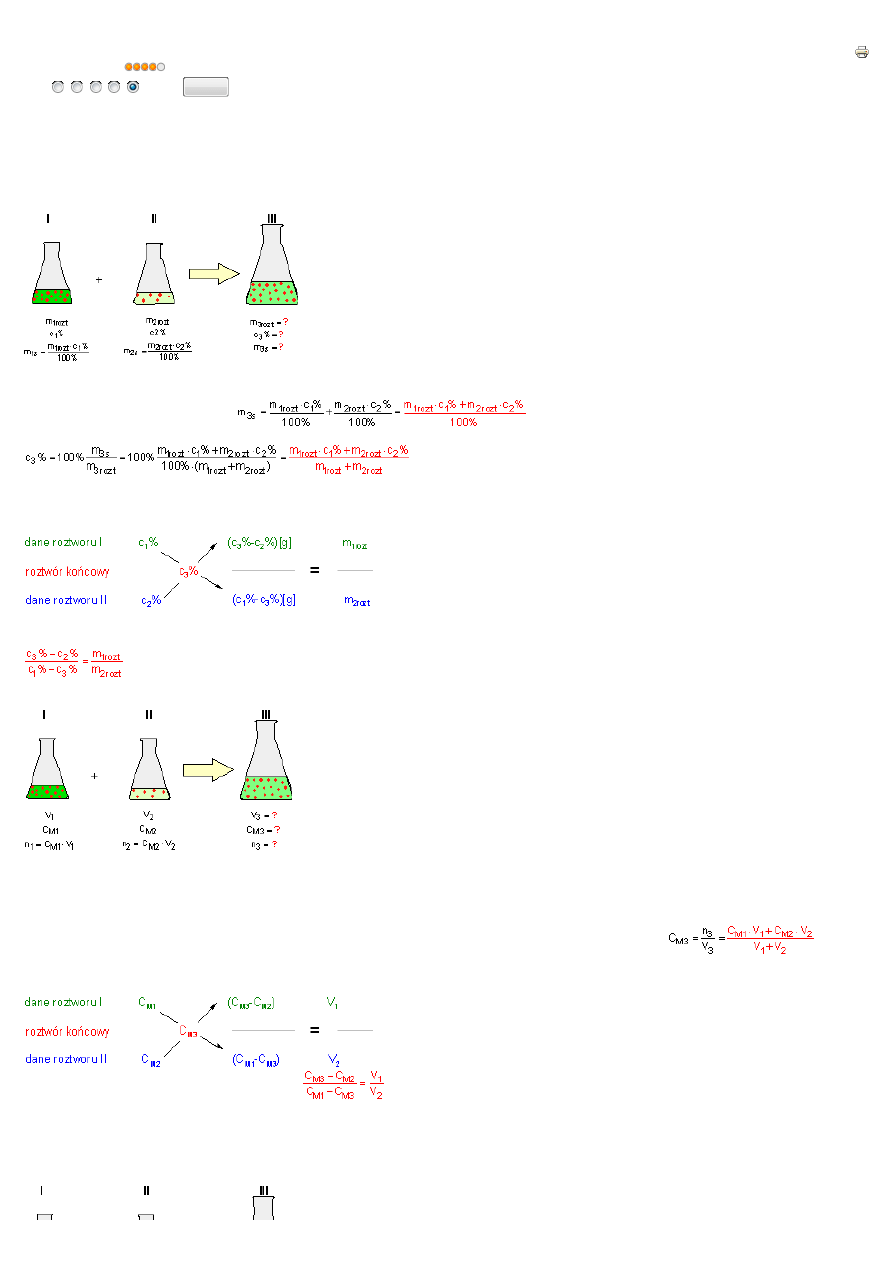
Mieszanie roztworów o znanym st
ęż
eniu procentowym obliczanie st
ęż
enia roztworu ko
ń
cowego
Wyobra
ź
my sobie,
ż
e mieszamy ze sob
ą
roztwór I z roztworem II. W wyniku zmieszania tych roztworów uzyskujemy roztwór III (roztwór ko
ń
cowy). Oczywi
ś
cie masa roztworu III jest
sum
ą
masy roztworu I i roztworu II:
m
3rozt
=m
1rozt
+m
2rozt
. Masa substancji rozpuszczonej w III roztworze równa jest sumie masy substancji zawartej w I roztworze i masy substancji
zawartej w II roztworze: m
3s
=m
1s
+m
2s
, czyli:
Maj
ą
c mas
ę
substancji w III roztworze, oraz jego mas
ę
łatwo obliczy
ć
st
ęż
enie procentowe tego roztworu:
II sposób
St
ęż
enie procentowe w roztworze ko
ń
cowym (III) mo
ż
na obliczy
ć
korzystaj
ą
c z metody krzy
ż
owej. W metodzie tej st
ęż
enia roztworów zapisuje si
ę
w nast
ę
puj
ą
cy sposób (c
1
%
>c
2
%):
Krzy
ż
st
ęż
e
ń
odczytujemy w nast
ę
puj
ą
cy sposób:
Roztwór o st
ęż
eniu c
3
% powstaje w wyniku zmieszania ze sob
ą
(c
3
%-c
2
%) g roztworu I i (c
1
%-c
3
%) g roztworu II. W krzy
ż
u st
ęż
e
ń
widoczna jest nast
ę
puj
ą
ca proporcja:
. Rozwi
ą
zuj
ą
c t
ę
proporcj
ę
(wymna
ż
amy na krzy
ż
) łatwo wyliczymy poszukiwane st
ęż
enie c
3
%.
Mieszanie roztworów o znanym st
ęż
eniu molowym, obliczanie st
ęż
enia roztworu ko
ń
cowego
Po zmieszaniu roztworu I o obj
ę
to
ś
ci V
1
z roztworem II o obj
ę
to
ś
ci V
2
otrzymamy roztwór III (ko
ń
cowy). Je
ż
eli st
ę
zenia C
M1
i C
M2
nie s
ą
zbyt du
ż
e, to obj
ę
to
ść
roztworu III jest
sum
ą
obj
ę
to
ś
ci roztworu I i roztworu II:
V
3
=V
1
+V
2
(je
ż
eli ta równo
ść
nie jest spełniona, to obj
ę
to
ść
ko
ń
cowa musi by
ć
podana). W roztworze I znajduje si
ę
n
1
=C
M1
.
V
1
moli
substancji rozpuszczonej, a w roztworze II n
2
=C
M2
.
V
2
moli tej substancji. Oczywi
ś
cie po zmieszaniu tych roztworów cała ilo
ść
substancji rozpuszczonej znajdzie si
ę
w roztworze III
(substancja rozpuszczona pochodzi jedynie z roztworu I i roztworu II): n
3
=n
1
+n
2
=
C
M1
.
V
1
+C
M2
.
V
2
. St
ęż
enie molowe III roztworu wynosi:
II sposób
W metodzie krzy
ż
owej (C
M1
>C
M2
) st
ęż
enia zapisujemy w nast
ę
puj
ą
cy sposób:
Dla krzy
ż
a st
ęż
e
ń
mo
ż
emy zapisa
ć
nast
ę
puj
ą
c
ą
proporcj
ę
:
(V
1
i V
2
musz
ą
by
ć
wyra
ż
one w tych samych jednostkach obj
ę
to
ś
ci). Po rozwi
ą
zaniu proporcji (po
pomno
ż
eniu na krzy
ż
) wyliczymy poszukiwane st
ęż
enie C
M3
.
Je
ż
eli st
ęż
enie jednego roztworu wyra
ż
one jest w procentach, a st
ęż
enie drugiego w
mol
/dm
3
, to wcze
ś
niej musimy przeliczy
ć
jedno z tych st
ęż
e
ń
, aby wyrazi
ć
je w tych samych
jednostkach.
Mieszanie roztworów w celu uzyskania roztworu o okre
ś
lonym st
ęż
eniu procentowym
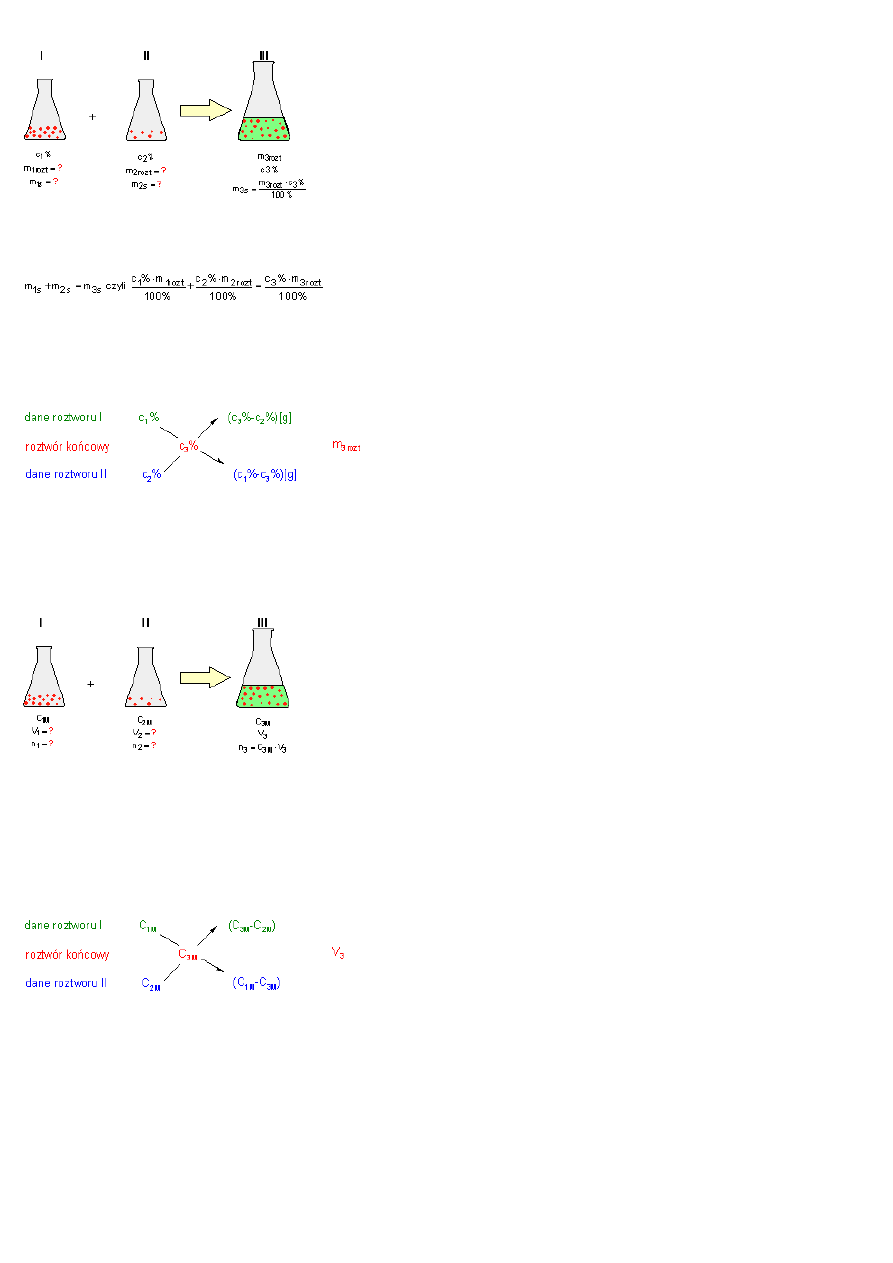
Strona 2
5.5. Mieszanie roztworów
2011-05-02 12:49:20
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/96-mieszanie-roztworow.html?tmpl=component&print=1&p...
Wyobra
ź
my sobie,
ż
e mieszamy dwa roztworu I i II o znanych st
ęż
eniach. W wyniku tego otrzymujemy roztwór III o st
ęż
eniu c
3
% i masie m
3rozt
. Wiadomo,
ż
e masa III roztworu
musi by
ć
równa sumie mas roztworu I i roztworu II:
m
1rozt
+m
2rozt
=m
3rozt
. W roztworze ko
ń
cowym (III) masa substancji rozpuszczonej równa jest m
3s
=c
3
%
.
m
3rozt
/100%. Ta masa
substancji pochodzi jedynie z roztworu I i roztworu II, czyli m
1s
=c
1
%
.
m
1rozt
/100% oraz m
2s
=c
2
%
.
m
2rozt
/100%, co mo
ż
na zapisa
ć
:
. Po pomno
ż
eniu stronami przez 100% otrzymamy:
c
1
%
.
m
1rozt
+ c
2
%
.
m
2rozt
= c
3
%
.
m
3rozt
. W efekcie otrzymali
ś
my
2 równania z dwiema niewiadomymi:
m
1rozt
+m
2rozt
=m
3rozt
c
1
%
.
m
1rozt
+ c
2
%
.
m
2rozt
= c
3
%
.
m
3rozt
Po rozwi
ą
zaniu układu równa
ń
otrzymamy mas
ę
roztworu I, oraz mas
ę
roztworu II jak
ą
nale
ż
y u
ż
y
ć
aby otrzyma
ć
okre
ś
lon
ą
ilo
ść
roztworu ko
ń
cowego o podanym st
ęż
eniu.
II sposób
Po odpowiednim zapisaniu danych mo
ż
emy skorzysta
ć
z metody krzy
ż
owej. W metodzie tej roztwór o wi
ę
kszym st
ęż
eniu oznacza si
ę
jako roztwór I:
Rozpisane dane czytamy w nast
ę
puj
ą
cy sposób: po zmieszaniu (C
3
%-C
2
%) g roztworu I z (c
1
%-c
3
%) g roztworu II otrzymamy (C
3
%-C
2
%)+(c
1
%-c
3
%), czyli (c
1
%- C
2
%) g
roztworu III o st
ęż
eniu c
3
%. Mo
ż
emy zatem zapisa
ć
proporcje:
(C
3
%-C
2
%) g roztworu I z roztworem II daje (c
1
%- C
2
%) g roztworu III, to
x g roztworu I z roztworem II da m
3rozt
g roztworu III.
Po rozwi
ą
zaniu proporcji otrzymamy mas
ę
roztworu I. Mas
ę
roztworu II otrzymamy jako ró
ż
nic
ę
: m
2rozt
=m
3rozt
-m
1rozt
.
Mieszanie roztworów w celu uzyskania roztworu o okre
ś
lonym st
ęż
eniu molowym
Jak
ą
obj
ę
to
ść
roztworu I i jak
ą
obj
ę
to
ść
roztworu II musimy zmiesza
ć
ze sob
ą
aby uzyska
ć
III roztwór o obj
ę
to
ś
ci V
3
i st
ęż
eniu C
3M
.
Wiadomo,
ż
e
V
1
+V
2
=V
3
. W III roztworze znajduje si
ę
n
3
=C
3M
.
V
3
moli substancji rozpuszczonej, która pochodzi z roztworu I i roztworu II: n
1
=C
1M
.
V
1
, n
2
=C
2M
.
V
2
, co mo
ż
emy
zapisa
ć
: C
3M
.
V
3
= C
1M
.
V
1
+C
2M
.
V
2
. Rozwi
ą
zuj
ą
c układ równa
ń
:
V
1
+V
2
=V
3
.
C
3M
.
V
3
= C
1M
.
V
1
+C
2M
.
V
2
obliczymy potrzebne obj
ę
to
ś
ci roztworu I i II.
II sposób
W metodzie krzy
ż
owej roztwór o wi
ę
kszym st
ęż
eniu oznacza si
ę
jako roztwór I. Dane zapisujemy w nast
ę
puj
ą
cy sposób:
W wyniku zmieszania (C
3M
-C
2M
) obj
ę
to
ś
ci I roztworu z (C
1M
-C
3M
) obj
ę
to
ś
ci II roztworu otrzymujemy:
C
3M
-C
2M
+ C
1M
-C
3M
= C
1M
-C
2M
obj
ę
to
ś
ci III roztworu, co mo
ż
emy zapisa
ć
w postaci proporcji:
W wyniku zmieszania (C
3M
-C
2M
) obj
ę
to
ś
ci I otrzymujemy C
1M
-C
2M
obj
ę
to
ś
ci III roztworu, to
zmieszanie V
1
obj
ę
to
ś
ci I roztworu da nam V
3
obj
ę
to
ś
ci III roztworu.
Z proporcji łatwo obliczymy V
1
, a z zle
ż
no
ś
ci V
2
=V
3
-V
1
obliczymy potrzebn
ą
obj
ę
to
ść
II roztworu.
5.5-1.
W jakim stosunku wagowym nale
ż
y zmiesza
ć
80% kwas siarkowy z 20% kwasem siarkowym, aby otrzyma
ć
roztwór 30%?
5.5-2.
W jakim stosunku obj
ę
to
ś
ciowym nale
ż
y zmiesza
ć
roztwór 5-molowy z roztworem 1
‑
molowym, aby otrzyma
ć
roztwór 2-molowy
5.5-3.
W jakim stosunku wagowym nale
ż
y zmiesza
ć
36% kwas solny z roztworem 2,88
‑
molowym (d=1,05g/cm
3
), aby otrzyma
ć
roztwór 15%?
5.5-4.

Strona 3
5.5. Mieszanie roztworów
2011-05-02 12:49:20
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/96-mieszanie-roztworow.html?tmpl=component&print=1&p...
5.5-4.
Zmieszano 10 gramów 10% roztworu z 20 gramami 2,5% roztworu. Obliczy
ć
st
ęż
enie procentowe Px otrzymanego roztworu.
5.5-5.
Jak
ą
obj
ę
to
ść
6-molowego roztworu NaOH nale
ż
y doda
ć
do 280cm
3
1-molowego roztworu, aby otrzyma
ć
roztwór ok. 2-molowy?
5.5-6.
Zmieszano dwa roztwory: 200cm
3
0,5-molowego roztworu oraz 400 cm
3
1-molowego roztworu. Obliczy
ć
st
ęż
enie molowe otrzymanego roztworu.
5.5-7.
Ile gramów wody i ile gramów st
ęż
onego kwasu solnego (36%) nale
ż
y zmiesza
ć
, aby otrzyma
ć
200g 10% roztworu?
5.5-8.
Do jakiej obj
ę
to
ś
ci wody nale
ż
y wla
ć
150g 30% roztworu, aby otrzyma
ć
roztwór 22,5%?
5.5-9.
Z jakiej ilo
ś
ci 30% roztworu mo
ż
na otrzyma
ć
12g 50% roztworu po odparowaniu odpowiedniej ilo
ś
ci wody?
5.5-10.
Obliczy
ć
st
ęż
enie molowe roztworu otrzymanego przez rozcie
ń
czenie 200g 6% roztworu MgSO
4
do obj
ę
to
ś
ci 500cm
3
.
5.5-11.
Jak
ą
obj
ę
to
ść
0,15-molowego NaOH mo
ż
na otrzyma
ć
z 0,25dm
3
0,75-molowego NaOH drog
ą
rozcie
ń
czania?
5.5-12.
W jakim stosunku wagowym nale
ż
y zmiesza
ć
45% i 20% roztwór KCl aby po zmieszaniu st
ęż
enie roztworu wynosiło 35%?
5.5-13.
Ile gramów 40% roztworu chlorku magnezu nale
ż
y doda
ć
do 0,5 litra roztworu MgCl
2
o st
ęż
eniu 1,43
mol
/dm
3
i g
ę
sto
ś
ci 1,13 g/cm
3
aby otrzyma
ć
roztwór 20%?
5.5-14.
Ile gramów roztworu 40-procentowego i ile gramów roztworu 12-procentowego nale
ż
y zmiesza
ć
, aby otrzyma
ć
100g roztworu 15-procentowego
5.5-15.
Zmieszano 200cm
3
80% roztworu kwasu siarkowego(VI) o g
ę
sto
ś
ci 1,74g/cm
3
z 100cm
3
40% roztworem kwasu siarkowego(VI) o g
ę
sto
ś
ci 1,4 g/cm
3
. Oblicz ile cm
3
wody nale
ż
y
doda
ć
do powstałego roztworu kwasu, aby otrzyma
ć
roztwór 50%?
5.5-16.
Oblicz w jakim stosunku obj
ę
to
ś
ciowym nale
ż
y zmiesza
ć
wod
ę
i roztwór BaCl
2
o st
ęż
eniu 0,55mol/dm
3
i g
ę
sto
ś
ci 1,12 g/cm
3
aby otrzyma
ć
roztwór o st
ęż
eniu 3,5%
5.5-17.
W jakim stosunku masowym nale
ż
y wymiesza
ć
96%-y kwas siarkowy(VI) z wod
ą
aby otrzyma
ć
roztwór 55%
5.5-18.
Oblicz ile gramów wodorotlenku sodu nale
ż
y zmiesza
ć
z jego wodnym roztworem o st
ęż
eniu 10% aby przygotowa
ć
200cm
3
roztworu o st
ęż
eniu 25% i g
ę
sto
ś
ci d=1,27 g/cm
3
.
5.5-19.
Ile g st
ęż
onego – 98% roztworu kwasu siarkowego(VI) dodano do 250g 1% roztworu tego kwasu, je
ś
li otrzymano roztwór 3%?
5.5-20.
Maj
ą
c
alkohol
96% i 30% otrzyma
ć
50g alkoholu 70 stopniowego.
5.5-21.
W 120 g wody rozpuszczono 30 g Na
2
CO
3
.
10H
2
O. Jakie jest st
ęż
enie procentowe roztworu Na
2
CO
3
?
5.5-22.
Ile gramów 4% roztworu danego składnika nale
ż
y doda
ć
do 150 g 7% roztworu aby otrzyma
ć
roztwór 5%
5.5-23.
Oblicz jak
ą
obj
ę
to
ść
wody nale
ż
y doda
ć
do 300g 20% wodnego roztworu soli kuchennej, aby otrzyma
ć
roztwór 3% tej soli.
5.5-24.
St
ęż
enie jonów siarczanowych w roztworze Co
2
(SO
4
)
3
o d=1,01 kg/dm
3
wynosi 1,2
mol
/dm
3
. Ile wody nale
ż
y doda
ć
do 150cm
3
tego roztworu aby otrzyma
ć
5% roztwór soli.
5.5-25.
Zmieszano 200g 5-procentowego roztworu w
ę
glanu sodu z 400g 7-procentowego roztworu tej samej soli. Oblicz st
ęż
enie procentowe otrzymanego roztworu.
5.5-26.
Chemik chce otrzyma
ć
100g kwasu o st
ęż
eniu 54%. Ma do dyspozycji dwa roztwory tego kwasu: o st
ęż
eniu 30% i st
ęż
eniu 70%. Ile musi wzi
ąć
roztworu o wi
ę
kszym st
ęż
eniu?
5.5-27.
60g kwasu octowego o st
ęż
eniu 10% rozcie
ń
czono wod
ą
destylowan
ą
do obj
ę
to
ś
ci 250cm
3
. jakie jest st
ęż
enie molowe otrzymanego roztworu kwasu octowego? Masa molowa
kwasu octowego wynosi 60g/
mol
.
5.5-28.
Ile mililitrów 54-procentowego roztworu H
2
SO
4
nale
ż
y doda
ć
do 500ml roztworu H
2
SO
4
o st
ęż
eniu 0,05
mol
/l aby otrzymany roztwór zawierał w 1mililitrze 0,009807g H2SO4.
(d=1,4350 g/ml).
5.5-29.
G
ę
sto
ść
roztworu kwasu azotowego, w którym znajduje si
ę
0,11ułamka molowego HNO3, wynosi d=1,18kg/dm
3
. Obliczy
ć
obj
ę
to
ść
, do jakiej nale
ż
y rozcie
ń
czy
ć
10cm
3
tego
roztworu, aby otrzyma
ć
2,0 molowy roztwór.
5.5-30.
Ile gramów 45% roztworu kwasu azotowego nale
ż
y doda
ć
do 120g 20% roztworu kwasu azotowego aby otrzyma
ć
roztwór 30%.
5.5-31
Oblicz obj
ę
to
ść
NH
3
odmierzonego w warunkach normalnych, jak
ą
nale
ż
y rozpu
ś
ci
ć
dodatkowo w 450g 20% roztworu, aby uzyska
ć
roztwór o st
ęż
eniu 30%.
5.5-32
Oblicz w jakim stosunku wagowym trzeba zmiesza
ć
wod
ę
i roztwór Na
2
CO
3
o st
ęż
eniu 0,38
mol
/dm
3
i g
ę
sto
ś
ci 1,08 g/cm
3
, aby otrzyma
ć
roztwór o st
ęż
eniu 0,4%.
5.5-33
Oblicz, w jakim stosunku obj
ę
to
ś
ciowym trzeba zmiesza
ć
wod
ę
i roztwór BaCl
2
o st
ęż
eniu 0,55 mola/dm
3
i d=1,12g/cm
3
, aby otrzyma
ć
roztwór o st
ęż
eniu 3,5%.

Strona 4
5.5. Mieszanie roztworów
2011-05-02 12:49:20
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/96-mieszanie-roztworow.html?tmpl=component&print=1&p...
5.5-34
Adam przygotował 405g 15% roztworu NaCl o d=1,12 g/cm
3
. Oblicz jego st
ęż
enie molowe, oraz okre
ś
l, jak
ą
obj
ę
to
ść
roztworu o st
ęż
eniu 0,2
mol
/dm
3
mo
ż
na otrzyma
ć
, zu
ż
ywaj
ą
c
cały roztwór przygotowany przez Adama.
5.5-35
Przygotowywano 100 cm
3
10
-3
molowego roztworu AgNO
3
.Poniew
ż
jest to roztwór bardzo rozcie
ń
czony, wybrano w tym celu nast
ę
puj
ą
cy sposób: odwa
ż
ono wi
ę
ksz
ą
odwa
ż
k
ę
,
rozpuszczono ja w kolbie o pojemno
ś
ci 500 cm
3
, po czym z tego roztworu pobrano próbk
ę
10 cm
3
i rozcie
ń
czono do oczekiwanej obj
ę
to
ś
ci 100 cm
3
. Oblicz, jak
ą
mas
ę
AgNO
3
odwa
ż
ono.
5.5-36
Ile cm
3
wody nale
ż
y doda
ć
do 400 cm
3
68% roztworu HNO
3
o g
ę
sto
ś
ci 1,4 g/cm
3
, aby otrzyma
ć
roztwór 10%?
5.5-37
Oblicz , jak
ą
obj
ę
to
ść
wody nale
ż
y doda
ć
do 300g 20% wodnego roztworu soli kuchennej, aby otrzyma
ć
3% roztwór soli. (G
ę
sto
ść
wody wynosi 1g/cm
3
).
5.5-38
Ile cm
3
1-molowego H
2
SO
4
o g
ę
sto
ś
ci 1,065 g/cm
3
trzeba rozcie
ń
czy
ć
, aby otrzyma
ć
50cm
3
roztworu 5-procentowego o g
ę
sto
ś
ci 1,032 g/cm
3
?
5.5-39
Zmieszano 50g 30% roztworu NaCl i 25g 12% roztworu NaCl, a nast
ę
pnie z otrzymanego roztworu odparowano 15g wody. Ile wynosi st
ęż
enie procentowe otrzymanego roztworu.
5.5-40
W soku cytrynowym jest około 6,5% kwasu cytrynowego. Zmieszano 250g soku z 250g wody. Ile wynosi st
ęż
enie procentowe otrzymanego roztworu.
5.5-41
Zmieszano 50g 30% roztworu NaCl z 25g 12% roztworu NaCl. Oblicz st
ęż
enie procentowe otrzymanego roztworu.
« poprzednia
nast
ę
pna »
Poprawiony:
ś
roda, 22 wrze
ś
nia 2010 23:47
Wyszukiwarka
Podobne podstrony:
Chemia mieszaniny, roztwory, stężenia
Rozdział mieszanin i roztworów, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
mieszanie roztworów, semestr 1, Chemia, teoria
Odpowiedzi 5 5 Mieszanie roztworów
Mieszanie roztworw o rnych steniach procentowych word 97 - 2003, WSZOP BHP, Semestr IV, Fizjologia P
rozcienczenia, tablice etanolowe, mieszanie roztworow
Chemia labolatorium, Mieszanina buforowa, Mieszanina buforowa - stosowana w celu wytworzenia właściw
chemia, Kopia CEMENT SORELA, CEMENT SORELA, mieszanina stężonego roztworu chlorku magnezu MgCl2 (lub
chemia, CEMENT SORELA, CEMENT SORELA, mieszanina stężonego roztworu chlorku magnezu MgCl2 (lub MgSO4
R.Mieszanie i rozcieńczanie roztworów procentowych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr
Obliczanie pH roztworów mocnych oraz słabych kwasów i zasad oraz mieszanin buforowych, UWM Weterynar
EGZAMIN, ROZTWORY I MIESZANINY MINI, ROZTWORY I MIESZANINY
w06 Mieszaniny buforowe- c, St˙˙enie jon˙w hydroniowych wywiera wp˙yw na stan r˙wnowagi chemicznej w
Mieszaniny substastancji i wody (roztwory)
więcej podobnych podstron