ĆWICZENIE Nr 42
WYZNACZANIE STAŁEJ DYSOCJACJI SŁABEGO KWASU.
Cel ćwiczenia: Wykorzystanie pomiaru przewodnictwa roztworu słabego kwasu
do wyznaczenia stałej dysocjacji tego kwasu.
Roztwór elektrolitu jest dobrym przewodnikiem prądu. Nośnikami ładunku
elektrycznego w roztworze są jony. Zdolność roztworu elektrolitu do przewodzenia
prądu określa przewodnictwo elektryczne roztworu
Γ, które jest odwrotnością oporu
stawianego przez roztwór elektrolitu.
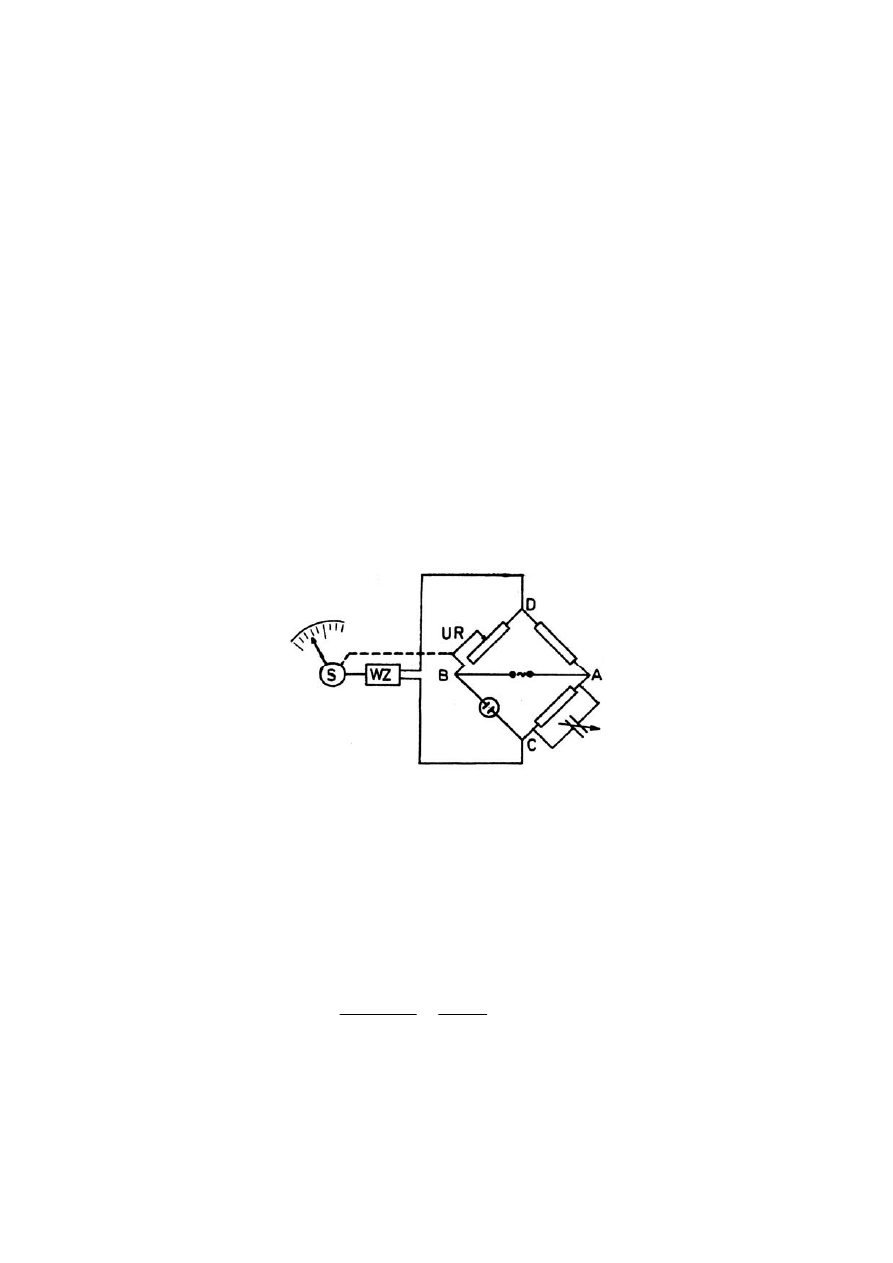
Do pomiaru przewodnictwa elektrolitu wykorzystuje się specjalne naczynia
nazywane naczyńkami konduktometrycznymi. Zawierają one wtopione elektrody
platynowe, których efektywna powierzchnia jest duża dzięki pokryciu elektrod
czernią platynową. Celem zmierzenia przewodnictwa roztworu elektrolitu elektrody
naczyńka konduktometrycznego należy połączyć z konduktometrem, który jest
zmodyfikowanym mostkiem Wheatstone’a. Schemat mostka Wheatstone’a
przedstawiono na rysunku. Pomiar przewodnictwa polega na doborze takiego oporu
UR, który równoważy opór stawiany przez naczyńko konduktometryczne. Po
zrównoważeniu mostka pomiędzy punktami C i D prąd nie płynie. W konduktometrze
opór UR jest dobierany automatycznie.
Schemat konduktometru
W roztworach wszystkich elektrolitów jonogennych, do których należą słabe
kwasy i zasady, jony powstają wskutek reakcji dysocjacji:
−
+
+
=
A
H
HA
(3)
Stężeniową stałą równowagi tej reakcji, nazywaną stałą dysocjacji K
c
wyraża
zależność:
)
1
(
c
c
c
c
K
2
HA
A
H
c
α
−
⋅
α
≡
⋅
=
−
+
(4)
w której
α jest stopniem dysocjacji, który można obliczyć jako stosunek
przewodnictwa molowego roztworu o stężeniu c,
λ
c
do przewodnictwa granicznego
λ
0
:
0
λ
λ
=
α
(5)
Uwzględniając zależność (5) w równaniu (4) otrzymujemy wyrażenie (6) znane jako
prawo rozcieńczeń Ostwalda:
)
(
c
K
0
0
2
c
λ
−
λ
⋅
λ
⋅
λ
=
(6)
Dla elektrolitów jonogennych, przewodnictwo graniczne
λ
0
można obliczyć
z prawa niezależnej wędrówki jonów, sformułowanego przez Kohlrauscha:
0
0
0
−
+
λ
+
λ
=
λ
(7)
Wykonanie ćwiczenia.
1. Pobrać zanurzeniowe naczyńko konduktometryczne, wzorcowy roztwór KCl
i roztwór słabego kwasu.
2. Metodą kolejnych rozcieńczeń przygotować roztwory słabego kwasu
o podanych stężeniach.
3. Zanurzeniowe naczyńko konduktometryczne, po opłukaniu wodą destylowaną
i wzorcowym roztworem KCl, zanurzyć w tym roztworze i umieścić w
termostacie. Przewodnictwo roztworu wzorcowego zmierzyć po 15 minutach
termostatowania. Pomiar powtórzyć trzykrotnie w odstępach 5 minutowych.
4. Zanurzeniowe naczyńko konduktometryczne kilkakrotnie opłukać wodą
destylowaną i roztworem słabego kwasu o najmniejszym stężeniu, zanurzyć w
tym roztworze i umieścić w termostacie. Przewodnictwo roztworu zmierzyć po
15 minutach termostatowania. Pomiar powtórzyć trzykrotnie w odstępach 5
minutowych.
5. Wykonać analogiczne pomiary przewodnictwa dla wszystkich przygotowanych
roztworów.
6. Wyniki pomiarów zestawić w tabeli:
Przewodnictwo, S
Stężenie
roztworu
Γ
1
Γ
2
Γ
3
Γ
śr
κ
S
.
m
-1
λ
Sm
2
mol
-1
Opracowanie wyników:
1. Obliczyć stałą naczyńka konduktometrycznego:
śr
KCl
k
Γ
κ
=
2. Przewodnictwa molowe
λ obliczyć z zależności (2)
3. Obliczyć stopień dysocjacji
α i stałe dysocjacji K
c
.
4. Wyniki zestawić w tabeli:
Stężenie kwasu
α
K
c
5.
Obliczyć średnią wartość stałej dysocjacji i porównać z danymi
tabelarycznymi
.
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 42, Ćwiczenie 42 (1), S
Ćwiczenie1 42, Studia, Fizyka, LABORKI
cwiczenie 42 kaustyfikacja sody, Technologia chemiczna, Technologia nieorganiczna
Cwiczenie 42 (7), 2.Elektryczność
Ćwiczenie 42, Ćwiczenie 42 (8), Nowak Marek
Ćwiczenie 42, cw42
ćwiczenie 42, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opracow
Ćwiczenie 42, Ćwiczenie 42 (6), MICHAŁ IiKŚ
więcej podobnych podstron