
UKŁADY RÓWNOWAGI
FAZOWEJ

Równowaga termodynamiczna
• Stan równowagi: minimum energii swobodnej lub równość
potencjałów chemicznych
• Energia swobodna Helmholtza: F = E – TS
• Zmiana energii wewnętrznej:
∆E = ∆Q + ∆W
• Zmiana entropii:
∆S = - ∆Q / T
• Energia swobodna Gibbsa: G = E + pV – TS
• Entalpia: H = E + pV
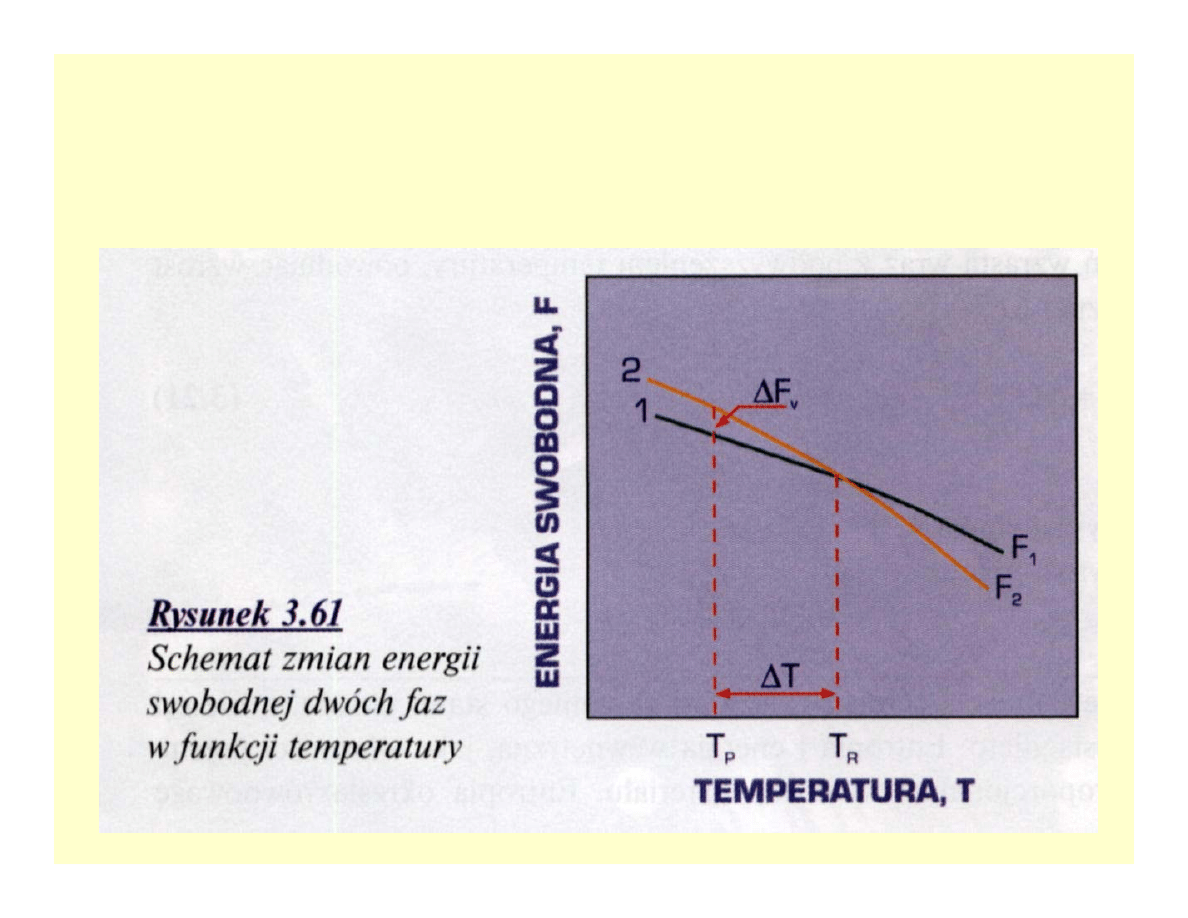
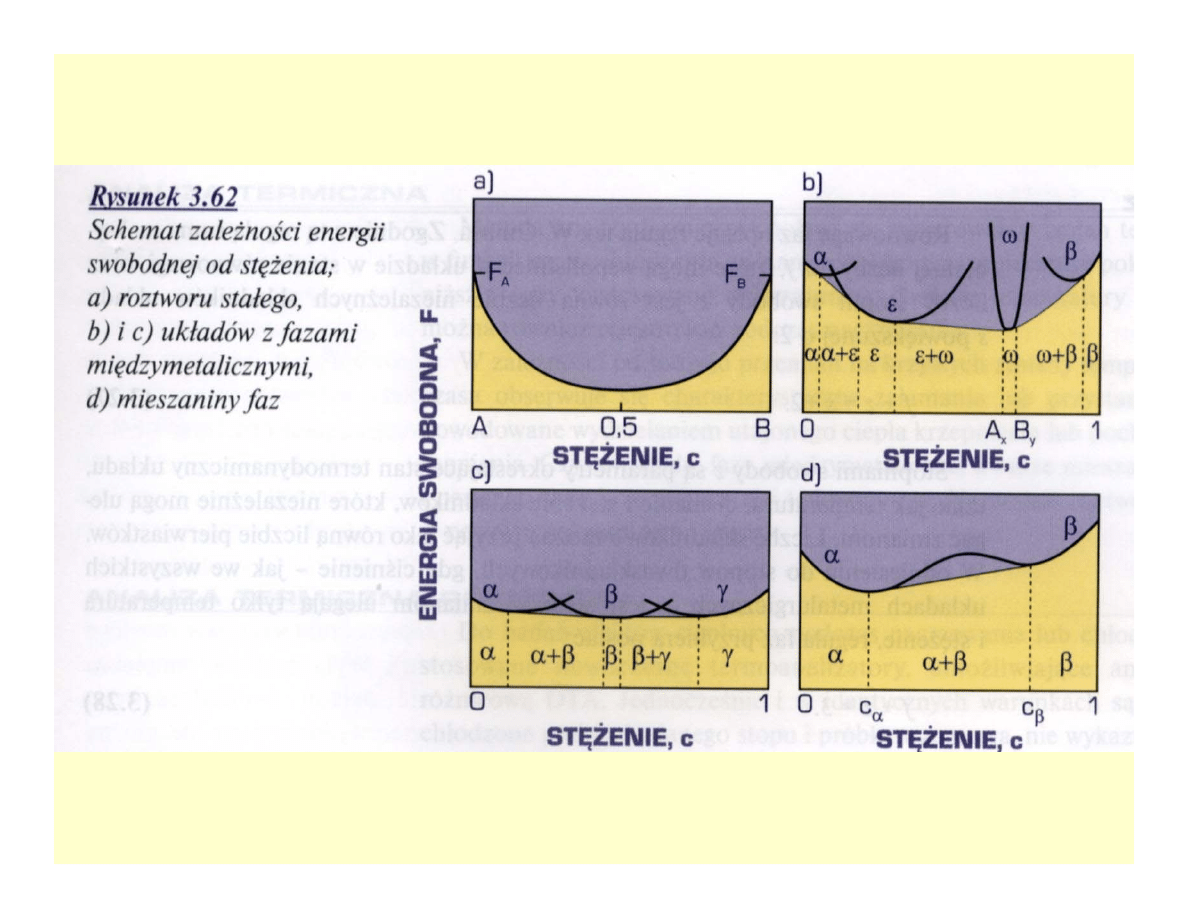
Energia swobodna faz stopu
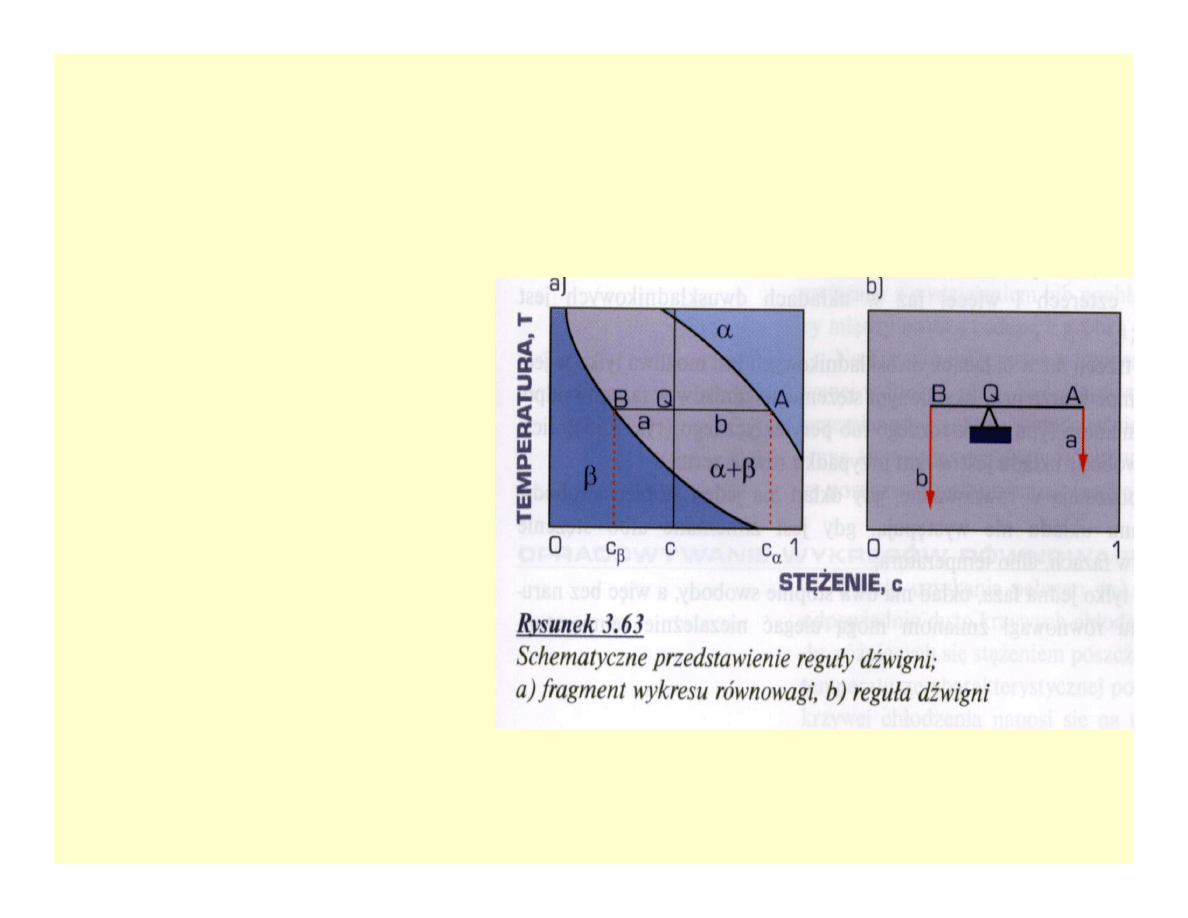
Reguła dźwigni
• a/b = QB/QA
• a + b = 1
• bc
β
+ ac
α
= c
• a = (c-c
β
/ c
α
-c
β
)
• B = (c
α
-c) / c
α
-c
β
)

Reguła faz Gibbsa
• Liczba stopni swobody z = s – f + 2
• Równowaga czterech i więcej faz w układach
dwuskładnikowych jest niemożliwa (p = const)
• Równowaga trzech faz w tych układach jest możliwa w
stałej temperaturze przy określonym stężenie składników
fazach (eutektyki lub perytektyki)
• Dwie fazy są w równowadze nawet przy zmianie bądź
stężenia składnika w fazie, bądź temperatury
• Dla jednej fazy możliwa jest zmiana i stężenia, i
temperatury

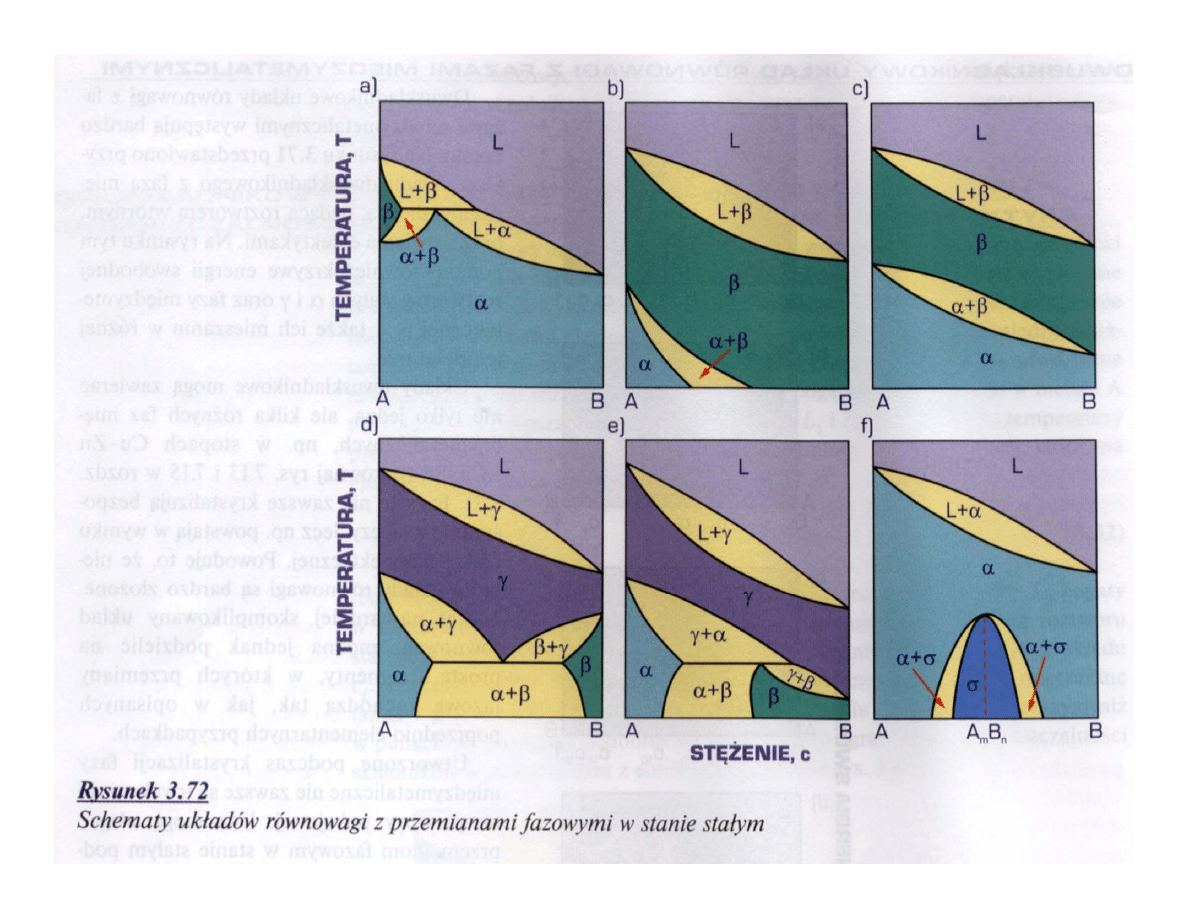
Dwuskładnikowe układy równowagi
fazowej
• O zupełnej rozpuszczalności składników stanie stałym
• O całkowitym braku rozpuszczalności w stanie stałym z
eutektyką
• O ograniczonej rozpuszczalności w stanie stałym z
eutektyką
• O ograniczonej rozpuszczalności w stanie stałym z
perytektyką
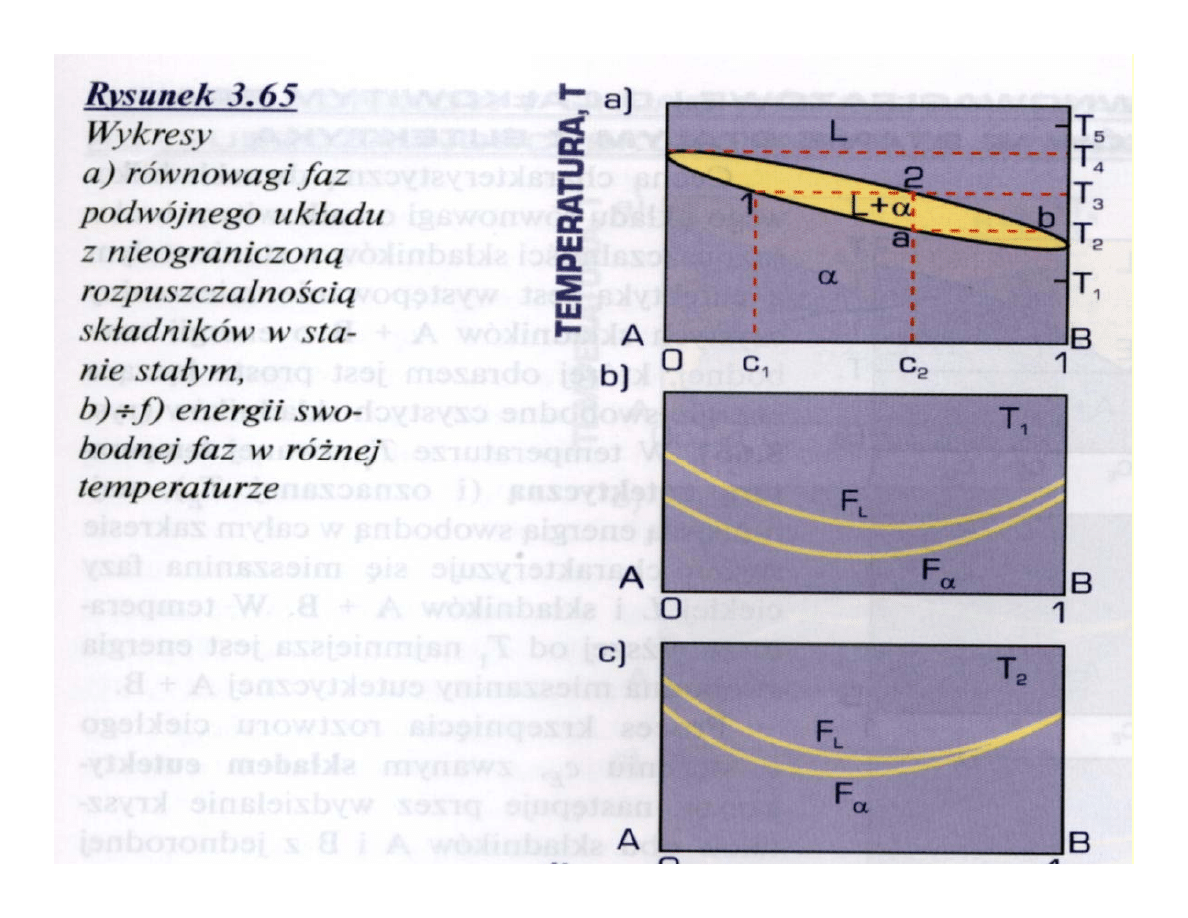
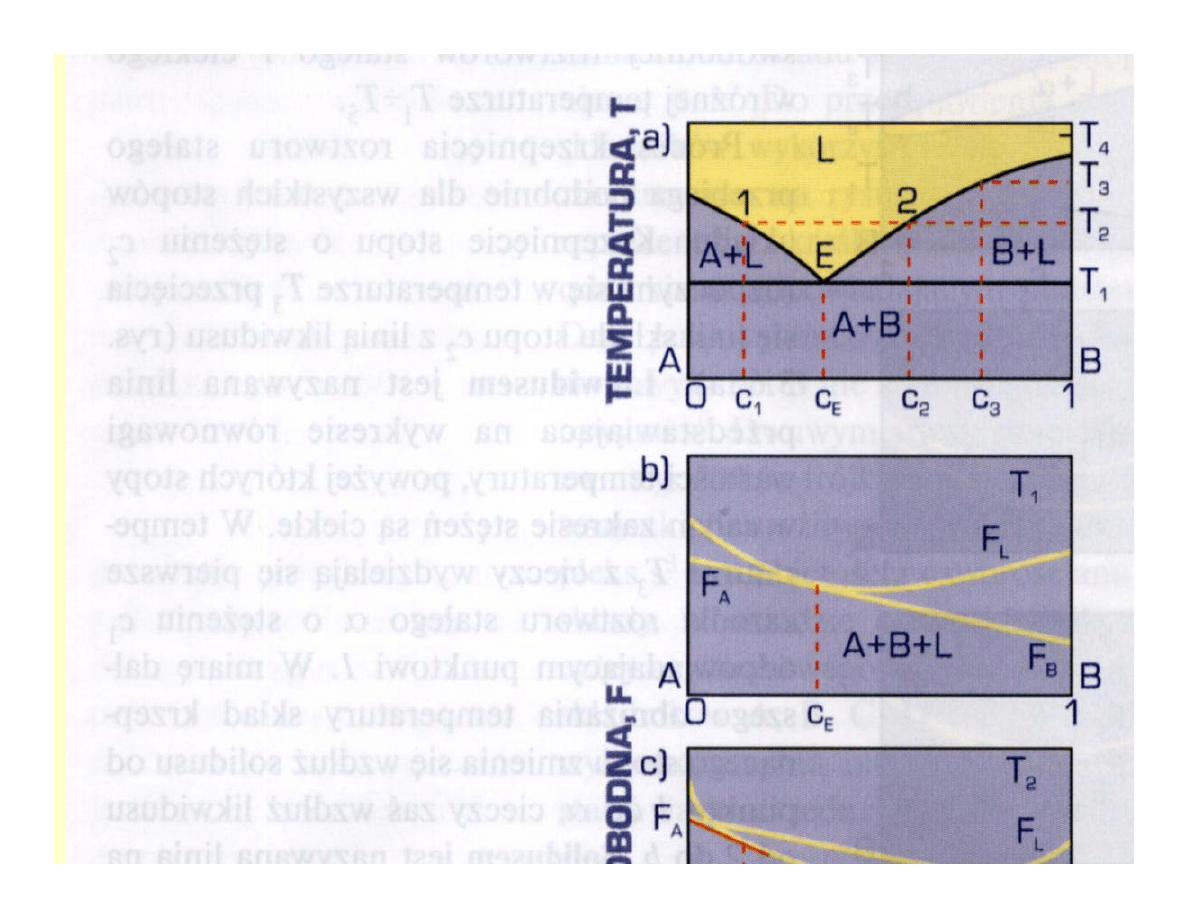
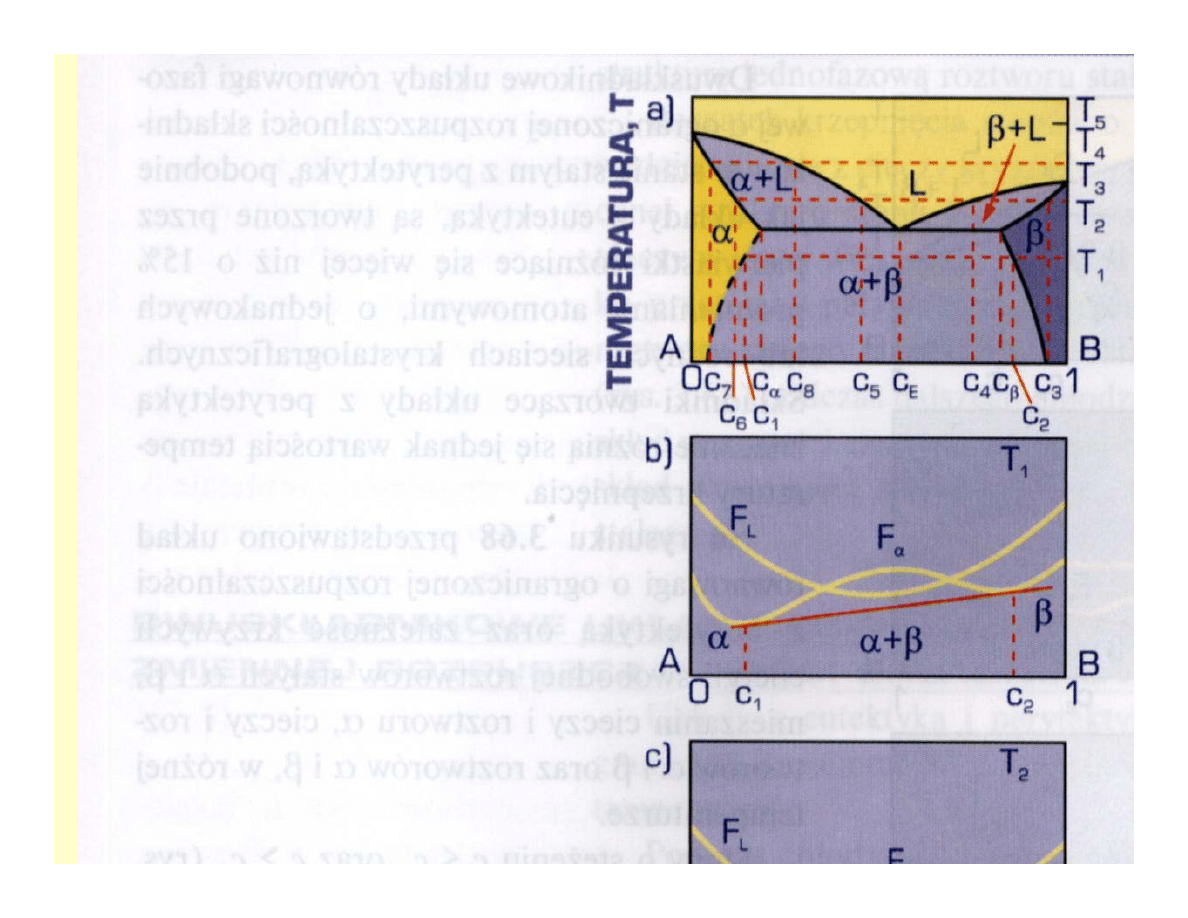
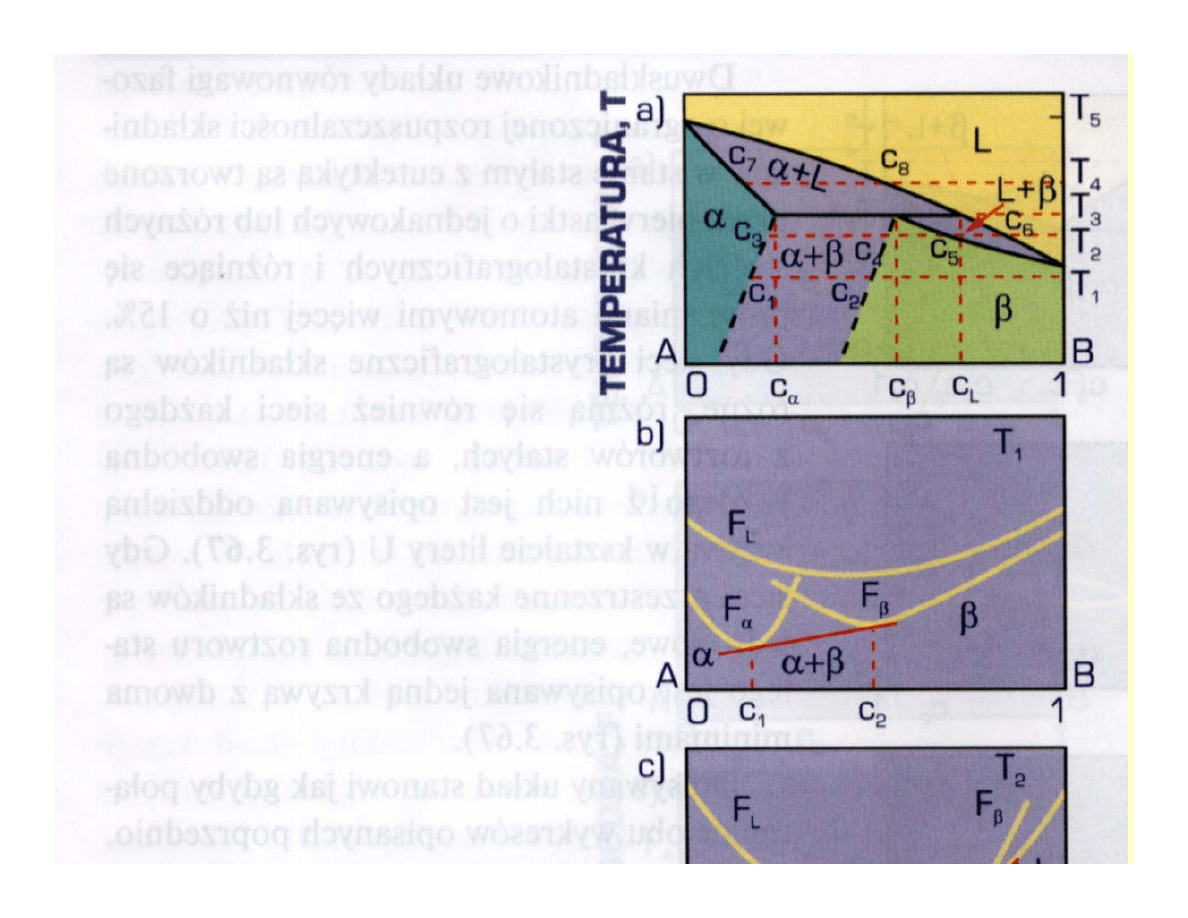
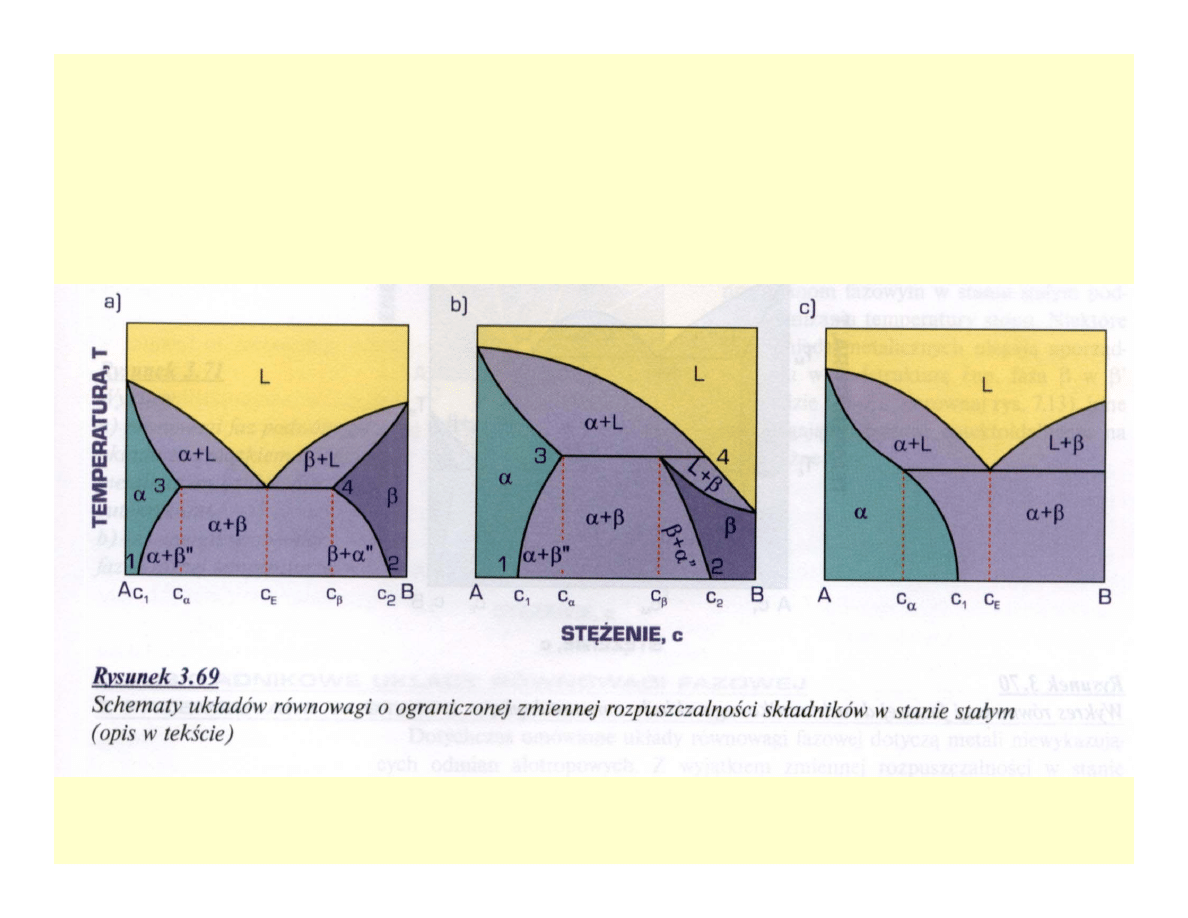
Przykłady zmiennej
rozpuszczalności w stanie stałym
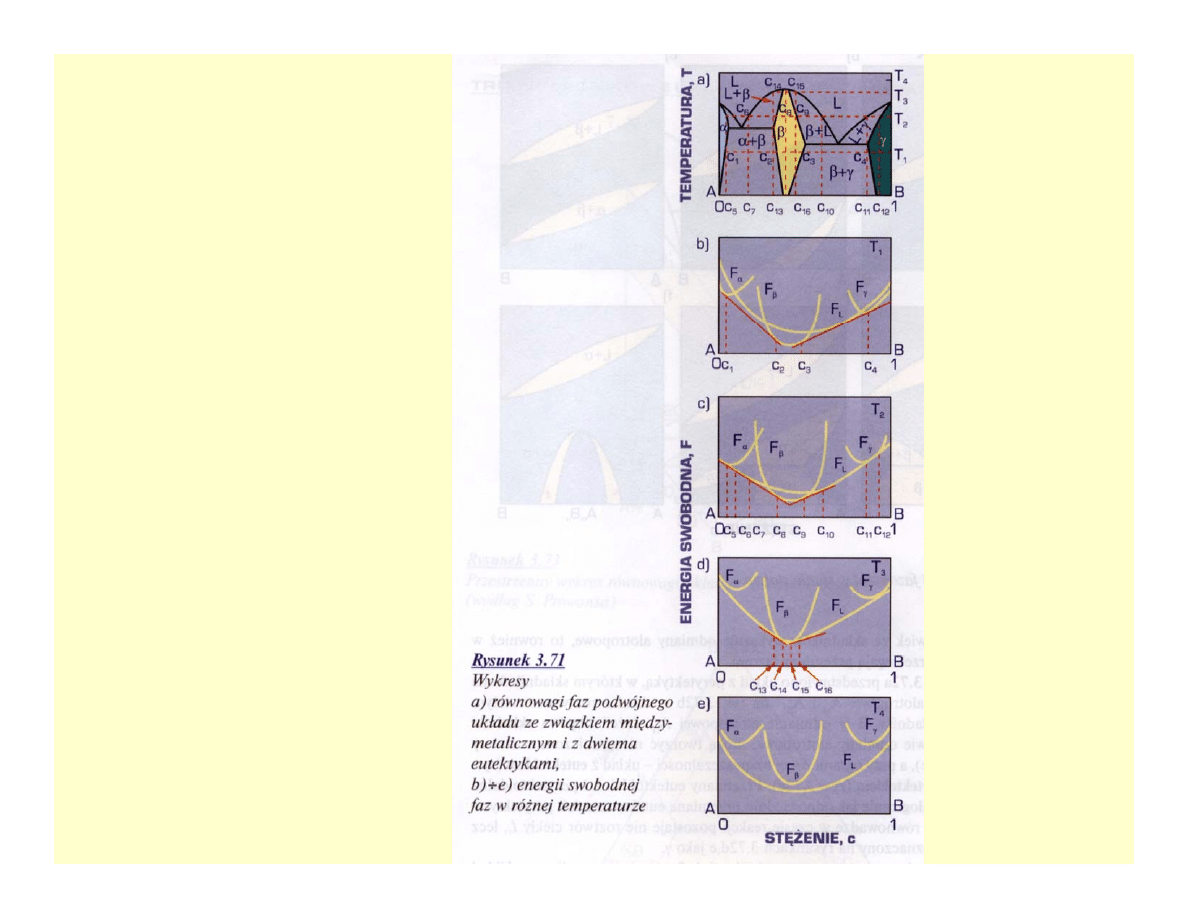
Układ równowagi
z fazami
międzymetaliczny
mi

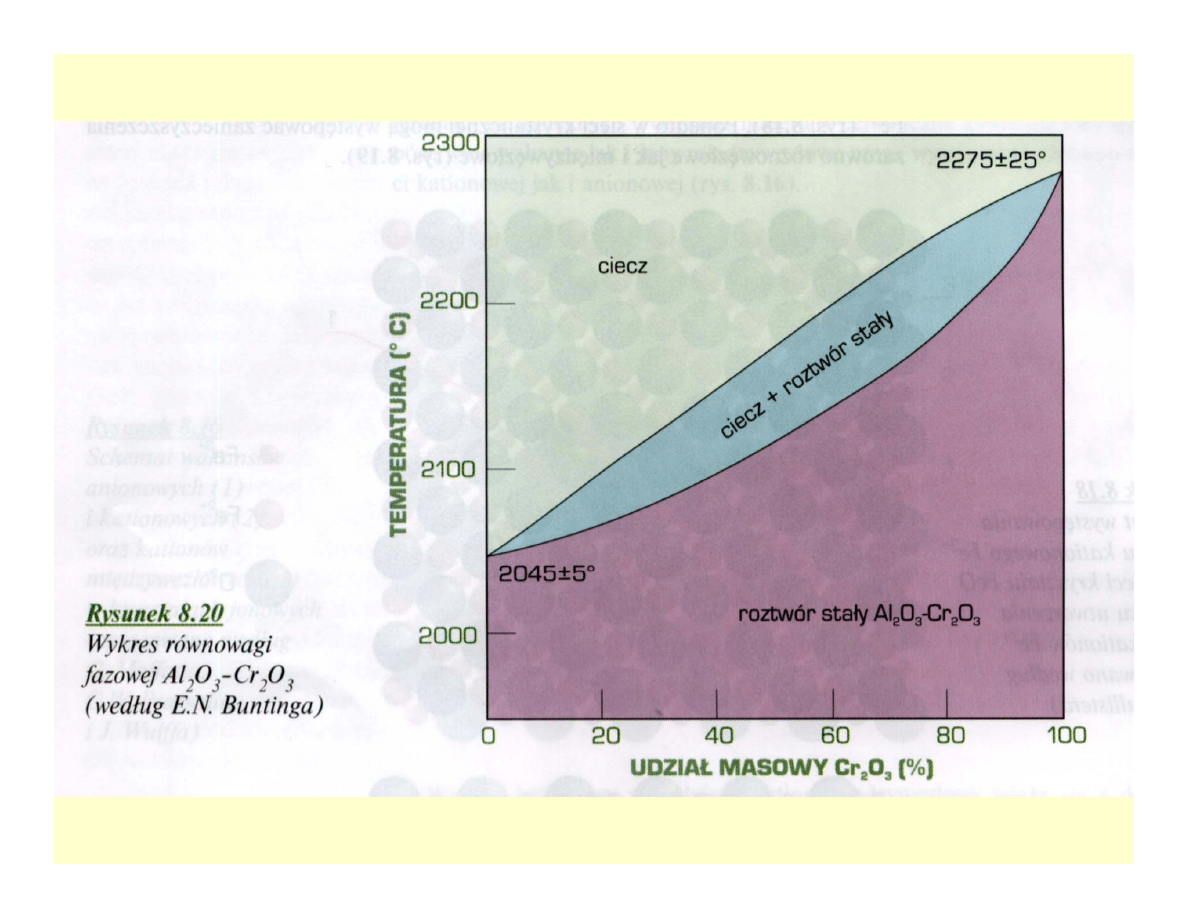
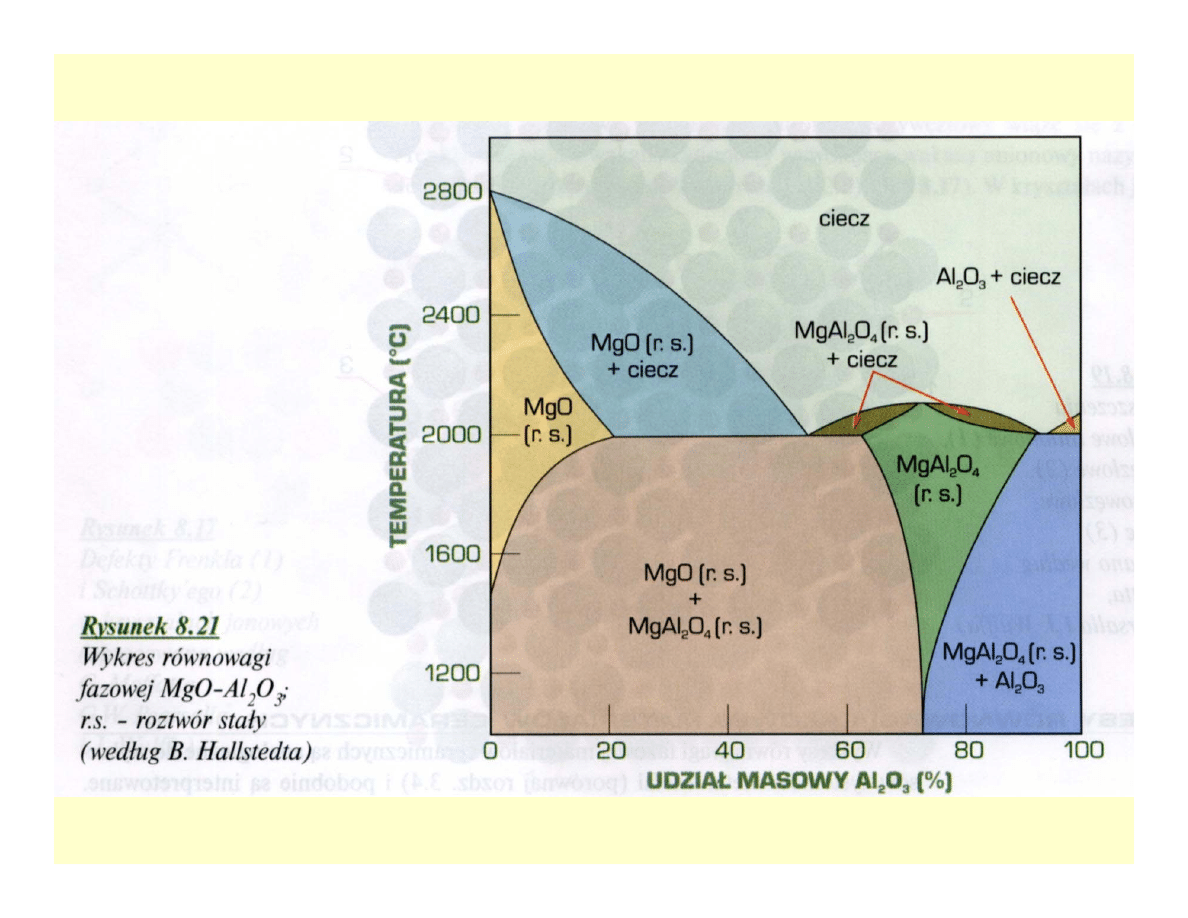
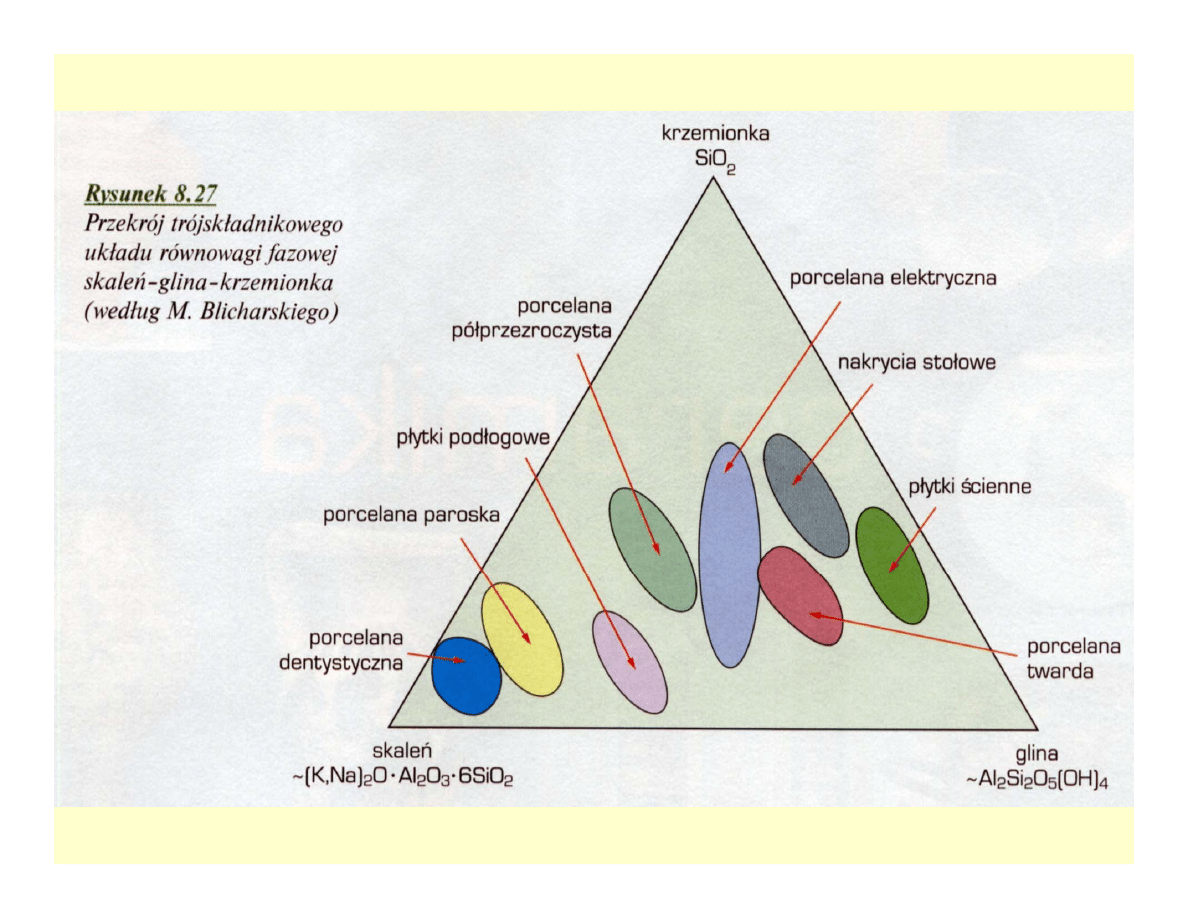
Układy równowagi fazowej
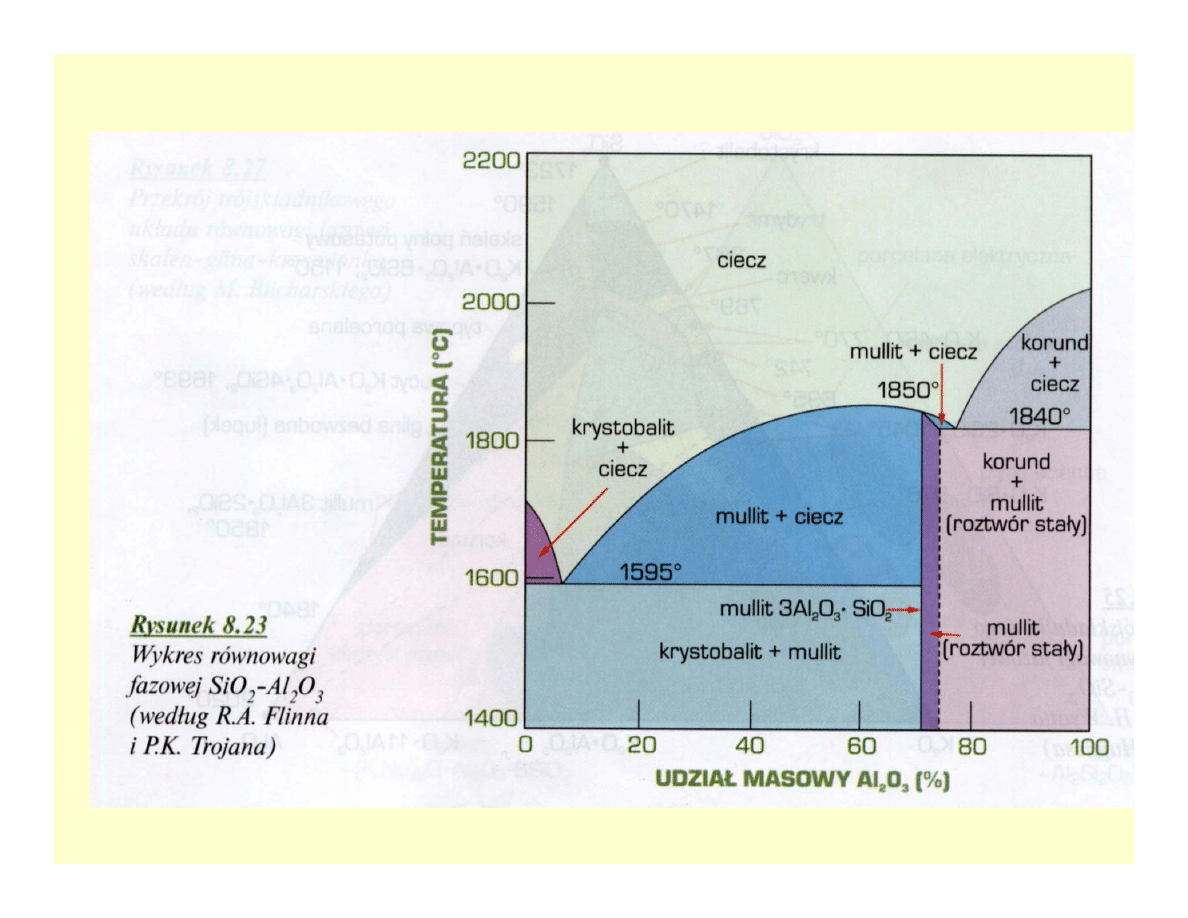
ceramik
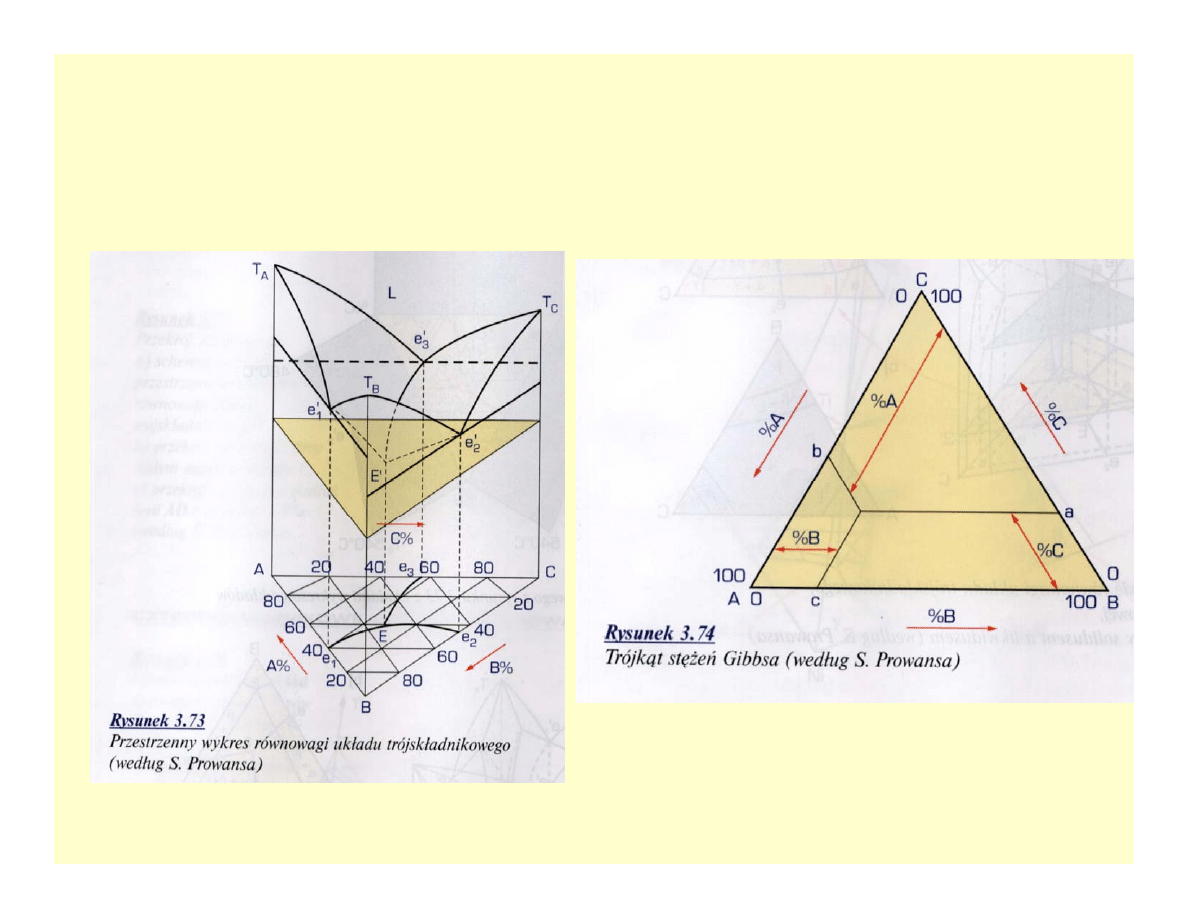
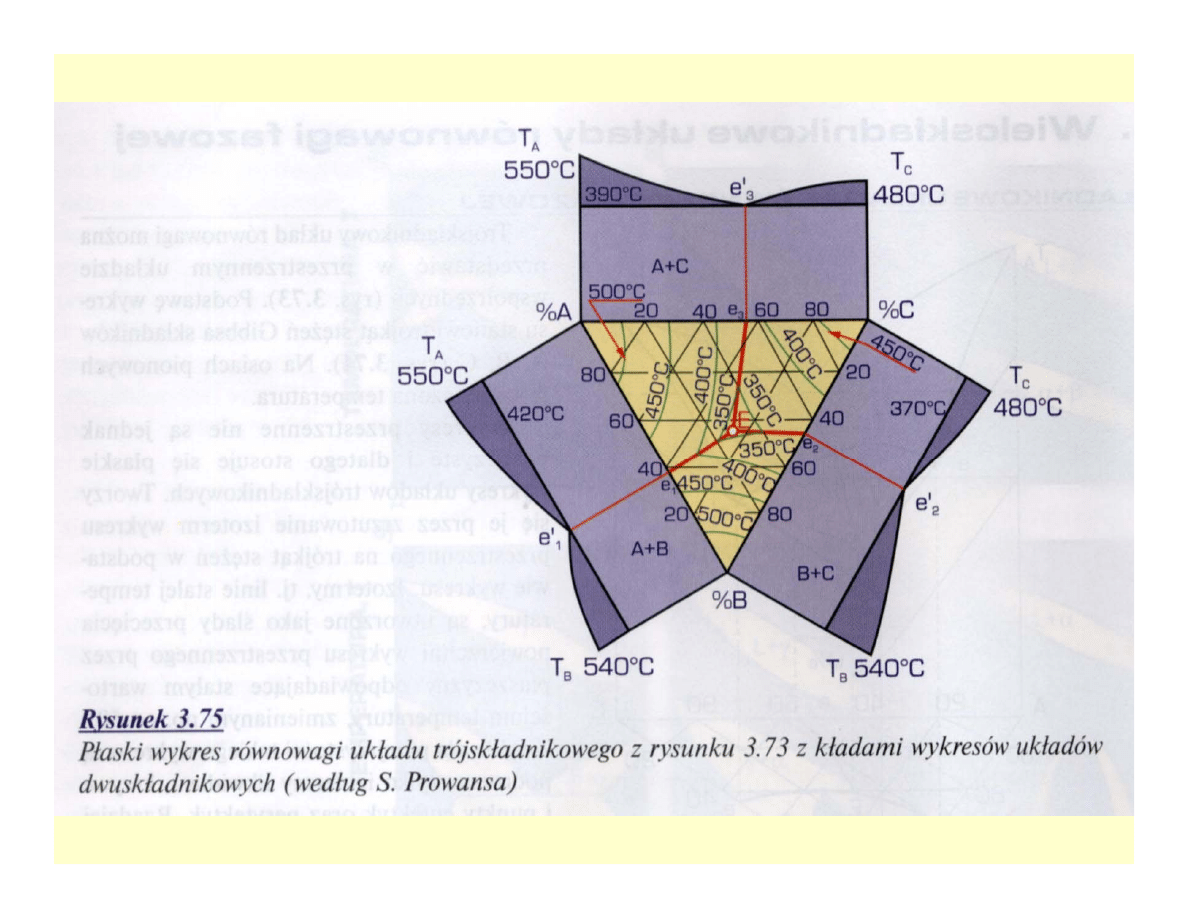
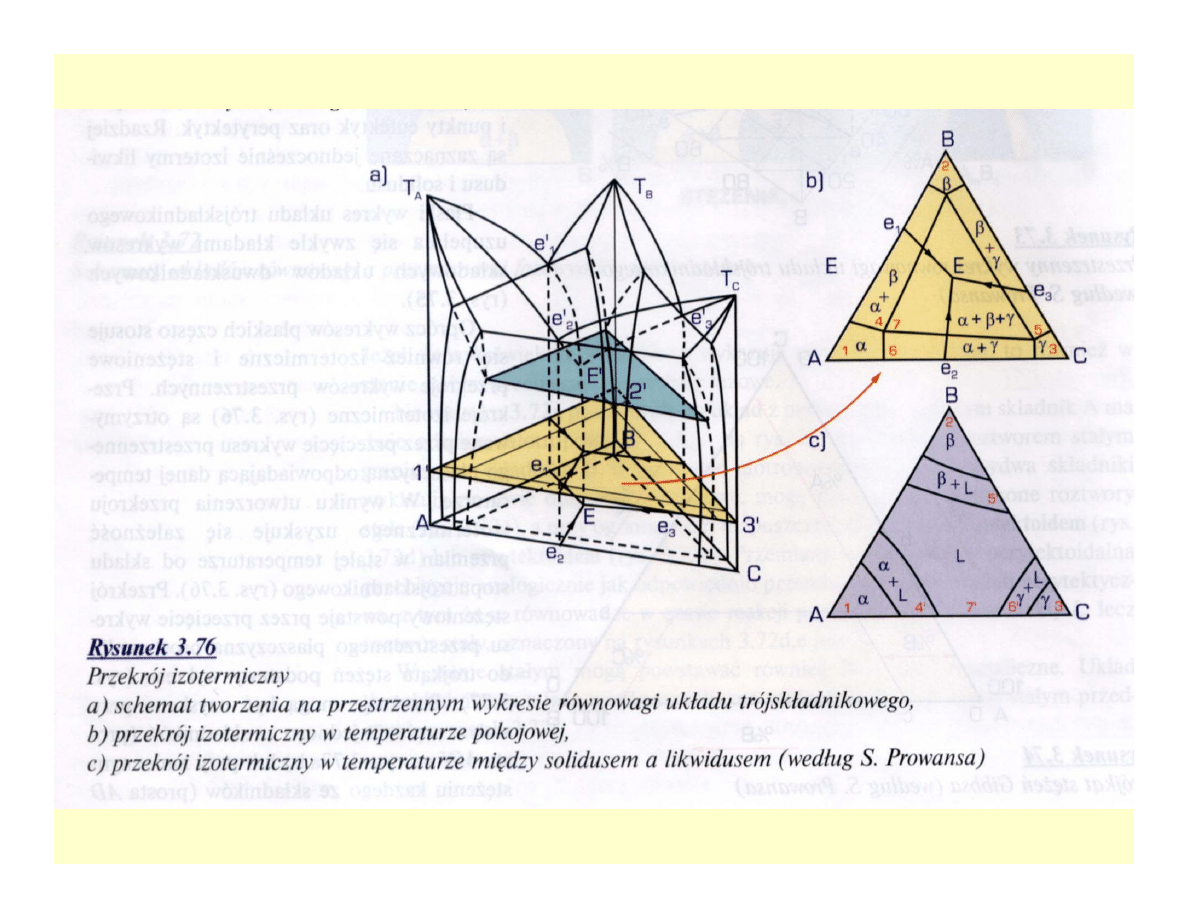
Wieloskładnikowe układy równowagi
fazowej
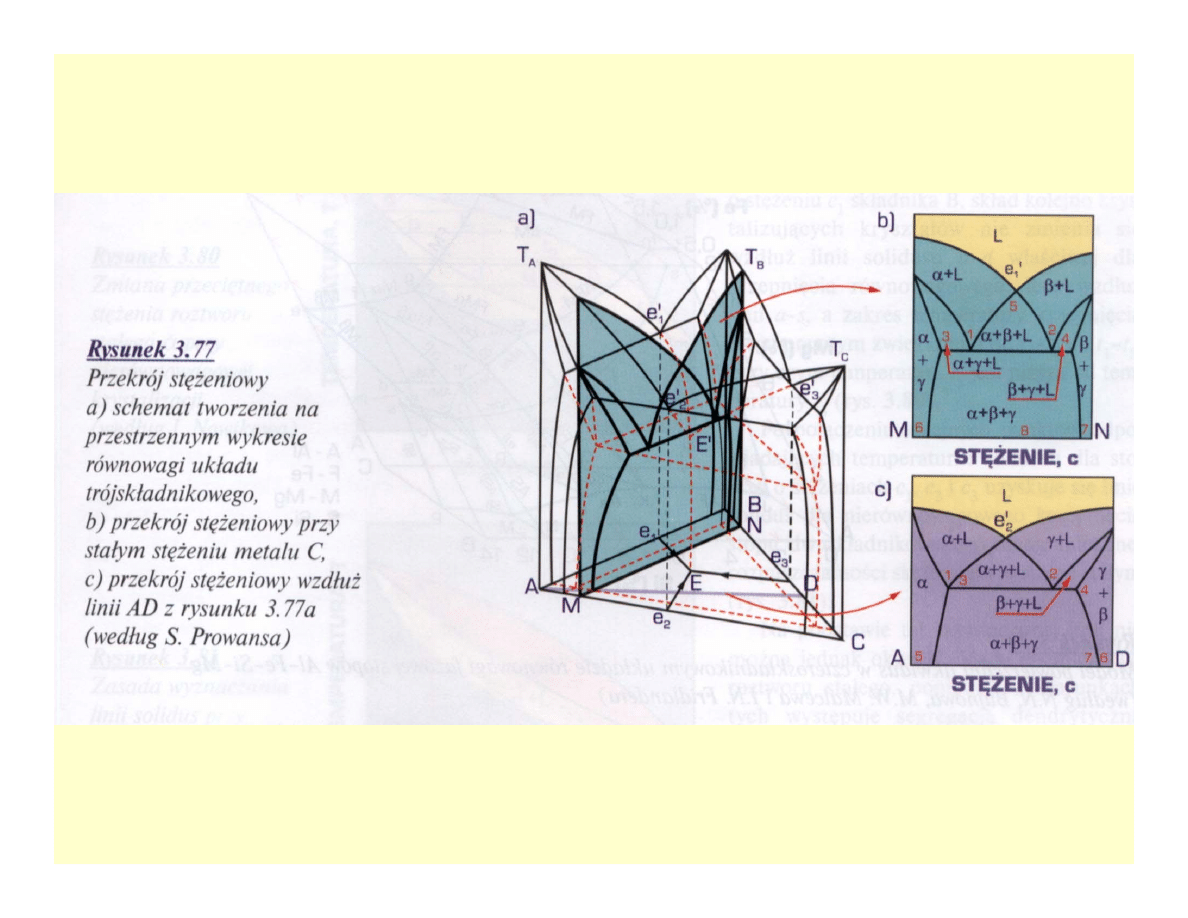

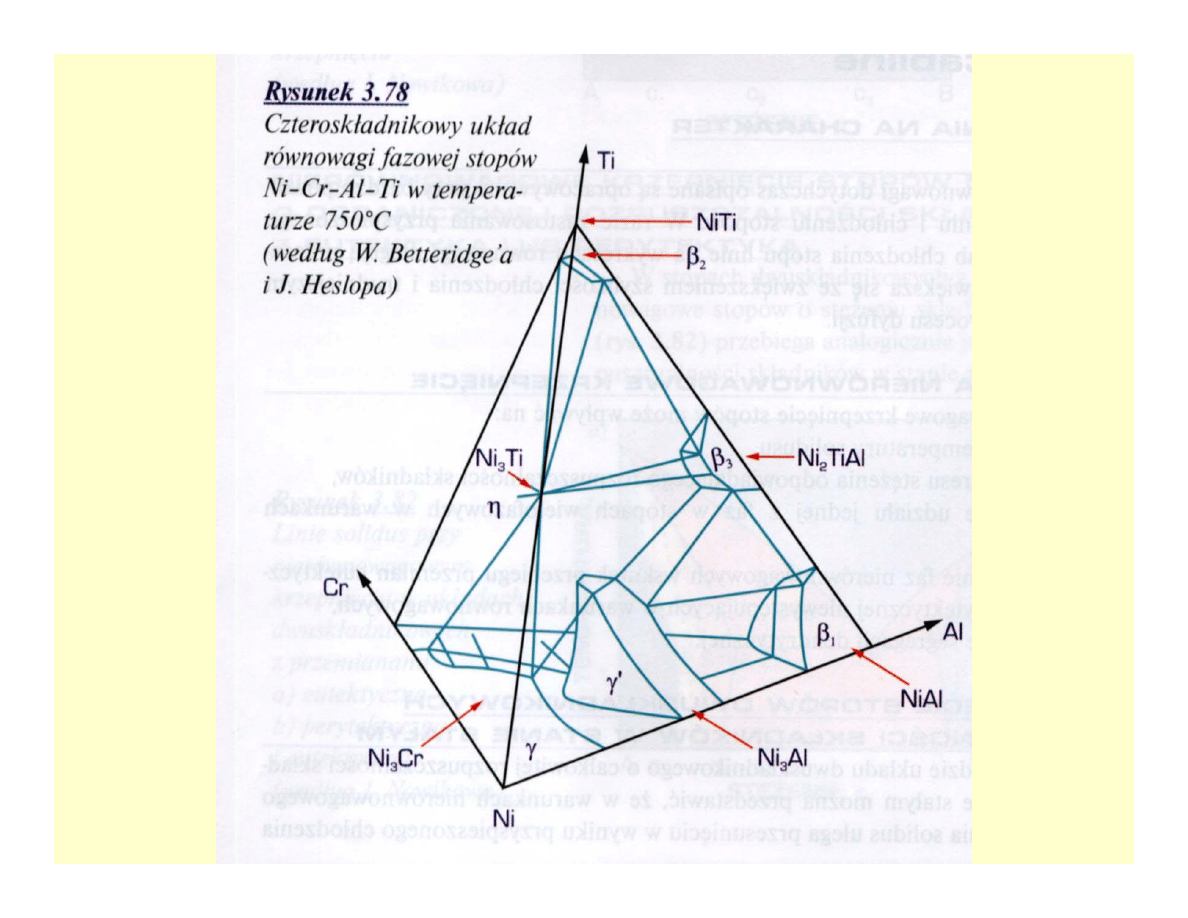
Układy czteroskładnikowe
Document Outline
- UKŁADY RÓWNOWAGI FAZOWEJ
- Równowaga termodynamiczna
- Energia swobodna faz stopu
- Reguła dźwigni
- Reguła faz Gibbsa
- Dwuskładnikowe układy równowagi fazowej
- Przykłady zmiennej rozpuszczalności w stanie stałym
- Układ równowagi z fazami międzymetalicznymi
- Układy równowagi fazowej ceramik
- Wieloskładnikowe układy równowagi fazowej
- Układy czteroskładnikowe
Wyszukiwarka
Podobne podstrony:
7 uklady rownowagi fazowej id 4 Nieznany
układy równowagi fazowej
Dwuskladnikowe uklady rownowagi fazowej, Księgozbiór, Studia, Materiałoznastwo
7 uklady rownowagi fazowej id 4 Nieznany
Dwuskladnikowe uklady rownowagi fazowej
Struktura materiałów, układy równowagi fazowej, przemiany fazowe (Tatiana Kosińska)
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
7 Analiza termiczna w zastosowaniu do wyznaczania wykresu równowagi fazowej
Układy równowazne 2
RÓWNOWAGI FAZOWE
Wykres układu równowagi fazowej, Polibuda, NoM
Analiza termiczna w zastosowaniu do wyznaczania wykresu równowagi fazowej, Studia, SEMESTR 1, NOM
więcej podobnych podstron