
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1231/2006
z dnia 16 sierpnia 2006 r.
zmieniaj
ące załączniki I i II do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę dla określania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
ceftiofuru oraz monoleinianu i trioleinianu polioksyetylenosorbitolu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę dla
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2 i 3,
uwzgl
ędniając opinie Europejskiej Agencji Leków wydane przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie stosowane
we Wspólnocie w weterynaryjnych produktach leczni-
czych przeznaczonych do podawania zwierz
ętom hodo-
wanym w celu produkcji
żywności powinny być
oceniane zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
W za
łączniku I do rozporządzenia (EWG) nr 2377/90
uwzgl
ędniona
jest
obecnie
substancja
Ceftiofur
w odniesieniu do mi
ęśni, tłuszczu, wątroby i nerek
byd
ła i świń oraz mleka pochodzącego od bydła. Wpis
dotycz
ący substancji Ceftiofur w wymienionym załącz-
niku nale
ży uzupełnić o owce oraz rozszerzyć na
wszystkie gatunki ssaków hodowanych w celu produkcji
żywności w odniesieniu do mięśni, tłuszczu, wątroby,
nerek i mleka.
(3)
W za
łączniku II do rozporządzenia (EWG) nr 2377/90
uwzgl
ędniona jest obecnie substancja monooleinian
polioksyetylenosorbitolu w odniesieniu do wszystkich
gatunków hodowanych w celu produkcji
żywności.
Wpis dotycz
ący monooleinianu polioksyetylenosorbitolu
w wymienionym za
łączniku należy zastąpić wpisem
dotycz
ącym monooleinianu i trioleinianu polioksyetyle-
nosorbitolu, obejmuj
ącym trioleinian polioksyetylenosor-
bitolu w odniesieniu do wszystkich gatunków zwierz
ąt
hodowanych w celu produkcji
żywności.
(4)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(5)
Nale
ży przewidzieć odpowiedni okres poprzedzający
stosowanie niniejszego rozporz
ądzenia, aby umożliwić
pa
ństwom członkowskim dostosowanie zezwoleń na
wprowadzenie do obrotu omawianych weterynaryjnych
produktów leczniczych, wydanych zgodnie z dyrektyw
ą
2001/82/WE Parlamentu Europejskiego i Rady z dnia
6 listopada 2001 r. w sprawie wspólnotowego kodeksu
odnosz
ącego się do weterynaryjnych produktów leczni-
czych (
2
), które mo
że okazać się konieczne w świetle
niniejszego rozporz
ądzenia.
(6)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
Za
łączniki I i II do rozporządzenia (EWG) nr 2377/90 zmienia
si
ę zgodnie z Załącznikiem do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze Rrozporz
ądzenie stosuje się od dnia 16 października
2006 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
pa
ństwach członkowskich.
Sporz
ądzono w Brukseli, dnia 16 sierpnia 2006 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
17.8.2006
Dziennik Urz
ędowy Unii Europejskiej
L 225/3
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1055/2006 (Dz.U. L 192
z 13.7.2006, str. 3).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).
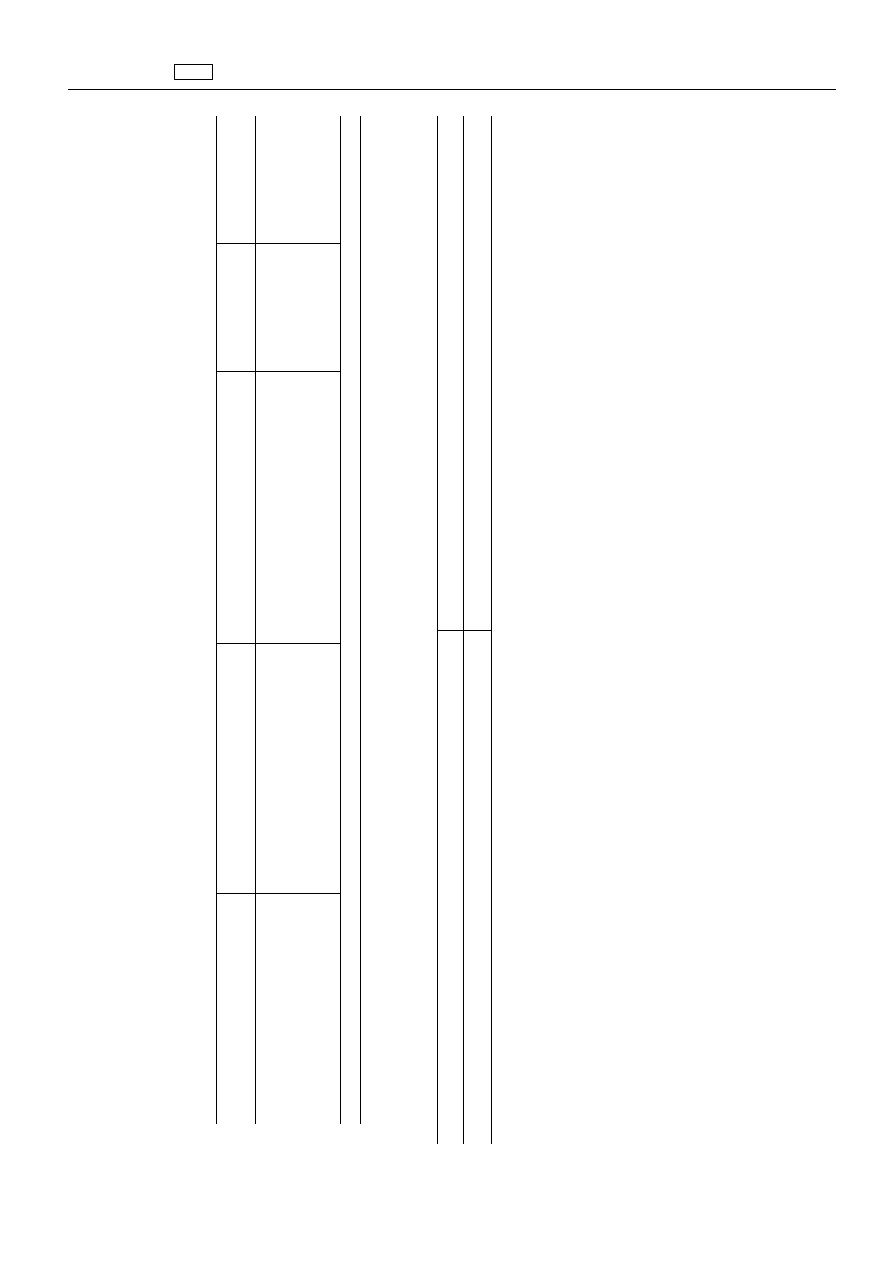
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
do
rozporz
ądzenia
(EWG)
nr
2377/90
(Wykaz
substancji
farmakologicznie
czynnych,
dla
których
zosta
ły
ustalone
najwy
ższe
dopuszczalne
poziomy
pozosta
ło
ści)
wprowadza
się
nast
ępuj
ąc
ą
substancj
ę:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.2.
Cefalosporyny
Substancja
czynna
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Ceftiofur
Suma
wszystkich
pozosta
ło
ści
zachowuj
ących
struktur
ę
betalaktamow
ą
wyra
żon
ą
jako
desfu-
royleceftiofur
Wszystkie
gatunki
ssaków
hodowanych
w
celu
produkcji
żywno
ści
1
000
μg/kg
Mi
ęś
nie
2
000
μg/kg
Tł
uszcz
(
1
)
2
000
μg/kg
W
ątroba
6
000
μg/kg
Nerki
100
μg/kg
Mleko
(
1
)
W
odniesieniu
do
trzody
chlewnej
ten
NDP
dotyczy
»skóry
i
tł
uszczu
w
proporcjach
naturalnych«.
”
B.
Do
za
łą
cznika
II
do
rozporz
ądzenia
(EWG)
nr
2377/90
(Wykaz
substancji
niepodlegaj
ących
najwy
ższym
dopuszczalnym
poziomom
pozosta
ło
ści)
wprowadza
się
nast
ępuj
ąc
ą
substancj
ę:
3.
Substancje
ogólnie
uwa
żane
za
bezpieczne
Substancja
czynna
farmakologicznie
Gatunek
zwierz
ąt
„Monooleinian
i
trioleinian
polioksyetylenosorbitolu
Wszystkie
gatunki
hodowane
w
celu
produkcji
żywno
ści
”
PL
L 225/4
Dziennik Urz
ędowy Unii Europejskiej
17.8.2006
Wyszukiwarka
Podobne podstrony:
2006 04 17
2006 08 25 Ustawa o biokomponen Nieznany (2)
2015 08 20 08 17 13 01
2002 08 17
LM 2006 08
2015 08 20 08 17 03 01
08 (17)
08 17 86
2015 08 20 08 17 49 01
08 (17)
Dz U 2006 nr 17 poz 140 2006 01 23
wojtczak 2006 08 28
Dz.U. 2006 nr 17 poz. 140 2006.01.23
2003 08 17
podrecznik starszoharcerski 2006 12 17
CDM 2 08 17 Release Info
IMiUE, 8 08 17 zał 1
więcej podobnych podstron