2009-11-24
1
Chemia IV
Układ okresowy
Układ okresowy pierwiastków
Chemik rosyjski Dymitr I. Mendelejew
oraz chemik niemiecki Julius Lothar
Meyer w 1869 odkrywają, niezależnie od
siebie, okresowość pierwiastków
chemicznych w odniesieniu do ciężaru
atomowych. Na podstawie tego
stwierdzenia Mendelejew przewiduje
istnienie nieznanych jeszcze
pierwiastków .
2009-11-24
2
• w drugim wydaniu (1871 r.) Mendelejew
po raz pierwszy wprowadził do swojego
układu wolne miejsca
• brakowało pierwiastków z ciężarami
atomowymi odpowiednimi dla tych miejsc
• Mendelejew uznał, że pierwiastki te muszą
istnieć a nie zostały jeszcze odkryte
Uwagi Mendelejewa
• Mendelejew (również Meyer) poznał związek
pomiędzy ciężarem atomowym pierwiastków
a ich własnościami fizycznymi i chemicznymi.
• Ustawił 63 znanych pierwiastków w rzędach
tak, że pierwiastki o podobnej wartościowości
stoją pod sobą
• Odkrył, że substancje w tych rzędach
zachowują się podobnie pod względem
fizycznym i chemicznym.
• Wraz ze wzrastającym ciężarem atomowym
istnieje okresowe zwiększanie i zmniejszanie
wartościowości, równolegle do okresowych
zmian właściwości
2009-11-24
3
• Na podstawie wyraźnej okresowości
własności fizycznych i chemicznych
przewidział Mendelejew istnienie nie
odkrytych jeszcze pierwiastków
• np. gal , skand , polon
• w szeregi poziome zwane okresami
• w kolumny pionowe zwane grupami
• w miarę wzrostu liczby atomowej następuje
stopniowe zapełnianie powłok elektronowych
atomów
• Rozpoczęciu się nowego okresu odpowiada
zapoczątkowanie zapełniania elektronami nowej
powłoki
• Powtarzanie się podobnej konfiguracji
elektronów w zewnętrznych powłokach jest
przyczyną okresowości właściwości
chemicznych i licznych właściwości fizycznych .
Zawiera symbole pierwiastków chemicznych
ułożone
2009-11-24
4
Układ okresowy pierwiastków ma
• 7 okresów - okresy zawierają różną liczbę
pierwiastków :
- Okres 1 obejmuje tylko 2 najlżejsze
pierwiastki (wodór i hel)
- 2 i 3 liczą po 8 pierwiastków
- okresy 4 i 5 – po 18
- okres 6 ogarnia 32 pierwiastki
- okres 7 (niepełny) liczy dotychczas 25
pierwiastków
• W każdym okresie od strony lewej do
prawej następuje przejście od
pierwiastków silnie elektrododatnich
do silnie elektroujemnych .
• Środek okresu zajmują pierwiastki o
właściwościach pośrednich.
• Okresy (z wyjątkiem 7) kończą się
gazem szlachetnym
2009-11-24
5
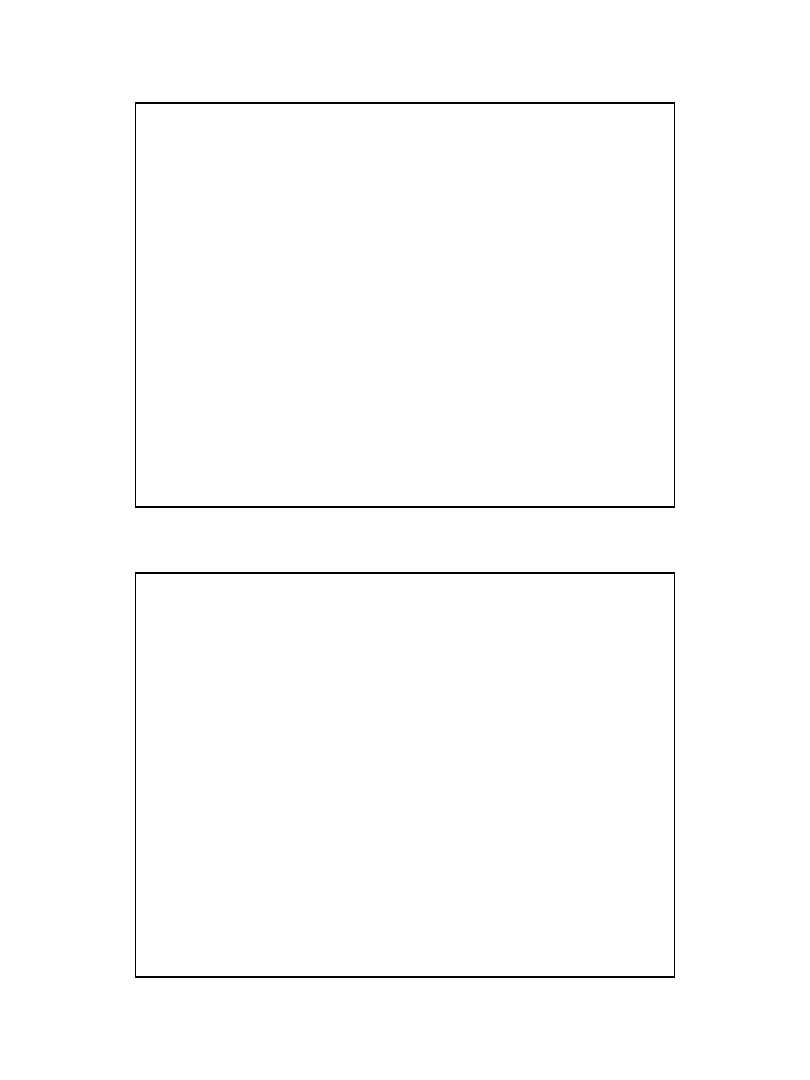
• pierwiastki tworzą 18 grup
• dawniej rozróżniano 8 grup głównie
(oznaczonych w tabeli symbolem A)
• 8 grup pobocznych tak zwanych też
podgrupami lub grupami dodatkowymi
(oznaczonych w tabeli symbolem B)
• Grupa 18 – dawniej VIII głównie
zawierająca gazy szlachetne, też oznaczana
jako grupa zerowa .
W skład 3 grupy (III grupy pobocznej)
wchodzą
• lantanowce w okresie 6
• aktynowce w okresie 7
W obrębie danej grupy pierwiastki mają
analogiczną konfigurację zewnętrzną powłok
elektronowych, różnią się
• liczbą powłok wewnętrznych
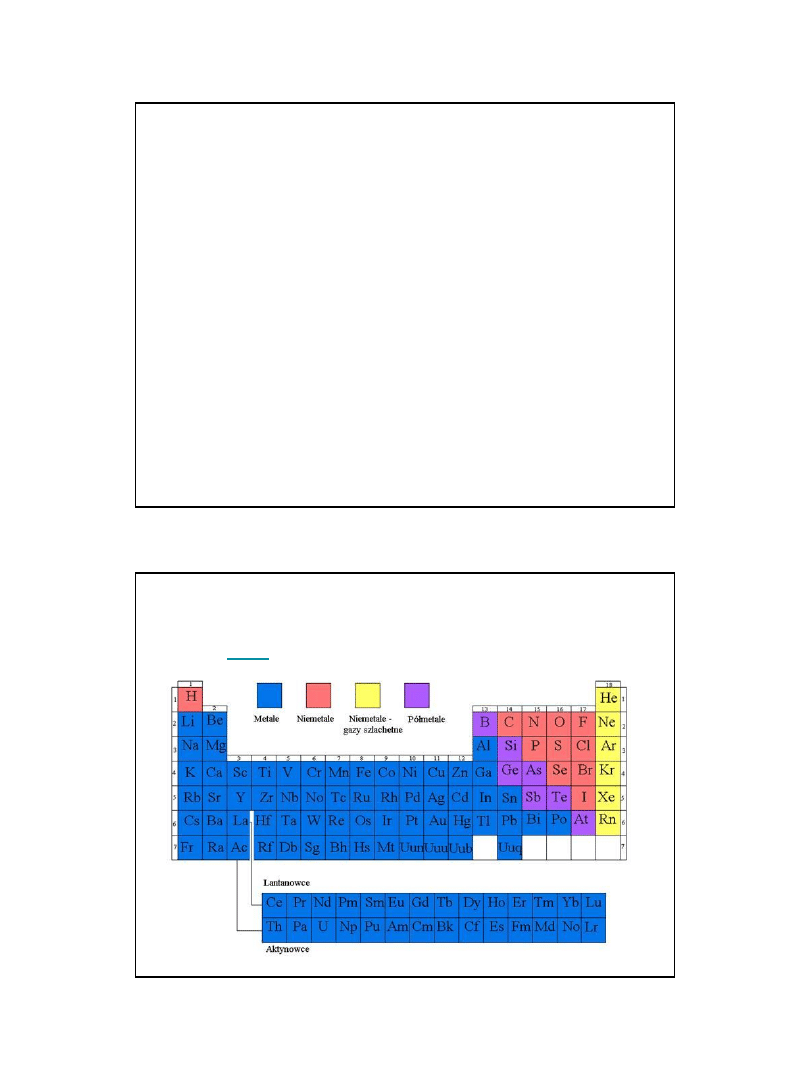
Grupa 1 i 2 oraz 13 – 18 obejmują pierwiastki ,
których atomy mają w najbardziej
zewnętrznych powłokach elektronowych
zapełnione elektronami poziomy energii s i p.
Pierwiastki grupy 3 – 12 (pierwiastki
przejściowe) zapełniają elektronami poziomy
energii d (pierwiastki wenętrznoprzejściowe)
lub f (pierwiastki wewnętrznoprzejściowe) .
2009-11-24
6
Pierwiastki o jednakowej konfiguracji
elektronów walencyjnych wykazują
- podobieństwo właściwości chemicznych,
- występują na takich samych stopniach
utlenienia,
- tworzą związki chemiczne podobnego typu
Nazwy grup tworzy się od nazwy pierwiastka
znajdującego się na początku danej
grupy: litowce (wodór do tej grupy należy
tylko formalnie) , berylowce, borowce
(glinowce), węglowce, azotowce,
tlenowce, fluorowce (chlorowce), gazy
szlachetne itd.
Układ okresowy pierwiastków
chemicznych
– Międzynarodowa Unia Chemii Czystej i Stosowanej
2009-11-24
7
Układ okresowy pierwiastków
•
Elektroujemność pierwiastka (E)
• Elektroujemność to miara tendencji do przyciągania
elektronów przez atomy pierwiastka, gdy tworzy on
związek chemiczny z atomami innego pierwiastka.
• Bardziej elektroujemny pierwiastek "ściąga" do siebie
elektrony tworzące wiązanie z atomem mniej
elektroujemnym, co prowadzi do polaryzacji wiązania.
• W skrajnym przypadku, gdy elektroujemności obu
pierwiastków bardzo się różnią (np. sód i chlor),
dochodzi do pełnego przeskoku elektronów na bardziej
elektroujemny atom, co prowadzi do powstania wiązania.
2009-11-24
8
Elektroujemność pierwiastków jest często zależna
od układu atomów w danym związku, ich stopnia
utlenienia.
• Mimo to zaproponowano wiele sposobów, aby
ilościowo zdefiniować ogólną elektroujemność
pierwiastków.
• Pierwszą taką propozycją była skala Paulinga
oparta na pomiarach energii i polaryzacji wiązań
prostych dwuatomowych związków chemicznych.
• Elektroujemność rośnie ze wzrostem liczby
atomowej w okresach i maleje w grupach
.
Potencjał jonizacji (PJ):
• A + E
1
A
+
+ e
-
• Potencjał jonizacyjny (lub energia jonizacji) atomu -
najmniejsza energia jaką trzeba dostarczyć by
oderwać elektron od atomu znajdującego się w stanie
podstawowym.
• Używa się określenia pierwszy, drugi, trzeci, n-ty
potencjał jonizacyjny oznacza wówczas energię
oderwanie n-tego
elektronu przy wcześniejszym
oderwaniu n -
1 elektronów.

2009-11-24
9
• Kolejne, szczególnie pierwszy, potencjały
jonizacyjne są wielkościami charakterystyczne
dla atomów decydują o ich własnościach
fizycznych i chemicznych -
dlatego podawane są
w tabelach pierwiastków.
• Energię jonizacji podaje się w jednostkach
energii na atom (elektronowolt na atom) lub na
mol atomów (kilodżul/mol) kJ/mol.
Powinowactwo elektronowe(PE)
• B +e
B
-
+ E
2
• Powinowactwo elektronowe to wielkość
charakteryzująca zdolność atomu do przyłączania
elektronu i tworzenia jonu ujemnego (anionu).
Ilościowo określa się je jako energię, która wydziela
się w wyniku tego procesu. Tradycyjnie energię tę
podaje się w elektronowoltach (eV).
• Powinowactwo elektronowe jest pośrednią miarą
elektroujemności pierwiastków chemicznych. Czym
większa wartość powinowactwa tym większa
elektroujemność pierwiastka.
2009-11-24
10
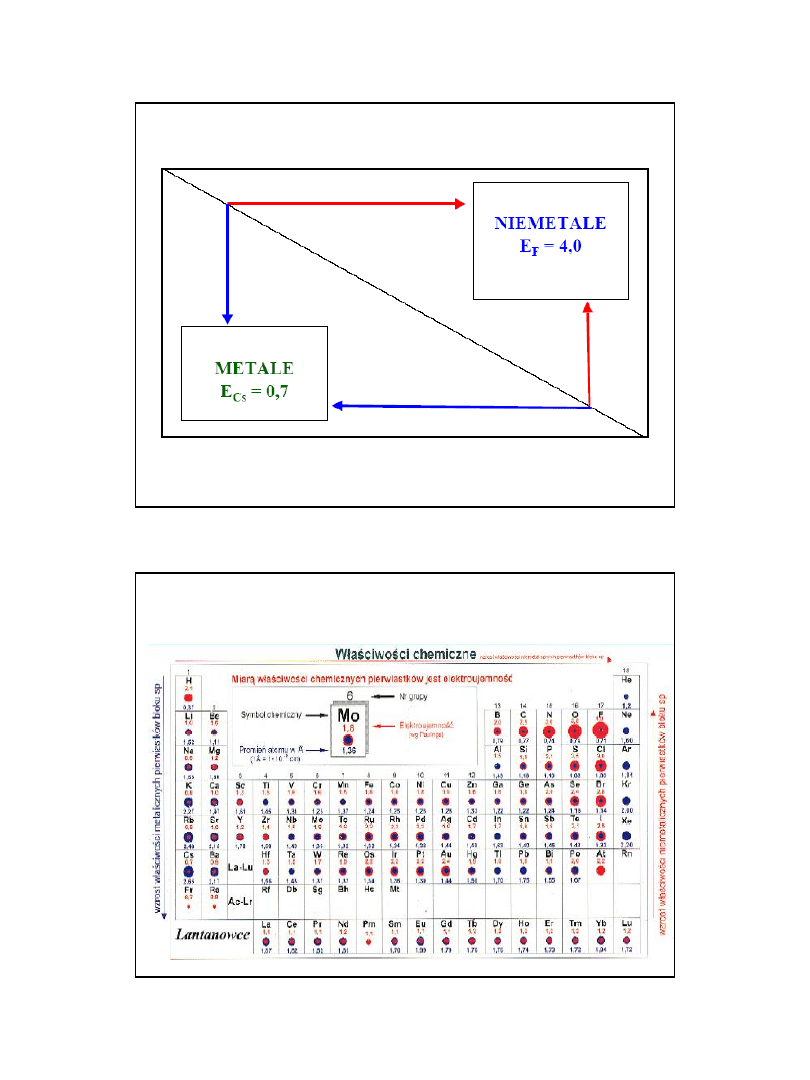
Wzrost elektroujemności, niemetaliczności,
stopni utlenienia
Zmniejszenie elektroujemności,
Wzrost metaliczności, redukcyjności
Właściwości pierwiastków

2009-11-24
11
jeśli znamy konfigurację elektronową atomu
pierwiastka możemy określić jego położenie w
układzie okresowym oraz określić maksymalny i
minimalny stopień utlenienia atomu pierwiastka w
związku chemicznym, np.
Siarka: S 1s2 2s2 2p6 3s2 3p4
maksymalny stopień utlenienia: VI -6
elektronów(oddaje elektrony)
minimalny stopień utlenienia : -II + 2
elektrony(
przyjmuje
elektrony)
Wyszukiwarka
Podobne podstrony:
Walkowiak, Chemia ogólna, Układ okresowy pierwiastków
Chemia Wykład 6 Układ Okresowy Pierwiastków
OZW chemia IV rok 2011 id 34346 Nieznany
Wyklad 6. Uklad okresowy pierwiastkow, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
uklad okresowy a budowa atomu1, przedmioty, chemia
UKŁAD OKRESOWY PIERWIASTKÓW (WERSJA SKRÓCONA) kolor, Dokumenty - chemia
Układ okresowy pierwiastków2, Chemia
Współczesny Układ Okresowy Pierwiastków, Chemia
Układ okresowy pierwiastków, chemia(2)
Chemia Układ okresowy pierwiastków szczegółowy
Uklad okresowy pierwiastków1, Chemia
chemia-uklad okresowy (2) , W 1814r
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
układ okresowy pierwiastków (1), chemia
uklad-okresowy, Chemia
więcej podobnych podstron