Równowagi w układzie węglanowym wody
1. Wstęp.
Woda w swoim obiegu w środowisku w wyniku kontaktu z naturalnymi składnikami
stałymi tworzącymi skorupę ziemską oraz powietrzem dąży do osiągnięcia
równowagi
chemicznej
obecnych
w
wodzie
substancji
rozpuszczonych.
Podstawowym układem tworzącym się w wodach naturalnych jest układ węglanowy.
Woda naturalna w trakcie migracji w środowisku może zmieniać swój skład układu
węglanowego. W wyniku kontaktu z minerałami następują reakcje rozpuszczania,
hydrolizy, karbonatyzacji, utleniania i redukcji, desilikacji. Procesy hydrolizy
minerałów mogą powodować wytworzenie kwasów lub zasad w wodzie
powodujących zmiany w układach węglanowych. Karbonatyzacja powoduje między
innymi wytworzenie węglanów, które w pewnych warunkach ulegają rozpuszczeniu.
2. Równowagi w układzie węglanowym wody.
Naturalnym składnikiem powietrza atmosferycznego jest dwutlenek węgla. Woda
naturalna która jest w kontakcie z powietrzem w warunkach równowagowych to
zawartość dwutlenku węgla rozpuszczonego w wodzie opisuje prawo Henrego
C = Hp
CZ
(1)
c – stężenie rozpuszczonego CO
2
w wodzie
H – stała zależna od temperatury
p
cz
- ciśnienie cząstkowe CO
2
w powietrzu
RT
V
n
p
cz
(2)
n – ilość moli CO
2
V – objętość układu
R – stała gazowa
T – temperatura powietrza
Zawartość rozpuszczonego CO
2
w równowadze z powietrzem atmosferycznym w
zależności od temperatury przykładowo wynosi:
Temperatury
0˚
10˚
20˚
Zawartość CO
2
mg/dm
3
1,00
0,70
0,51
w wodzie

Wynika z powyższego że w przypadku gdy w wodzie stężenie rozpuszczonego CO
2
wynosi powyżej 0,51 mg/dm
3
w 20˚C będzie on desorbował z wody do powietrza do
czasu aż osiągnie stężenia równowagowego wynoszącego 0,51 mg/dm
3
.
Rozpuszczony w wodzie CO
2
reaguje z woda tworząc kwas węglowy
CO
2
+ H
2
O H
2
CO
2
(3)
Równowagę tej reakcji opisuje równanie:
]
[
]
[
2
3
2
0
CO
CO
H
K
(4)
K
0
– stała
[ ] – stężenia substancji, mol/dm
3
Oznaczając kwasowość wody określa się stężenie [H
2
CO
3
]
X
[H
2
CO
3
]
x
= [H
2
CO
3
] + [CO
2
]
(5)
Kwas węglowy jest słabym kwasem. Ulega on dwustopniowej dysocjacji.
H
2
CO
3
H
+
+ HCO
3
-
(6)
Równowagę reakcji (6) opisuje równanie:
]
[
]
][
[
3
2
3
`
1
CO
H
HCO
H
K
(7)
K
1
`
- stała równowagi reakcji
(6)
HCO
3
-
H
+
+ CO
3
2-
(8)

Równanie opisujące równowagę reakcji (8) jest w postaci:
]
[
]
][
[
3
2
3
2
HCO
CO
H
K
(9)
K
2
– stała równowagi i reakcji
(8)
Podstawiając [H
2
CO
3
] z zależności (4) do równania (7) uzyskano równanie (10)
]
[
]
][
[
2
0
3
1
1
CO
K
HCO
H
K
(10)
(11)
Ponieważ w reakcjach biorą udział jony wodorowe to w układzie musi być
zachowana równowaga wynikająca z iloczynu jonowego wody
K
w
= [H
+
] [OH
-
]
(12)
K
w
- iloczyn jonowy wody
W roztworze wodnym ogólne stężenie C
T
form węglanowych opisuje równanie;
C
T
= [H
2
CO
3
] + [HCO
3
-
] + [CO
3
2-
]
(13)
Stężenia poszczególnych form węglanowych określają zależności
[H
2
CO
3
] = α
0
c
T
,
(14)
[HCO
3
-
] = α
1
c
T
,
(15)
[CO
3
2-
] = α
2
c
T
,
(16)
Udziały „α” określa się za pomocą następujących równań:
1
2
2
1
1
0
]
[
]
[
1
H
K
K
H
K
(17)
1
2
1
1
]
[
]
[
1
H
K
K
H
(18)
1
2
1
2
2
3
]
[
]
[
1
K
K
H
K
H
(19)
]
[
]
][
[
2
3
`
1
0
1
CO
HCO
H
K
K
K
W wodach naturalnych występują jony wapnia. Jony wapnia z jonami węglanowymi
tworzą trudnorozpuszczalny osad węglanu wapnia. Wydzielanie osadu występuje
wówczas gdy zostanie przekroczony iloczyn rozpuszczalności węglanu wapnia
J = [Ca
2+
] [CO
3
2-
]
(20)
J – iloczyn rozpuszczalności węglanu wapnia
W przypadku roztworów o wyższym zasoleniu w równaniach należy zamiast stężeń
stosować aktywność jonów
a = f±[c]
(21)
a – aktywność
f± - średni współczynnik aktywności
[c] – stężenie jonów mol/dm
3
W układzie roztworu wodnego powinna być zachowana również równowaga
węglanowo – wapniowa opisana równaniem:
Ca
2+
+ 2HCO
3
-
↔ CaCO
3
+ CO
2
+ H
2
O
(22)
]
][
[
]
][
[
2
3
2
3
2
CO
CaCO
HCO
Ca
K
(23)
]
[
]
[
]
[
]
[
]
][
[
]
[
3
1
2
2
2
3
2
3
HCO
H
K
Ca
CO
HCO
Ca
CaCO
K
K
r
(24)
]
[
]
][
[
3
2
1
H
HCO
Ca
K
K
K
r
s
(25)
pH
s
= - logK
s
– log[Ca] – log[(HCO
3
-
)]
(26)
pH
s
– odczyn równowagi węglanowo wapniowej
[CaCO
3
] – stężenie rozpuszczonej formy CaCO
3
który jest w równowadze z fazą
stałą

Z równania (25) wynika że występuje stan wody naturalnej zależny od temperatury
oraz stężeń jonów wodorowych, wapnia, wodorowęglanów przy którym woda nie
rozpuszcza węglanu wapnia oraz nie wytrąca osadu węglanu wapnia. Wodę
spełniającą te warunki nazywamy „stabilną”.
Zasadowość ogólną można przedstawić Z = C
r
(α
1
+ 2 α
2
) + [OH
-
] – [H
+
] (27)
Z – zasadowość wody mol/dm
3
3. Cel ćwiczenia i zakres ćwiczenia
Celem ćwiczenia jest określenie równowagi węglanowo – wapniowego w roztworze
wodnym z wyjaśnieniem procesów zachodzących w układzie wodnym:
Zakres ćwiczenia
Badanie symulacyjne następujących zjawisk zachodzących w środowisku wodnym
- w układzie wodnym zachodzi hydroliza kwaśna
- w układzie wodnym zachodzi kontakt wody z węglanem wapnia
- w układzie wodnym zachodzi kontakt wody z powietrzem
- w układzie wodnym zachodzi hydroliza zasadowa
4. Przebieg ćwiczenia
Wodę „0” należy rozlać do 4 zlewek po 0,5 dm
3
oraz do cylindra miarowego 1 dm
3
.
Zlewka z wodą „0” (0,5 dm
3
) jest wodą bazową do prowadzenia prób symulacyjnych
nad przemianami zachodzącymi w układzie węglanowym.
a) Stan początkowy wody
Woda „0”
Woda do badań – 0,5 dm
3
Oznaczenia
- odczyn
- zasadowość ogólna
- kwasowość ogólna
- zawartość jonów Ca
2+
- twardość ogólna

b) Symulacja przebiegu hydrolizy kwasnej
Woda „I”
Do 0,5 dm
3
wody 0 dodać dawkę 1,0 mmol/dm
3
kwasu solnego. (0,5 cm
3
1 M HCl)
Po wymieszaniu roztworu oznaczyć:
- odczyn
- zasadowość
- kwasowość
- zawartość jonów Ca
2+
- twardość ogólna
c) Kontakt wody z węglanem wapnia
Woda „II”
Do 0,5 dm
3
wody „0” dodać 2 g CaCO
3
. Następnie zawartość zlewki mieszać przez 1
godzinę po tym czasie pozostawić do 15 minutowej sedymentacji. Klarowną wode
przesączyć przez sączek o średniej gęstości.
W przesączy oznaczyć:
- odczyn
- zasadowość ogólną
- zawartość jonów Ca
2+
- twardość ogólna
d) Kontakt wody z powietrzem atmosferycznym
Woda „III” (x,y) – 1 dm
3
wody „0” w cylindrze miarowym
Wodę „0” napowietrzyć przez okres 0,5 h po tym czasie odlać 0,5 dm
3
a pozostała
0,5 dm
3
napowietrzać dalej przez 0,5 h. Próbę po zakończonym napowietrzania
mieszać przez 15 min a następnie pozostawić do 10 minutowej sedymentacji.
Klarowną ciecz przesączyć przez średni sączek. W przesączu oznaczyć:
- odczyn
- zasadowość ogólną
- kwasowość ogólna

- zawartość jonów Ca
2+
- twardość ogólna
e) Symulacja przebiegu hydrolizy zasadowej
Woda IV – do 2 zlewek rozlać po 0,5 dm
3
wody „0”
Do jednej próbki dodać dawkę NaOH w ilości „z/2” mmol/dm
3
(z – zasadowość wody)
Do drugiej próbki dodać dawkę NaOH w ilości „z/3” mmol/dm
3
Roztwór NaOH 1 M NaOH (1 cm
3
– 1 mmol)
Zawartość zlewek mieszać przez 0,5 h a następnie pozostawić do 15 minutowej
sedymentacji.
Klarowną wodę przesączyć przez sączek o średniej gęstości
W przesączu oznaczyć:
- odczyn
- zasadowość F i M
- zawartość jonów Ca
2+
- twardość ogólną
5. Oznaczenia
Oznaczenia zasadowości i kwasowości wykonać z 50 cm
3
. Oznaczenia zawartości
jonów Ca
2+
oraz twardości ogólnej z 25 cm
3
. Każdę oznaczenie wykonać dwa razy.
Obliczyć błąd względny oznaczenia
W
s
b
a
100
*
a,b – uzyskane wartości
s – średnia arytmetyczna wartości a i b
Jeżeli wartość „w” wynosi poniżej 5% wówczas za wartość przyjąć wartość średnią z
dwóch oznaczeń. Jeżeli wartość „w” wynosi powyżej 5% wówczas należy wykonać
dodatkowe oznaczenia odrzucając wynik oznaczenia odbiegający od dwóch
pozostałych.

7. Opracowanie wyników badań
Uzyskane wyniki przestawić w postaci tabelarycznej
Dla poszczególnych wód na podstawie wykonanych oznaczeń określić w wodzie
stężenia:
Przeliczanie jednostek
Zasadowość –
mval/dm
3
1 mval/dm
3
= 10
-3
mol/dm
3
Kwasowość -
mval/dm
3
1 mval/dm
3
= 10
-3
mol/dm
3
Zawartość Ca
2+
mg Ca
2+
/dm
3
1 mg Ca
2+
/dm
3
-
3
3
/
10
40
1
dm
mol
Twardość ogólna
o
twardości
1
o
tw
-
3
2
3
/
10
6
,
5
1
dm
molMe
Wyniki oznaczeń przedstawić w Tabeli 1.
Na podstawie oznaczenia odczynu określić stężenia [H
+
] i [OH
-
] ([H
+
= 10
-pH
,
równanie 12). Na podstawie równań (17,18,19) obliczyć wartości α
0
, α
1
, α
2
. Ogólne
stężenie form węglanowych „C
T
” obliczyć z równania (27). Znając wartość „α” oraz
„C
T
” obliczyć stężenia form węglanowych (równania 14,15,16).
Na podstawie równania 20 obliczyć wartośc „J”. Na podstawie równania 25 obliczyć
wartość K
s
. Wyniki przedstawić w Tabeli 2.
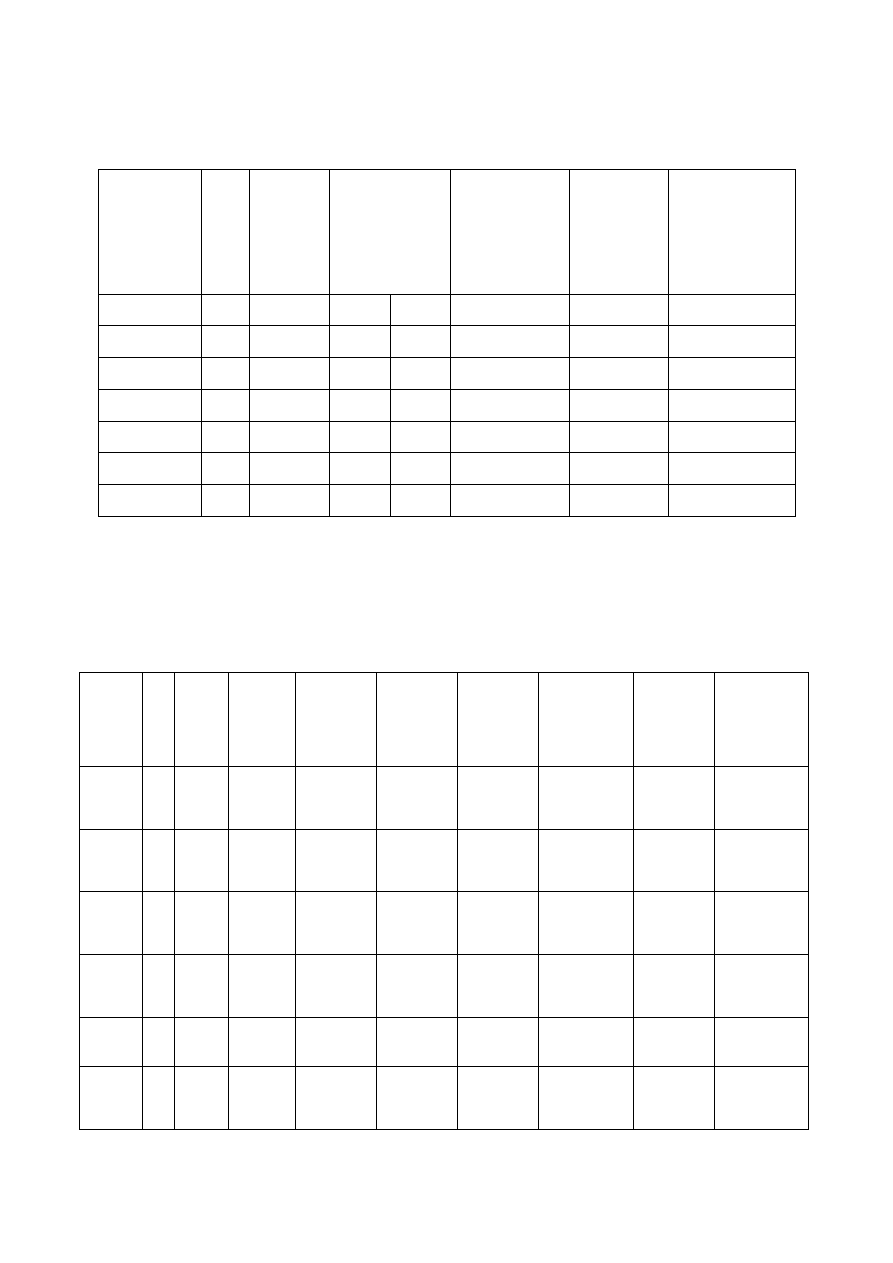
Tabela 1.
Odczyn
pH
Zasadowość
mol/dm
3
F M
Kwasowość
mol/dm
3
Zawartość
Ca
2
mol/dm
3
Twardość
ogólna
Mol Me
2+
/dm
3
Woda 0
Woda I
Woda II
-
Woda III
X
-
Y
-
Woda IV
X
-
y
-
Tabela 2.
[H
+
]
mol/
dm
3
[OH
-
]
mol/
dm
3
[CO
2
]
mol/
dm
3
[HCO
3
-
]
mol/
dm
3
[CO
3
2-
]
mol/
dm
3
[Ca
2+
]
mol/dm
3
J
K
s
Woda
0
Woda
I
Woda
II
Woda
III
Woda
IV
A

B
7. Analiza uzyskanych wyników
Wyszukiwarka
Podobne podstrony:
instrukcja przeciwpozarowa gene Nieznany
Instruktazstanowiskowy id 21769 Nieznany
kolm instrumenty 3 id 239529 Nieznany
cw3 i 4 instrukcja id 123316 Nieznany
CA 6 instrukcja uzytkownika id Nieznany
algorytmy PKI Instrukcja id 577 Nieznany (2)
instrukcja 3 id 215628 Nieznany
instrukcja podstawy AutoCad 1 i Nieznany
Instrukcja 3 2 id 215652 Nieznany
cwiczenie 3 instrukcja id 12533 Nieznany
INSTRUKCJA OBSLUGI VideoPRO 3 4 Nieznany
Lab 06 Instrukcje sterujace id Nieznany
Cwicz 22 2 instrukcja id 124025 Nieznany
więcej podobnych podstron