
Kol
ory
met
ria
Wprowadzenie
Kolorymetria należy do grupy metod spektroskopowych
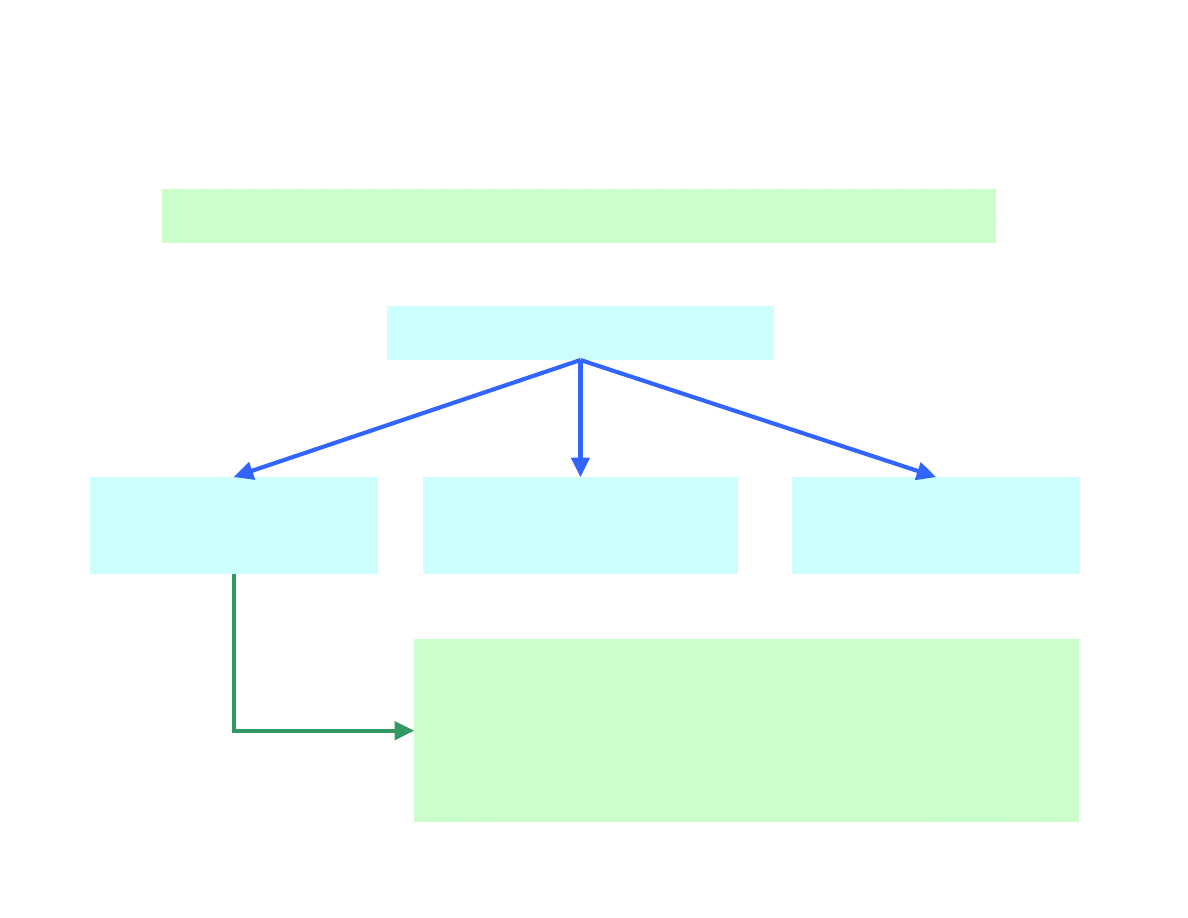
Metody spektroskopowe
metody
absorpcyjne
metody
emisyjne
inne metody
spektroskopowe
- spektrofotometria w nadfiolecie
- spektrofotometria w świetle widzialnym
(kolorymetria)
- spektrofotometria w podczerwieni
podstawa metody -
zależność intensywności zabarwienia roztworu od ilości
(stężenia) pochłaniającej promieniowanie substancji
Metody kolorymetryczne
Kolorymetryczne metody analizy opierają się na tworzeniu
barwnych połączeń przez oznaczany składnik
Należą one do metod bardzo czułych
zakres detekcji 10
-4
- 10
-6
mol/dm
3
dobra precyzja i dokładność pomiarów
duża selektywność zarówno samych substancji oznaczanych,
jak i selektywność odczynników wywołujących zmianę barwy
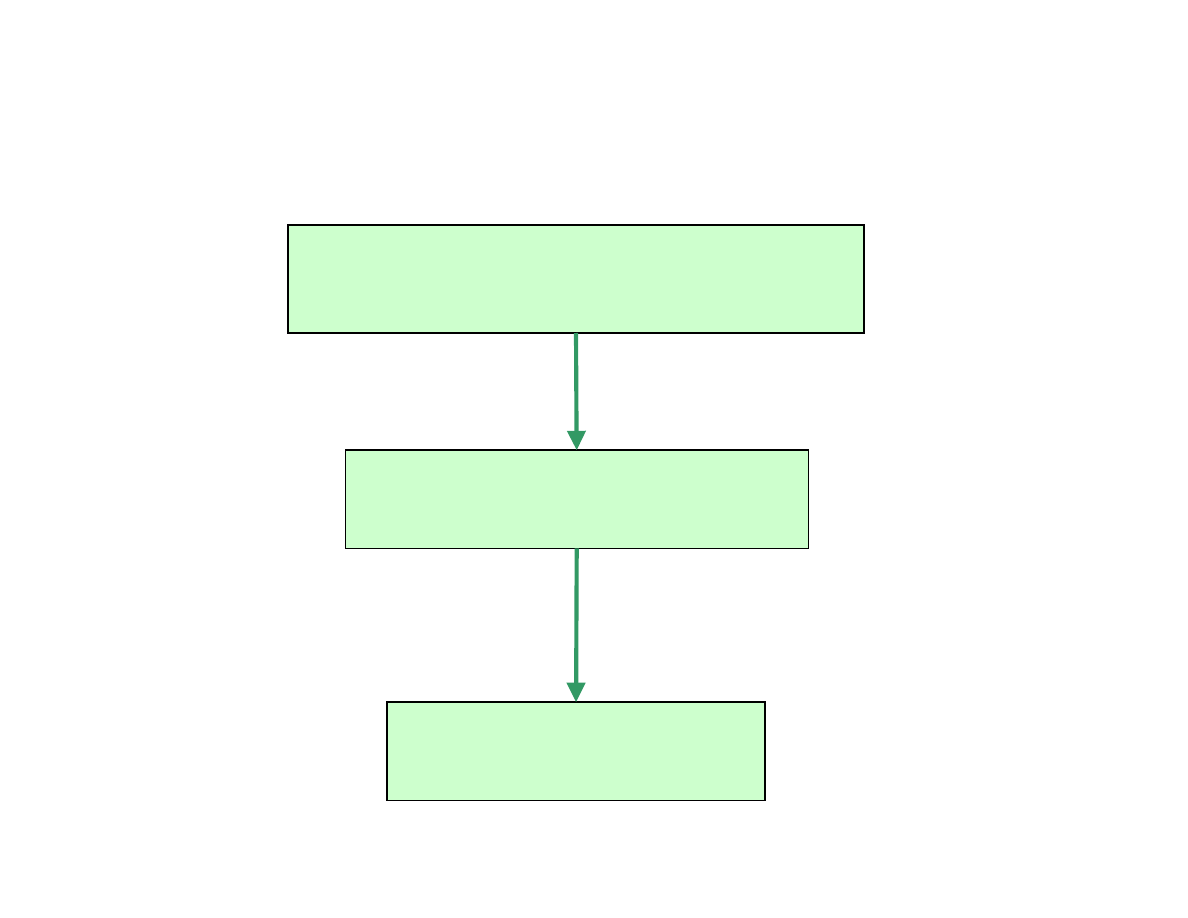
Oznaczenie metodą kolorymetryczną
Metody kolorymetryczne
przeprowadzenie oznaczanego
składnika w związek barwny
pomiar natężenia
barwy

Wiarygodność ilościowych oznaczeń metodą spektroskopową
zależy od spełnienia szeregu warunków takich jak:
• a) dobór odpowiedniego przyrządu, kontrola jego sprawności i
kalibracja zgodnie z instrukcją obsługi,
• b) przygotowanie próbek do pomiaru - roztwór analizowany musi być
jednorodny, substancje koloidalne i nie rozpuszczone należy rozpuścić
albo usunąć z analizowanej próbki, dobrać odpowiedni rozpuszczalnik,
który nie absorbuje promieniowania w badanym zakresie, ustalić
odpowiednie pH,
• c) dobór analitycznej długości fali, czyli długości fali przy której mierzy
się absorbancję substancji badanej.
Metody kolorymetryczne

1) w analizie ilościowej kationów metali
Zastosowanie spektrofotometrii UV/VIS :
2) w analizie ilościowej anionów nieorganicznych
3) w analizie ilościowej związków organicznych
4) do badania równowag reakcji n.p.: wyznaczania stałych
dysocjacji kwasów i zasad, ustalania składu i stałych
trwałości związków kompleksowych
5) w analizie jakościowej

λ
ν
c
h
h
E
⋅
=
⋅
=
gdzie: h - stała Plancka (6,62*10
-34
J· s),
ν - częstotliwość drgań [Hz , 1 Hz = 1 cykl/s],
c - prędkość światła (3*10
5
km/s),
λ - długość fali [nm , µm]
Zmiany energii ∆E w procesie absorpcji lub emisji są wprost
proporcjonalne do częstotliwości drgań (a odwrotnie do
długości fali) promieniowania elektromagnetycznego:
Podstawy teoretyczne
Podstawy teoretyczne
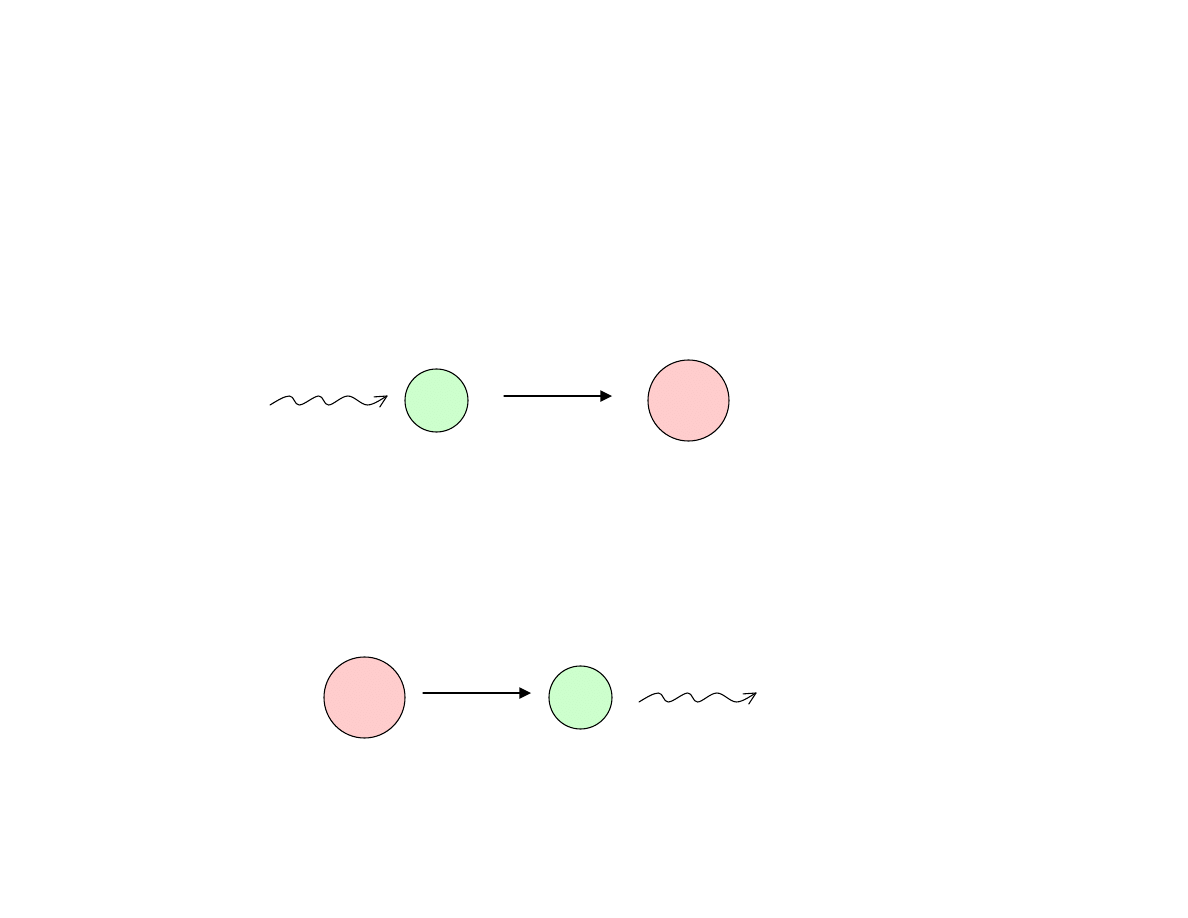
hν
absorpcja promieniowania
Metody spektrofotometrii w świetle widzialnym i nadfiolecie polegają
na pomiarze absorpcji promieniowania elektromagnetycznego.
n
*
stan wzbudzony
n
stan podstawowy
hν
emisja promieniowania
n
*
stan wzbudzony
n
stan podstawowy
Przechodzenie przez roztwór promieniowania ultrafioletowego
(UV) czy widzialnego (VIS) może wywołać w cząsteczkach
absorbujących przejścia
elektronów
pomiędzy poziomami
zewnętrznych (
walencyjnych
) powłok elektronowych
warunek konieczny
odpowiednia porcja energii
Podstawy teoretyczne

Prawa absorpcji i zakres ich stosowalności
Wszystkie rozważania dotyczące pomiarów spektrofotometrycznych
dotyczą wiązki równoległej promieniowania monochromatycznego
(o tej samej częstotliwości), o natężeniu promieniowania I
0
.
Jeżeli ośrodkiem pochłaniającym są: ciecz lub gaz, odległość b - to
odległość między wewnętrznymi, płaskimi i równoległymi ścianami
naczynia (kuwety), w którym znajduje się badana ciecz lub gaz.
Absorpcja promieniowania zależy od grubości warstwy - parametr b
Jeżeli ośrodkiem pochłaniającym jest ciało stałe, to odległość
b jest odległością pomiędzy dwiema płaskimi, równoległymi
powierzchniami tego ciała.
Prawa
absorpcji
ś
wiatła
dotyczą
zależności
natężenia
ś
wiatła
przechodzącego I
t
od natężenia światła padającego I
0
oraz od grubości
warstwy pochłaniającej i (dla roztworów ) od stężenia. Zależności te w
odniesieniu do grubości warstwy pochłaniającej podali Bouger i Lambert,
a w odniesieniu do stężenia Beer.
Jeżeli wiązka promieniowania o natężeniu początkowym I
0
pada na
ośrodek pochłaniający, to część promieniowania zostaje rozproszona (I
r
),
część pochłonięta (I
a
), a część przejdzie przez ośrodek (I
t
). Można więc
zapisać bilans:
I
0
= I
r
+ I
a
+ I
t
I
r
< 4 %, ponadto pomiaru dokonuje się
w taki sam sposób (I
r
=const.)
Prawa absorpcji i zakres ich stosowalności
I
0
= I
a
+ I
t

Połączone prawo Bougera -Lamberta -Beera
abc
t
I
I
−
⋅
=
10
0
Natężenie
promieniowania
monochromatycznego
przechodzącego przez ośrodek absorbujący jest wprost
proporcjonalne do natężenia światła padającego i maleje
wykładniczo przy liniowym wzroście grubości warstwy i
stężenia .
T
I
I
t
=
0
transmitancja
(przepuszczalność)
jaka część promieniowania
padającego została przepuszczona
przez ośrodek pochłaniający
Transmitancję można wyrazić w procentach lub przy pomocy
ułamka dziesiętnego. Skala transmitancji jest więc skalą liniową od
0 % do 100 %.
abc
T
I
I
t
=
=
1
lg
lg
0
Absorbancja roztworu zmienia się logarytmicznie od 0 do ∝,
przy czym transmitancji 100 % odpowiada absorbancja równa 0.
Prawo Bougera-Lamberta-Beera
A
c
b
I
I
A
t
⋅
⋅
=
=
ε
0
lg
molowy współczynnik
absorpcji
grubość warstwy
absorbującej (w cm)
stężenie roztworu
najczęściej w mol/dm
3
absorbancja
(ekstynkcja)

Jeżeli w roztworze o grubości warstwy b znajdują się
dwie
pochłaniające
substancje,
dla
których
współczynniki
absorpcji
i
stężenia
wynoszą
odpowiednio ε
1
i c
1
oraz ε
2
i c
2
, to absorbancja takiego
roztworu jest równa sumie absorbancji obu składników i
wynosi:
Prawo addytywności absorpcji
A= b⋅(ε
1
⋅c
1
+ ε
2
⋅c
2
)
Większość pomiarów spektrofotometrycznych wykonuje
się w roztworach.
Najlepsze rozpuszczalniki stosowane do pomiarów w UV/VIS
- etery
- alkohole
- nasycone węglowodory
W zakresie widzialnym można stosować dowolne,
czyste i bezbarwne rozpuszczalniki pod warunkiem,
ż
e nie reagują one z rozpuszczoną substancją badaną.
H
2
O
nie absorbuje ona w zakresie UV/VIS
powszechnie stosowany rozpuszczalnik
Warunki pomiarów

Przy
ocenie
i
wyborze
metody
oznaczenia
spektrofotometrycznego powinno brać się pod uwagę cały
szereg czynników, które wpływają na czułość, dokładność i
przebieg spektrofotometrycznych oznaczeń pośrednich:
Wybór metody
1) o czułości metody decyduje wielkość molowego
współczynnika absorbancji
2) niezmienność absorbancji w czasie,
3) należy wybierać metody, w których absorbancja w
najmniejszym stopniu zależy od pH roztworu.
Pomiary względne można realizować przez
porównanie z wzorcami różnymi metodami:
a) metodą krzywej kalibracyjnej ( metodą kalibracji )
b) metodą dodawania wzorca
c) metodą wzorca wewnętrznego
Wybór metody
gdzie:
Y - oznacza wielkość mierzoną,
c - stężenie analitu,
m - współczynnik,
b - wartość stała, będącą często wartością
eksperymentalną ślepej próby.
Y = m⋅c + b
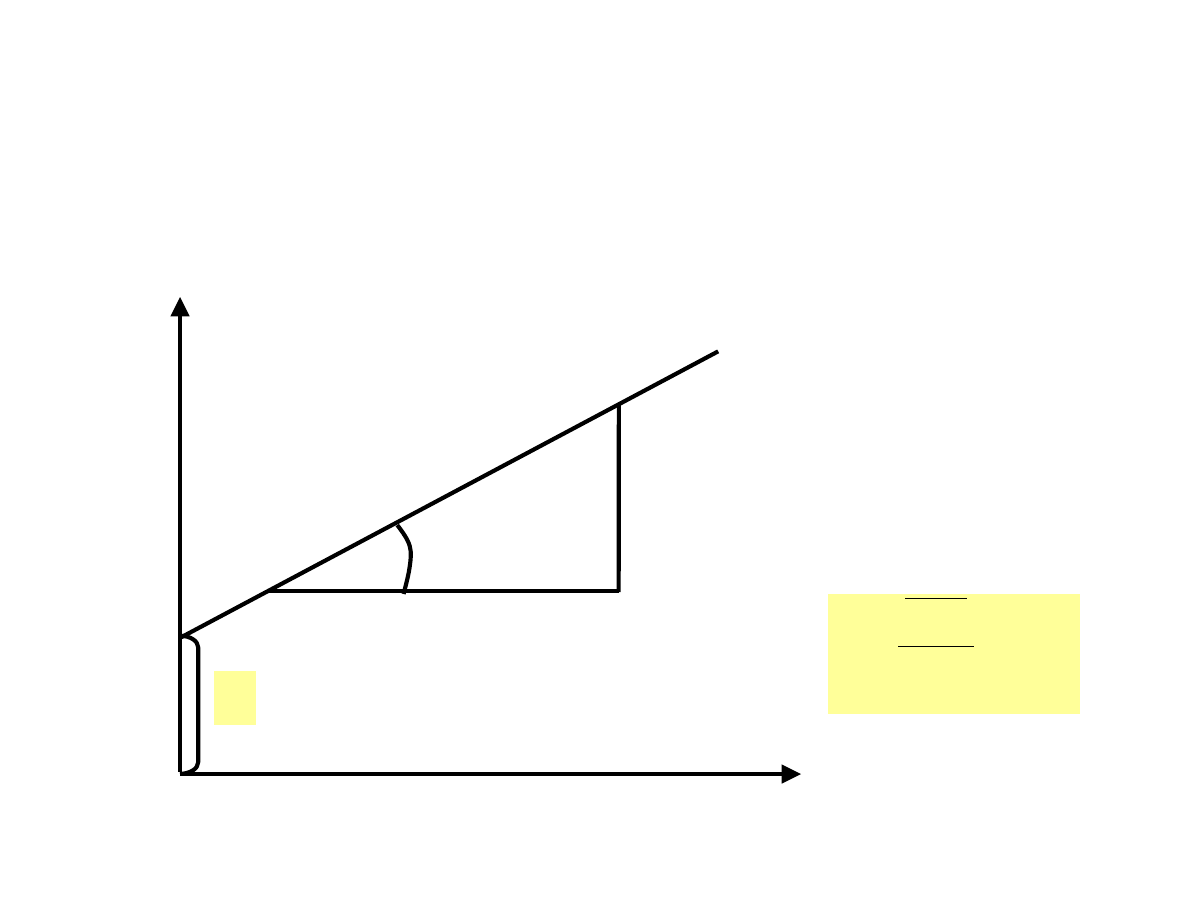
Metoda krzywej kalibracyjnej (wzorcowej)
Równanie przedstawiające liniową zależność wielkości
mierzonej jako funkcję stężenia analitu Y = m⋅c, można
przedstawić w postaci bardziej uogólnionej:
Wartość ślepej próby jest to wartość mierzona zgodnie z
procedurą dla próbki, w której znajdują się wszystkie
składniki z wyjątkiem analitu.
Y
0
α
α
α
α
M
N
L
α
tg
_____
=
=
LM
MN
m
b
c
Współczynnik proporcjonalności
m jest nachyleniem krzywej
kalibracyjnej
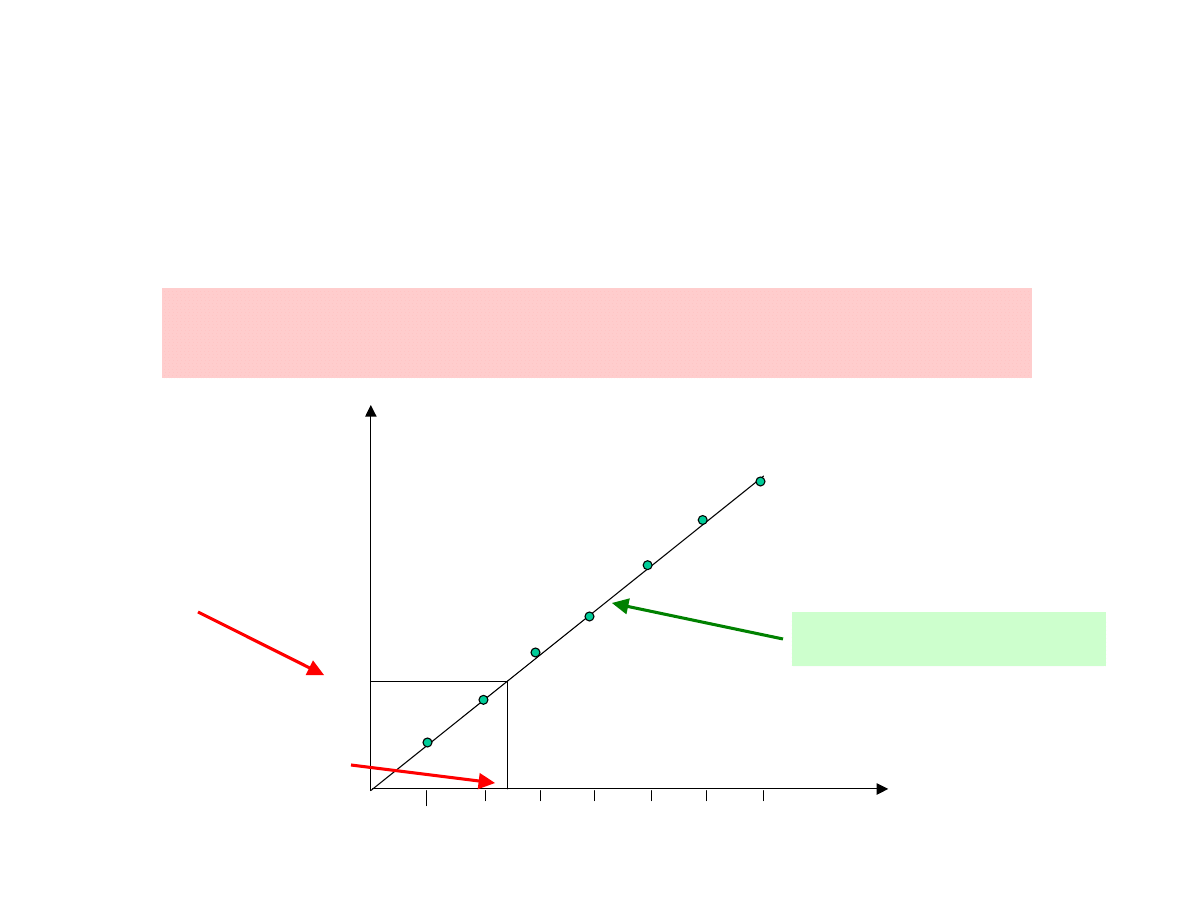
Przygotowuje się roztwory wzorcowe o stężeniu analitu:
0 (ślepa próba), 1, 2, 3, 4, 5 i dla każdego roztworu mierzy się
wartość Y. Następnie wykreśla się krzywą kalibracyjną
Metoda krzywej kalibracyjnej (wzorcowej)
UWAGA !!! Wzorce i analit powinny być przygotowywane w
takim samym środowisku
)
krzywa kalibracyjna
Y
c
1
2
3
4
5
6
7
c
x
Y
x
Dla próbki badanej x
mierzy się wartość Y
x
z krzywej kalibracyjnej
odczytuje stężenie c
x
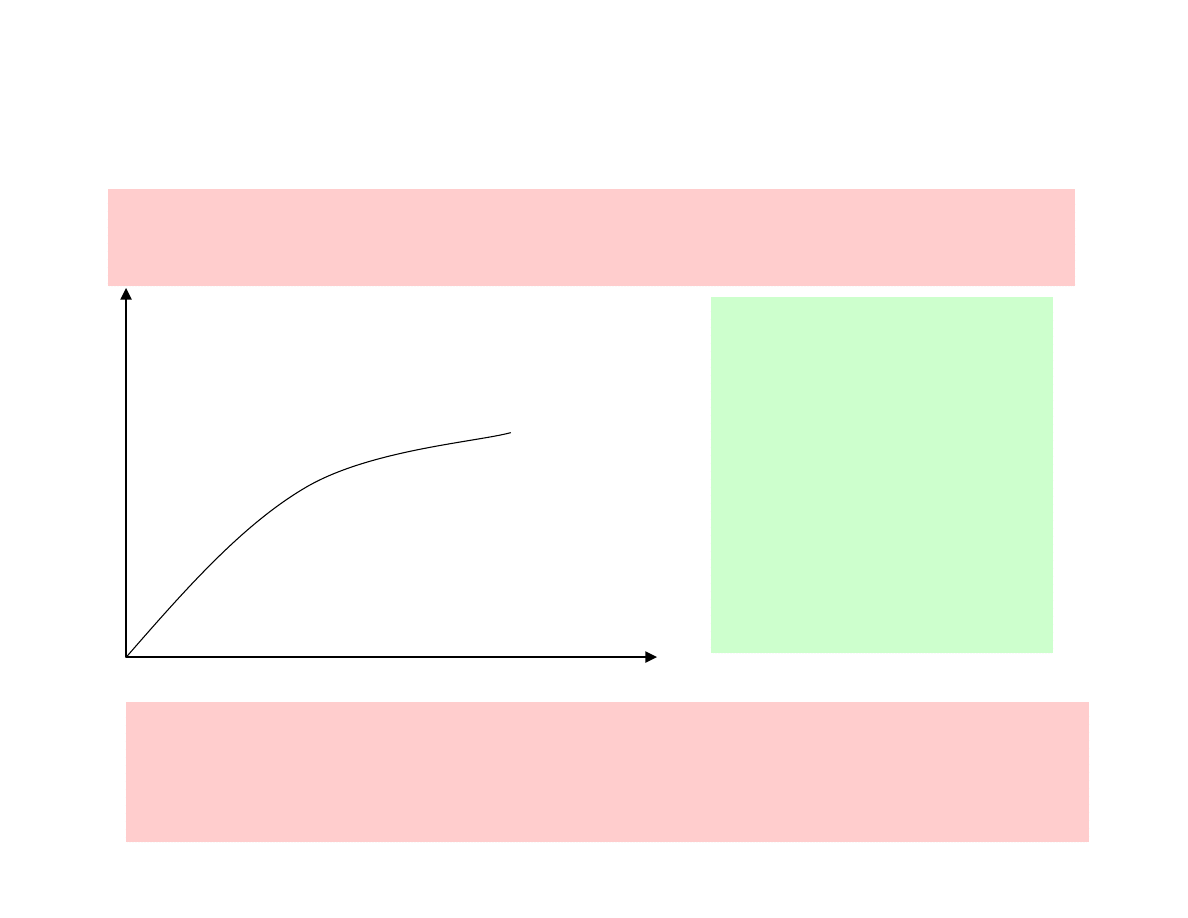
Aby pomiary przy użyciu krzywej kalibracyjnej dawały
prawidłowe wyniki, należy zdawać sobie sprawę z tego, że:
b) na wartość wielkości mierzonej może mieć duży wpływ
matryca, tzn. wszystkie te substancje, które znajdują się w
analizowanej próbce obok analitu.
0-a
- występuje
liniowa zależność Y
od c,
a-b
- w miarę wzrostu
stężenia analitu
obserwujemy wzrost
krzywizny dla
zależności Y od c.
Y
c
a
b
0
a) krzywa kalibracyjna ma ograniczony zakres prostoliniowości,
tak jak na rysunku
Metodę kalibracji można zastosować w postaci skróconej
gdy w równaniu:
Y = m⋅c + b
b=0
w
w
c
c
Y
Y
=
w
w
Y
c
Y
c
⋅
=
Wykonujemy wówczas tylko dwa pomiary:
1) dla próby badanej Y
Y = m· c
2) dla wzorca Y
w
Y
w
= m· c
w
Metoda krzywej kalibracyjnej (wzorcowej)
wersja uproszczona
Uwaga!!!
Na podobnej zasadzie oparta jest metoda dodatku wzorca
Wyszukiwarka
Podobne podstrony:
101 Garb zniewolenia sowieckiegoid 11503 ppt
Mazowieckie Studia Humanistyczne r1998 t4 n1 s79 101
BTChwyklad 011
1998 (101)
BTChwyklad 141a
101 Rodzaje programów telewizyjnych IIid 11554
101 102
01 2006 100 101
Urządzenia 101 - parametry łączników protokół (tylko dla ZAO, Politechnika Lubelska, Studia, semestr
Podstawy elektroniki str 101 141
101 Łuk trójprzegubowy
highwaycode pol c17 tory tramwajowe (s 100 101, r 300 307)
2007 l 101 l 10120070418pl00110013
BTChwyklad 062
alle (101)
1 XII W materialoznawstwoid 101 Nieznany (2)
BTChwyklad 022
więcej podobnych podstron