
(12)
TŁUMACZENIE PATENTU EUROPEJSKIEGO
(19) PL
(11)
(13)
T3
(96)
Data i numer zgłoszenia patentu europejskiego:
01.08.2005 05016712.1
RZECZPOSPOLITA
POLSKA
Urząd Patentowy
Rzeczypospolitej
Polskiej
(97)
O udzieleniu patentu europejskiego ogłoszono:
26.09.2007 Europejski Biuletyn Patentowy 2007/39
EP 1757276 B1
(51) Int. Cl.
A61K9/51
A61K9/50
(2006.01)
(2006.01)
(54) Tytuł wynalazku:
Sposób otrzymywania nano-i-mikrokapsułek z białka pajęczego jedwabiu
(30)
Pierwszeństwo:
(43)
Zgłoszenie ogłoszono:
28.02.2007 Europejski Biuletyn Patentowy 2007/09
(45)
O złożeniu tłumaczenia patentu ogłoszono:
29.02.2008 Wiadomości Urzędu Patentowego 02/2008
(73) Uprawniony z patentu:
Technische Universität München, München, DE
(72) Twórca (y) wynalazku:
Scheibel Thomas, München, DE
Bausch Andreas, München, DE
Huemmerich Daniel, Mintraching, DE
Hermanson Kevin, Cincinnati, US
PL/EP 1757276 T3
(74) Pełnomocnik:
WTS Rzecznicy Patentowi
rzecz. pat. Witek Rafał
53-114 Wrocław
ul. R. Weigla 12
Uwaga:
W ciągu dziewięciu miesięcy od publikacji informacji o udzieleniu patentu europejskiego, każda osoba może wnieść do Europejskiego Urzędu Patentowego sprzeciw
dotyczący udzielonego patentu europejskiego. Sprzeciw wnosi się w formie uzasadnionego na piśmie oświadczenia. Uważa się go za wniesiony dopiero z chwilą
wniesienia opłaty za sprzeciw (Art. 99 (1) Konwencji o udzielaniu patentów europejskich).

PZ/0505/RW
EP 1 757 276 B1
1
Opis
[0001] Niniejszy wynalazek dotyczy sposobu otrzymywania nano- oraz mikrokapsułek z
białek pajęczego jedwabiu. Ponadto, wynalazek związany jest z nano- lub mikrokapsułkami
uzyskiwanymi tym sposobem, jak również zawierającymi je farmaceutycznymi,
kosmetycznymi i żywnościowymi kompozycjami.
[0002] Struktury o małych rozmiarach cieszą się dużym zainteresowaniem jako pęcherzyki
transportowe oraz jako potencjalne bloki budujące w przyszłych zastosowaniach. Jednym z
ich zadań jest możliwość kapsułkowania substancji reagujących lub cząstek o małych
rozmiarach oraz umożliwienie rozpoczęcia uwalniania zakapsułowanej substancji, po
umieszczeniu ich w określonych warunkach. Rozwiązaniem takiego problemu jest
zastosowanie pęcherzyków chemicznych, tak zwanych nano-kapsułek. Nano-kapsułki
zaprojektowane są do uwalniania znajdujących się wewnątrz substancji reagujących pod
wpływem zewnętrznego elementu rozpoczynającego uwalnianie lub bodźca. Z zagadnieniem
tym związanych jest kilka problemów: najważniejszym jest otrzymanie takich nano-kapsułek
w zdefiniowany sposób otaczających, np. chemicznie lub biologicznie aktywne substancje.
[0003] Ostatnio, w odpowiedzi na taką potrzebę, rozwijano „hybrydowe”, odpowiadające na
bodziec nano-kapsułki. Struktury (pęcherzyki, lecz również micele) uzyskano z
samogrupujących się np. diblokowych kopolimerów kwasu amfifilo-polibutadieno (PB)-b-
poli(glutaminowego) (PGA), o konformacji wrażliwej na pH. Wrażliwość na pH może być
wykorzystana do procesu rozładowania pęcherzyków. Kopolimery PB-b-PGA zawierające
usieciowany blok hydrofobowy i hydrofilowy blok peptydowy zsyntetyzowano poprzez
połączenie anionowej i otwierającej pierścień polimeryzacji (Chécot et al., 2003).
Polidyspersyjność kopolimerów jest wystarczająco mała by uzyskać dobrze zdefiniowane,
samogrupujące się agregaty. Na przykład, kopolimer PB40-b-PGA 100 w wodzie tworzy
ścisłe, dwuwarstwowe pęcherzyki zwane polimersomami (Won et al., 1999). Jedną z
właściwości tych pęcherzyków jest to, że odpowiadają zmianą wielkości na przesunięcie pH
środowiska na zewnątrz (Figura 1). Takie przejście pod wpływem zmian pH jest odwracalne i
tylko umiarkowanie wrażliwe na zasolenie, nie bazuje zatem na prostym efekcie
polielektrolitowego zwiększenia objętości, ale na peptydowym charakterze bloku PGA
(Figura 1). Takie pęcherzyki są w stanie służyć nie tylko jako kapsułki dla związków
niskocząsteczkowych (jak cząsteczki rozpuszczalnika, takie jak fluorofory (Chécot et al.,
2003)), lecz również mogą stabilizować większe nanoczasteczki. Wadą takich systemów jest
częściowy brak kompatybilności z układami biologicznymi, które zazwyczaj są bardzo

PZ/0505/RW
EP 1 757 276 B1
2
wrażliwe na silne zmiany pH, ze względu na to, że takie zmiany pH mogą powodować utratę
aktywności biologicznej kapsułkowanej próbki.
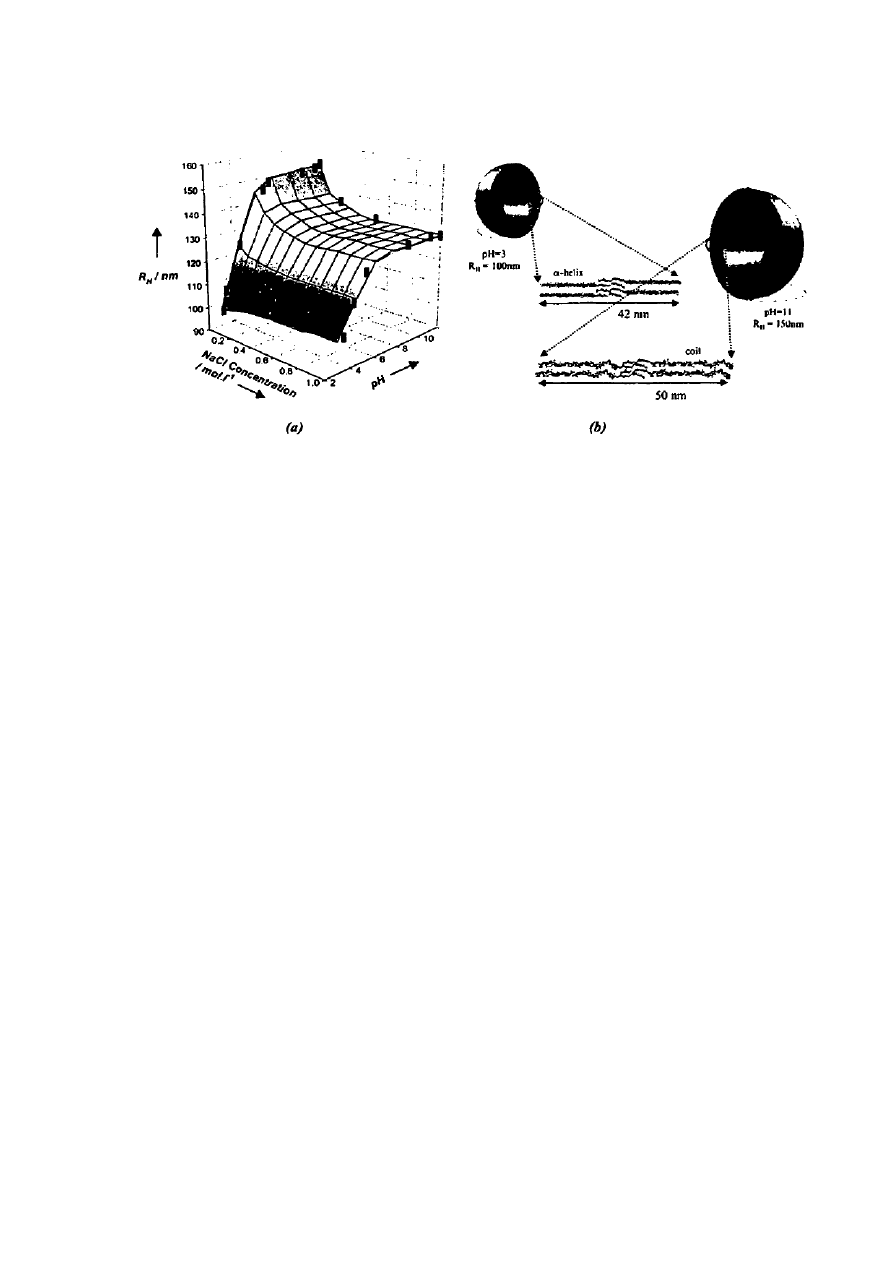
[0004] Na Figurze 1 przedstawiono dla zobrazowania (a) dynamiczne rozproszenie światła
hydrodynamicznego promienia R
H
peptosomu w funkcji stężenia NaCl i pH. (b)
Schematyczne przedstawienie peptosomu i zmian jego wielkości w funkcji pH, z powodu
zwinięcia i przejścia w drugorzędową strukturę
α-helisy części peptydu.
[0005] Inną znaną metodą kapsułkowania jest samogrupowanie się cząstek koloidalnych na
powierzchni styku faz olej/woda. Siła prowadząca proces samogrupowania wynika z
minimalizacji całkowitej energii powierzchniowej – przez co może być użyty szeroki
wachlarz cząstek i rozpuszczalników. Takiego typu stabilizowane emulsje dobrze znane są
jako emulsje Pickering. Stabilizacja lub sieciowanie cząstek prowadzi do mechanicznie
stabilnych jednostek, które następnie mogą być przeniesione do fazy ciągłej. Zaletą tak
zwanych koloidosomów jest kontrola substancji zawartej w środku oraz łatwość regulowania
mechanicznej i chemicznej stabilności zewnętrznej otoczki. Samogrupowanie się cząstek daje
w wyniku strukturę niemal krystaliczną, przez co występują w niej otwory pomiędzy
cząstkami. Otwory te stanowią wybiórczy rozmiarowo filtr, który umożliwia kontrolę
procesu dyfuzji przez membranę (Dinsmore et al., 2000). Cały proces może być
przeprowadzony w sposób biokompatybilny. Jednakże, same cząstki koloidalne nie
koniecznie są biokompatybilne.
[0006] W US 6 303 150 opisano nanokapsułki o ściankach z sieciowanych białek. Białko
musiało wykazywać efekt tworzący film i wybrane było z grupy białek roślinnych lub
zwierzęcych, jak np. jedwab. Czynnik sieciujący był konieczny do otrzymania ścian kapsułek.
[0007] W WO 02/47665 opisano sposób otrzymywania samogrupujących się, wybiórczo
przepuszczalnych, elastycznych, mikroskopowych struktur, odnoszących się do
koloidosomów, które posiadają kontrolowany rozmiar porów, porowatość i korzystne
właściwości mechaniczne. Sposób obejmuje: (a) dostarczenie cząsteczek utworzonych z
materiału biokompatybilnego w pierwszym rozpuszczalniku; (b) utworzenie emulsji poprzez
dodanie pierwszej cieczy do wspomnianego pierwszego rozpuszczalnika, wspomniana
emulsja jest zdefiniowana przez krople wspomnianej pierwszej cieczy otoczone przez
wspomniany pierwszy rozpuszczalnik; (c) opłaszczenie powierzchni wspomnianych kropel
wspomnianymi cząsteczkami; oraz (d) stabilizację wspomnianych cząstek na powierzchni
wspomnianej kropli w celu utworzenia koloidosomów posiadających wytrzymałość na siłę
przynajmniej około 20 Paskali. W WO 02/47665 do produkcji opisywanych koloidosomów
zastosowano biokompatybilne, syntetyczne polimery. Przykładem jest polistyren,

PZ/0505/RW
EP 1 757 276 B1
3
polimetylometakrylan, polialkileny, krzemionka i ich kombinacje. Cząstki, z których
uzyskiwano koloidosomy stabilizowano na przykład poprzez spiekanie, sieciowanie
chemiczne i tym podobne. Jednakże, sposób otrzymywania wspomnianych koloidosomów
jest współmiernie trudny a stosowane cząstki koloidowe mogą wykazywać szkodliwe
właściwości w zastosowaniach in vivo ze względu na ich syntetyczny i nienaturalny charakter.
Zastosowanie koloidalnych cząstek ogranicza również zakres wielkości otoczek, ponieważ
użycie koloidów ogranicza minimalna wielkość torebki o zdefiniowanych otworach.
[0008] Istnieje zatem, problem przedstawiony w niniejszym wynalazku polegający na
dostarczeniu nano- i mikrokapsułek silnie biokompatybilnych, a zatem odpowiednich do
zastosowań in vivo. Innym problemem związanym z niniejszym wynalazkiem jest uzyskanie
nano- i mikrokapsułek, które są zdolne przyjmować różne rodzaje i zmienne ilości
składników aktywnych lub odżywczych, tj., które pozwalają na kontrolowane uwalnianie
wspomnianych składników aktywnych itp. in vivo, na przykład w zastosowaniach
miejscowych lub układowych.
[0009] Problemy te zostały rozwiązane w niniejszych zastrzeżeniach niezależnych. Korzystne
realizacje przedstawiono w zastrzeżeniach zależnych.
[0010] W niniejszym wynalazku, zaskakująco okazało się, że białka jedwabiu pajęczego
mogą służyć jako podstawa do formowania mikro- i nanokapsułek, które mogą znaleźć różne
zastosowania in vivo. W szczególności, okazało się, że mogą być uzyskane za pomocą
ulepszonego sposobu produkcji wspomnianych kapsułek, który nie wymaga stosowania etapu
łączenia lub stabilizowania cząsteczek, z których tworzone są kapsułki, przez dodatek
odczynników chemicznych, jak czynniki sieciujące lub, które wymóg spiekania, lub innych,
które mogą wywierać szkodliwy wpływ na środki upakowane w środku wspomnianych
mikro- i nanokapsułek.
[0011] Ponieważ najnowsze stosowane techniki kapsułkowania (patrz na przykład WO
02/47665) opierają się na cząsteczkach niebiologicznych lub makromolekułach, Twórcy
rozwinęli nowy, stabilny proces kapsułkowania, oparty na samoskładających się białkach
jedwabiu pajęczego. Inaczej, niż pozostałe techniki kapsułkowania, w niniejszym sposobie
hydrofobowy/hydrofilowy charakter powierzchni emulsji nie tylko został wykorzystany do
zebrania cząsteczek koloidu, ale wykorzystano również siłę prowadzącą do immobilizacji
koloidu poprzez koalescencję i tworzenie sieci polimerowej (stabilizację). Proces ten jest nie
tylko sposobem otrzymywania polimerowych nano- i mikrokapsułek utworzonych z nowej
klasy biokompatybilnych koloidów, ale stanowi również nowe podejście do otrzymywania
sieci polimerowej z zastosowaniem białek. Dużą zaletą nano- i mikrokapsułek utworzonych

PZ/0505/RW
EP 1 757 276 B1
4
za pomocą niniejszego sposobu jest ich biokompatybilność i funkcjonalność nadana
kapsułkom przez białka. Umożliwia to kontrolę mechanizmu uwalniania za pomocą kilku
środków: zmian pH, zmian temperatury lub aktywności proteaz.
[0012] Na przykład, nano- i mikrokapsułki mogą być zniszczone a ich składniki uwolnione in
vivo chemicznie, fizycznie (na przykład przez siły rozrywające) lub biologicznie (przez
trawienie proteolityczne).
[0013] Samoskładanie białek jedwabiu pajęczego na styku powierzchni osiągnięto poprzez
wprowadzenie białka do fazy wodnej w emulsji woda/olej (patrz Figura 2). Minimalizacja
energii powierzchniowej skierowała białka na styk powierzchni i spowodowała agregację
monomerów, prowadzącą do utworzenia gęstej sieci polimerowej (Figura 3).
[0014] Powstałe w tym procesie torebki/baloniki wypełniane są na przykład zawartością fazy
wodnej i mogą przebywać w rozpuszczalnikach organicznych, alkoholach, jak również w
wodzie (Figura 3). Zatem, wykazują nieoczekiwaną stabilność w znacznie różnych
środowiskach. Istotnie, samo składanie białek na odwrotnej powierzchni emulsji jest również
możliwe – dlatego możliwe jest kapsułkowanie zawartości fazy olejowej (patrz również
poniżej).
[0015] Zadziwiająco, torebki/baloniki mogą zostać wypełnione białkami, odczynnikami
chemicznymi, cząsteczkami o rozmiarach nano- i mikrometrowych, itp., co przykładowo
przedstawiono poprzez wypełnienie cząstek cząsteczkami znakowanego fluorescencyjnie
(FITC) dekstranu (Figura 4).
[0016] Nieprzepuszczalność membrany i mechaniczna stabilność torebek wobec stresu
osmotycznego są, biorąc pod uwagę grubość membrany, względnie wysokie. Obrazy z
mikroskopu elektronowego ujawniają, że grubość ta wynosi między 10 a 70 nm (Figura 5).
[0017] W niniejszym podejściu, w celu osiągnięcia biologicznego zakapsułkowania
składników aktywnych, wykorzystano syntetyczne białka jedwabiu pajęczego, w
szczególności zastosowano syntetyczną sekwencję C
16
(Huemmerich et al., 2004).
[0018] Ogólnie, jedwabie pajęcze są polimerami białkowymi wykazującymi nadzwyczajne
właściwości fizyczne, jednak informacje na temat składu różnych jedwabi produkowanych
przez różne pająki są ograniczone (patrz Scheibel, 2004). Wśród rożnych typów jedwabi
pajęczych, najintensywniejsze badania prowadzone były nad niciami pajęczymi ze złotego
pająka jedwabnego Nephila clavipes oraz z krzyżaka ogrodowego Araneus diadematus.
Jedwabie z białkiem nici pajęczej składają się ogólnie z dwóch głównych białek i pozostaje
niejasnym czy dodatkowe białka odgrywają istotną rolę w wytwarzaniu i końcowej strukturze

PZ/0505/RW
EP 1 757 276 B1
5
jedwabiu. Dwoma głównymi składnikami białkowymi nici z Araneus diadematus są ADF-3 i
ADF-4 (Araneus Diadematus Fibroin).
[0019] Geny kodujące białka podobne do jedwabiu pajęczego otrzymywano stosując strategię
klonowania, opartą na kombinacji modułów syntetycznego DNA i sekwencji naturalnego
genu, amplifikowanego PCR (Huemmerich et al., 2004). Białka nici jedwabnych ADF-3 i
ADF-4 pochodzące od pająka ogrodowego Araneus diadematus wybrano jako matryce dla
konstruktów syntetycznych. Ciągła strategia klonowania pozwala na kontrolowaną
kombinację różnych modułów syntetycznego DNA, jak również naturalnych fragmentów
genu. Zaprojektowany wektor klonowania zawierał kasetę klonowania z sekwencją
rozdzielającą, przeznaczoną jako miejsce dla syntetycznych genów (Huemmerich et al.,
2004).
[0020] W celu naśladowania sekwencji powtórzeniowej ADF-4, zaprojektowano jednostkę
pojedynczego konserwatywnego powtórzenia, tak aby uzyskać jeden moduł konsensusowy,
określony jako C, który multimeryzowano w celu uzyskania białka powtórzeniowego C
16
,
które zostało wykorzystane w podejściu przedstawionym jako przykład.
[0021] Istnieje wiele możliwych zastosowań przedstawionych torebek/balonów z pajęczego
jedwabiu, poczynając od żywności funkcjonalnej do zastosowań farmaceutycznych i
kosmetycznych. Na przykład, kapsułkowanie w technologii żywności może ochronić pewne
składniki, takie jak witaminy przed utlenieniającym wpływem środowiska. W innym
zastosowaniu w technologii żywności, możliwe jest ukrycie smaku takich składników jak olej
z ryb. W zastosowaniach farmaceutycznych bariera dyfuzyjna otoczki białkowej pozwala na
powolny (kontrolowany) proces uwalniania zakapsułkowanego materiału. Dalsze
zaprojektowanie otoczki białkowej może dać w wyniku opakowanie o zdefiniowanym
uwalnianiu, które uwalnia zawartość jedynie po aktywacji z zastosowaniem określonych
proteaz lub innych czynników uruchomiających proces uwalniania. W kosmetykach, transport
składników aktywnych w wodzie do skóry może być ułatwiony poprzez przedstawione
torebki/balony, po powolnej degradacji otoczki białkowej, np., przez proteazy w skórze.
Ponadto, po nałożeniu na skórę uwolnienie zawartości może być osiągnięte poprzez
mechaniczne rozerwanie.
[0022] Niniejszy wynalazek w szczególności ukierunkowany jest na następujące aspekty i
zastosowania:
[0023] Zgodnie z pierwszym aspektem, niniejszy wynalazek dotyczy sposobu otrzymywania
nano- i mikrokapsułek, obejmującego następujące etapy:
a) dostarczenie białek pajęczego jedwabiu;

PZ/0505/RW
EP 1 757 276 B1
6
b) utworzenie roztworu lub zawiesiny wspomnianych białek w odpowiednim
rozpuszczalniku;
c) uzyskanie emulsji o przynajmniej dwóch fazach, wspomniana emulsja zawierająca roztwór
lub zawiesinę utworzoną w punkcie b) jako pierwszą fazę i przynajmniej jedną dodatkową
fazę, która jest zasadniczo niemieszalna ze wspomnianą pierwszą fazą;
d) utworzenie sieci polimerowej białek pajęczego jedwabiu na powierzchni zetknięcia
przynajmniej dwóch faz;
e) wydzielenie sieci polimerowej białek otrzymanych na etapie (d) z emulsji.
[0024] Jak wyjaśniono wyżej, nieoczekiwanie okazało się, że utworzenie sieci polimerowej
na etapie d) nie wymaga dodania kolejnych elementów (na przykład czynników sieciujących)
i nie ma potrzeby zastosowania dodatkowych etapów, jak spiekanie, sieciowanie itp.).
[0025] Wiadomo, że stosowany tu termin „białko pajęczego jedwabiu” nie tylko obejmuje
wszystkie naturalne sekwencje, ale również wszystkie pochodzące z nich sztuczne lub
syntetyczne sekwencje.
[0026] Zgodnie z powyższym, sekwencje jedwabiu pajęczego mogą pochodzić z sekwencji,
nazwanych jako „oryginalne”. Termin ten oznacza, że zastosowane sekwencje kwasu
nukleinowego wyizolowane są ze środowiska naturalnego, bez poddawania istotnym
zmianom ich sekwencji. Jedyną akceptowaną modyfikacją, która może wystąpić jest
zmodyfikowanie oryginalnej sekwencji kwasu nukleinowego w celu przystosowania tej
sekwencji do ekspresji w gospodarzu bez zmiany kodowanej sekwencji aminokwasowej.
Korzystnymi sekwencjami są NR3 (SEQ ID NO: 10; pochodząca z ADF-3) oraz NR4 (SEQ
ID NO: 11; pochodząca z ADF-4). W obu sekwencjach, dla bardziej wydajnej translacji,
kodon AGA (Arg), rzadko ulegający translacji u E.coli poddano mutacji do CGT (Arg) przy
zastosowaniu mutagenezy PCR.
[0027] Oryginalne, niepowtarzające się sekwencje pochodzą korzystnie z amino-końcowego,
nie zawierającego powtórzeń regionu (białka wiciowate, ang. flagelliform) i/lub
karboksylowego końca niepowtarzającego się regionu (białka wiciowate i białka nici ang.
dragline) naturalnie występującego białka jedwabiu pajęczego. Korzystne przykłady tych
białek zostaną wskazane poniżej.
[0028] Zgodnie z kolejną realizacją, oryginalne, nie powtarzające się sekwencje pochodzą z
amino-końcowego, niepowtarzającego się regionu (białka wiciowate) i/lub karboksylowego
końca niepowtarzającego się regionu (białka wiciowate i białka nici) naturalnie
występującego białka jedwabiu pajęczego.

PZ/0505/RW
EP 1 757 276 B1
7
[0029] Korzystne oryginalne sekwencje białek wiciowatych są sekwencjami
aminokwasowymi i sekwencjami kwasu nukleinowego z FlagN-NR (SEQ ID NO: 31 i 32)
oraz FlagC-NR (SEQ ID NO: 33 i 34).
[0030] Rekombinowane białka jedwabiu pajęczego według wynalazku mogą ogólnie
pochodzić z białek nici pajęczych (ang. dragline) z pajęczego głównego gruczołu przędnego
i/lub z białek pochodzących z gruczołu przędnego wydzielającego białka wiciowate (ang.
flagelliform).
[0031] Zgodnie z realizacją, rekombinowane (syntetyczne/sztuczne) białka jedwabiu
pajęczego, które mogą być zastosowane w niniejszym wynalazku ogólnie pochodzą z białek
nici pajęczych (ang. dragline) z gruczołów przędnych i/lub z białek pochodzących z
gruczołów białek wiciowatych.
[0032] Ogólnie, korzystnie jest wybrać sekwencje białka nici ang. dragline i/lub białka
wiciowatego, ang. flagelliform ze wspomnianych białek pochodzących z kulistych-
pajęczynowych pająków (Araneidae i Araneoids).
[0033] Korzystniej, białka nici i/lub białka wiciowate pochodzą z jednego lub więcej z
następujących pająków: Arachnura higginsi, Araneus circulissparsus, araneus diadematus,
Argiope picta, pająk krzyżakowaty (Argiope trifasciata), Nephila antipodiana, Cyrtophora
beccari, Celaenia excavata, czarno-biały pająk kolczasty (Gasteracantha kuhlii), czarno-żółty
pająk ogrodowy (Argiope aurantia), pająk Bolas (Ordgarius furcatus), Ordgarius magnificus,
Neoscona nautica, Neoscona rufofemorata, Zygiella calyptrata, pospolity pająk ogrodowy
(Parawixia dehaani), Neoscona oxancensis, Gasteracantha cancriformis (elipsoides),
Gasteracantha arcuata, Cyrtophora moluccensis, Cyrtophora parnasia, Dolophones conifera,
Dolophones turrigera, kolczasty pająk Doria (Gasteracantha doriae), Gasteracantha Mamosa,
Cyrtophora exanthematica, Aculeperia ceropegia, Eriophora pustulosa, Anepsion depressium,
Gasteracantha quadrispinosa, Eriophora transmarina, Araneus bicentenarius, baloniasty pająk
Nephila maculata, Gasteracantha hasseltii, Tegenaria atria, Heurodes turrita, Cyclosa insulina,
Astracantha minax, Araneus mitificus, Eriovixia laglaisei, Nephilengys malabarensis, Argiope
versicolor, Herennia omatissima, Argiope aemula, Cyrtophora unicolor, Cyrtophora hirta,
Argiope keyserlingi, Acusilas coccineus, pająk srebrny (Argiope argentata), Gasteracantha
cancriformis, Neoscona domiciliorum, Argiope aetheria, Argiope Keyserlingi, Foltys
illepidus, Arkys clavatus, Arkys lancearius, pająk dwukolczasty (Poecilopachys australasia),
gatunki Nephila, np., Nephila clavipes, Nephila senegalensis, Nephila madagascariensis i
dużo więcej (kolejne gatunki pająków, patrz również poniżej). Najkorzystniej, białka nici

PZ/0505/RW
EP 1 757 276 B1
8
pajęczej (ang.dragline) pochodzą z Araneus diadematus a białka wiciowate (ang. flagelliform)
pochodzą z Nephila clavipes.
[0034] W kontekście niniejszego wynalazku, powinno być jasne, że rekombinowane białko
jedwabiu pajęczego może zawierać nie tylko sekwencje białka z jednego gatunku, lecz
również sekwencje pochodzące z różnych gatunków pająka. Przykładowo, jedna lub więcej
syntetycznych sekwencji powtórzeniowych białka jedwabiu pajęczego może pochodzić z
jednego gatunku, jedna lub więcej oryginalnych autentycznych niepowtórzeniowych
sekwencji białka jedwabiu pajęczego z innego. Jako kolejny przykład, możliwe jest również
zaprojektowanie rekombinowanego białka jedwabiu pajęczego, które zawiera więcej niż
jeden typ sekwencji powtórzeniowej, przy czym różne typy pochodzą od różnych gatunków.
[0035] Zgodnie z korzystną realizacją, białko nici (ang. dragline) jest dzikim typem ADF-3,
ADF-4, MaSp I, MaSp II a białkiem flagelliny jest FLAG. Termin ADF-3/-4 zastosowano w
kontekście białek MaSp produkowanych przez Araneus diadematus (Araneus diadematus
fibroin-3/-4). Oba białka, ADF-3 i -4 należą do klasy białek MaSp II (białka spidroiny II, ang.
major ampullate spidroin II).
[0036] W kolejnej realizacji, zastosowaną sekwencją kwasu nukleinowego jest ADF-3 (SEQ
ID NO:1) i/lub ADF-4 (SEQ ID NO:2) lub ich wariant.
[0037] Wiadomo, że w wynalazku rozważane są dwa różne rodzaje ADF-3 i ADF-4
sekwencji kodujących oraz białek: po pierwsze, opublikowana już sekwencja ADF-3 i ADF-4
(tutaj: sekwencja „dzikiego typu”) oraz, po drugie, ich wariant, kodowany przez SEQ ID NO:
1 (ADF-3) oraz 2 (ADF-4). Sekwencje dzikiego typu zostały już opublikowane i są dostępne
pod numerem przyjęcia U47855 oraz U47856 (SEQ ID NO: 8 i 9).
[0038] Kolejnymi białkami jedwabiu pajęczego, które mogą być zastosowane w niniejszym
wynalazku (tj. pojedynczo lub w kombinacji z innymi białkami) oraz ich numery przyjęcia w
bazie danych są następujące:
Spidroina 2 [Araneus bicentenarius]gi׀2911272
Główne białko 1 nici jedwabnej gruczołu przędnego, ang. major ampullate gland dragline silk
protein-1 [Araneus ventricosus] gi׀27228957
Główne białko 2 nici jedwabnej gruczołu przędnego, ang. major ampullate gland dragline silk
protein-2 [Araneus ventricosus] gi׀27228959 ampullate spidroin 1 [Nephila
madagascariensis]gi׀13562006
Główne białko spidroiny 1, ang. Major ampullate spidroin 1 [Nephila senegalensis]
gi׀13562010

PZ/0505/RW
EP 1 757 276 B1
9
Główne białko spidroiny 1, ang. major ampullate spidroin 1 [Latrodectus geometricus
gi׀13561998
Główne białko spidroiny I, ang. major ampullate spidroin I [Argiope trifasciata] gi׀13561984
Główne białko spidroiny I, ang. major ampullate spidroin I [Agriope aurantia] gi׀13561976
Białko niciowe spidroiny 2, ang. dragline silk protein spidroin 2 [Nephila clavata]
gi׀16974791
Główne białko spidroiny 2, ang. major ampullate spidroin 2 [Nephila senegalensis]
gi׀13562012
Główne białko spidroiny 2, ang major ampullate spidroin 2 [Nephila madagascariensis]
gi׀13562008
Główne białko spidroiny 2, ang major ampullate spidroin 2 [Ladrodectus geometricus]
gi׀13562002
[0039] Zgodnie z inną, korzystną realizacją, białkiem typu wiciowatego (ang. flagelliform)
jest SEQ ID NO: 6 (FlagN) oraz/lub SEQ ID NO: 7 (Flag-C) lub ich wariant.
[0040] Jednakże, mogą być zastosowane również znane już i opublikowane sekwencje białek
wiciowatych, w szczególności następujące:
sekwencja białka jedwabiu: Flagelliform silk protein partial cds [Nephila clavipes]gi׀2833646
oraz białka Flagelliform silk protein partial cds [Nephila clavipes]gi׀2833648
[0041] W jednej z korzystnych realizacji, rekombinowane białko jedwabiu pajęczego zawiera
jedną lub więcej syntetycznych sekwencji powtórzeniowych zawierających jedną lub więcej
konsensowych sekwencji zawierających polialaninę. Wspomniane polialaninowe sekwencje
mogą zawierać od 6 do 9 reszt alaninowych. Patrz, na przykład SEQ ID NO: 1, zawierająca
kilka motywów polialaninowych z 6 reszt alaniny.
[0042] Korzystnie, sekwencja konsensusowa zawierająca polialaninę pochodzi z ADF-3 i
posiada sekwencję aminokwasową SEQ ID NO: 3 (moduł A) lub ich wariant. Moduł A
zawiera polialaninę posiadającą 6 reszt alaninowych. Kolejną korzystną sekwencją
konsensusową, zawierającą polialaninę, pochodzącą z ADF-4, jest moduł C (SEQ ID NO: 5),
zawierający 8 reszt alaninowych.
[0043] Zgodnie z kolejną korzystną realizacją, w rekombinowanym białku jedwabiu
pajęczego według wynalazku, syntetyczna sekwencja powtórzeniowa pochodzi z ADF-3 i
zawiera jedno lub więcej powtórzeń sekwencji aminokwasowej SEQ ID NO: 4 (moduł Q) lub
ich wariant.
[0044] Ogólniej, syntetyczna sekwencja powtórzeniowa może również zawierać ogólne
motywy: GGX lub GPGXX, tj. regiony bogate w reszty glicyny. Jak wspomniano powyżej,

PZ/0505/RW
EP 1 757 276 B1
10
regiony te będą zapewniać białku elastyczność, a przez to również powierzchni utworzonej z
rekombinowanego białka jedwabiu pajęczego zawierającego wspomniane motywy.
[0045] Wiadomo, że specyficzne moduły dla syntetycznych jednostek powtórzeniowych do
zastosowania w niniejszym wynalazku mogą być również razem łączone, tj., moduły
(powtarzające się jednostki) łączące A i Q, Q i C itp. są również objęte niniejszym
wynalazkiem. Mimo że liczba modułów, które mogą być wprowadzone do białka pajęczego
jedwabiu nie jest ograniczona, korzystnie jest wykorzystać liczbę modułów syntetycznej
jednostki powtórzeniowej dla każdego rekombinowanego białka, która to liczba należy
korzystnie do przedziału od 5-50 modułów, korzystniej 10-40 i najkorzystniej między 15-35
modułami.
[0046] Syntetyczna sekwencja powtórzeniowa korzystnie zawiera jedną lub więcej (AQ) i/lub
(QAQ) jako jednostki powtórzeniowe. Nawet bardziej korzystnie, syntetyczną sekwencją
powtórzeniową jest (AQ)
12
, (AQ)
24
, (QAQ)
8
lub (QAQ)
16
.
[0047] W przypadku, gdy syntetyczna sekwencja powtórzeniowa pochodzi z ADF-4, może
korzystnie zawierać jedno lub więcej powtórzeń sekwencji aminokwasowej SEQ ID NO:5
(moduł C) lub jego wariant, jak wspomniano powyżej, w którym ogólną całkowitą
syntetyczną sekwencją powtórzeniową jest C
16
lub C
32
.
[0048] Korzystnymi realizacjami dla w pełni rekombinowanych białek jedwabiu pajęczego
według wynalazku są (QAQ)
8
NR3, (QAQ)
16
NR3, (AQ)
12
NR3, (AQ)
24
NR3, C
16
NR4 i
C
32
NR4 tj., białka, które zawierają lub składają się ze wspomnianych sekwencji.
[0049] Należy zauważyć, że powyższa konfiguracja syntetycznej sekwencji powtórzeniowej
(stosując układ A, Q i C), stosuje się również do wszystkich innych jednostek
powtórzeniowych ujawnionych powyżej, na przykład każda sekwencja zawierająca
polialaninę może być wzięta za A i/lub C i wszystkie sekwencje bogate w reszty glicyny
mogą być użyte jako Q.
[0050] Nowe moduły dla sztucznych, powtórzeniowych sekwencji pochodzących z sekwencji
białek wiciowatych są modułami K (SEQ ID NO: 35 i 36), sp (SEQ ID NO: 37 i 38), X (SEQ
ID NO: 39 i 40) oraz Y (SEQ ID NO: 41 i 42).
[0051] Sztuczna powtórzeniowa sekwencja również korzystnie zawiera lub składa się z Y
8
,
Y
16
, X
8
, X
16
, K
8
, K
16
.
[0052] Ponadto, możliwe jest również połączenie tych sekwencji pochodzących z ADF-3 i
ADF-4 oraz Flag w jedną rekombinowaną sekwencję.

PZ/0505/RW
EP 1 757 276 B1
11
[0053] W niniejszym wynalazku jednakże silnie preferowane jest wykorzystanie białek
jedwabiu pajęczego w etapie a) które zostały wybrane z lub zawierają sekwencje z grupy
sekwencji ADF-4 i ich pochodnych, włączając C
16
, C
16
NR4, C
32
i/lub C
32
NR4.
[0054] Zgodnie z kolejną realizacją, rozpuszczalnik w b) oraz/lub rozpuszczalniki
przynajmniej jednej dodatkowej fazy, wybrane są z grupy obejmującej rozpuszczalniki
hydrofilowe, korzystnie wodę, alkohole jak etanol, glicerol lub rozpuszczalniki lipofilowe,
korzystnie oleje naturalne, takie jak oleje pochodzenia roślinnego lub zwierzęcego, oleje
syntetyczne, takie jak migliol, olej silikonowy, rozpuszczalniki organiczne, takie jak
węglowodory aromatyczne, na przykład toluen, benzen, etc.
[0055] Należy zauważyć, że jedna pojedyncza faza może zawierać również więcej niż jeden
rozpuszczalnik (tj. mieszaninę) tak długo dopóki rozpuszczalniki te są istotnie identyczne.
„Istotnie identyczne” oznacza, że rozpuszczalniki posiadają podobne właściwości
rozpuszczalności, a zatem tworzą jedynie jedną wspólną fazę. W związku z powyższym,
„istotnie identyczne” rozpuszczalniki obejmują rozpuszczalniki, w których nie można
zaobserwować rozdzielonych faz po zmieszaniu rozpuszczalników. Przykładowo, dwa lub
więcej rozpuszczalniki lipofilowe mogą być połączone w jedną fazę, na przykład olej roślinny
(na przykład olej z oliwek i olej rycynowy) oraz migliol i/lub heksadekan. Ponadto, jako
alternatywa, faza hydrofilowa może zawierać dwa lub więcej składników hydrofilowych, na
przykład wodę, glicerol i tym podobne.
[0056] Jak wspomniano powyżej, wymagane jest jedynie aby układ emulsyjny do
otrzymywania nano- i mikrokapsułek według wynalazku posiadał przynajmniej dwie fazy,
przy czym fazy te są zasadniczo istotnie niemieszalne.
[0057] W etapie c) niniejszego wynalazku mogą być wykorzystane dobrze znane typy
emulsji, na przykład rodzaje emulsji W/O, O/W, O/W/O lub W/O/W. Wspomniane typy
emulsji są dobrze znane w dziedzinie, pozostałe informacje znajdują się w podanym tytułem
referencji „Remington’s Pharmaceutical Science”, Mack Publishing Co., Easton, PA, ostatnie
wydanie lub inne dostępne informacje.
[0058] Korzystnym sposobem formowania emulsji według niniejszego wynalazku jest
otrzymywanie miniemulsji. Miniemulsje są układem zdyspergowanym o krytycznej
stabilności kropelek wielkości od 50 do 500 nm, otrzymanymi poprzez naruszenie układu
zawierającego olej, wodę, surfaktant i substancję hydrofobową. Polimeryzacja w takich
miniemulsjach, gdy ostrożnie prowadzona, daje w wyniku cząstki około takiej samej
wielkości jak początkowe kropelki. Oznacza to, że odpowiednie przygotowanie miniemulsji
zahamowuje koalescencję kropelek lub proces dojrzewania Ostwalda. Miniemulsje

PZ/0505/RW
EP 1 757 276 B1
12
przygotowuje się za pomocą silnie ścinających urządzeń, takie jak homogenizatory
ultradźwiękowe lub wysokociśnieniowe. W ramach odnośników literaturowych poleca się
publikacje K.Landfestera i współpracowników.
[0059] W przypadku emulsji typu W/O, faza W (hydrofilowa) tworzy kropelki emulsji i w
tym przypadku, białka jedwabiu pajęczego zawarte są w fazie W. Faza O jest fazą lipofilową i
tworzy fazę ciągłą.
[0060] W przypadku emulsji typu O/W, faza O (lipofilowa) tworzy kropelki emulsji i w tym
przypadku, białka jedwabiu pajęczego zawarte są w fazie O. Faza W jest fazą hydrofilową i
tworzy fazę ciągłą.
[0061] Surfaktanty zastosowane w powyższych emulsjach mogą być wybrane ze związków,
które specjalista w dziedzinie użyje w oparciu o dostępną wiedzę w dziedzinie farmacji i nauk
pokrewnych. Przykładowym wyborem surfaktantów do zastosowania do otrzymywania
niniejszych emulsji są estry kwasów tłuszczowych gliceroli, sorbitolu i innych alkoholi
wielofunkcyjnych, korzystnie, monostearynianu glicerolu, monolaurynianu sorbotanu lub
monolenianu sorbitanu; poloksaminy; etery polioksyetylenowe i estrypolioksyetylenowe;
triglicerydy etoksylowane; fenole etoksylowane i difenole etoksylowane; sole metali kwasów
tłuszczowych; sole metali siarczanów alkoholi tłuszczowych; sodowy siarczan laurylu oraz
sole metali sulfobursztyniany; polisorbaniany, korzystniej polisorbonian 20, 40, 60 i 80;
poloksamery, glikolepolioksyetylenowe; oraz mieszaniny wspomnianych substancji.
[0062] Jednakże, wyraźnie zauważono, że zastosowanie surfaktantu nie jest zasadniczą cechą
niniejszego wynalazku. Specjalista w dziedzinie posiada wiedzę o układach emulsyjnych,
które nie wymagają surfaktantów.
[0063] W korzystnej realizacji niniejszego wynalazku, rozpuszczalnik użyty w 1b) zawiera
ponadto jeden lub więcej czynników farmaceutycznych, środków kosmetycznych, produktów
spożywczych lub substancji dodawanych do żywności. W takim przypadku, jeden lub więcej
ze składników będzie zakapsułkowanych w sieci polimerowej, utworzonej na zetknięciu faz.
[0064] Jako alternatywa, możliwe jest również dodanie wyżej wymienionych środków do
fazy ciągłej, która nie zawiera białek pajęczego jedwabiu. W tym przypadku, nano- i
mikrokapsułki według wynalazku będą pokryte wspomnianymi środkami.
[0065] Jako kolejna alternatywa, środki mogą być wprowadzone do nano- i mikrokapsułek
według wynalazku po uzyskaniu ich zgodnie z niniejszym sposobem.
[0066] Można tego dokonać poprzez spęcznienie membrany określonymi rozpuszczalnikami i
pozostawienie aby substancja zawarta w kapsułce (środek czynny) uległa dyfuzji do środka.
Spęcznienie może być również osiągnięte poprzez zastosowanie temperatury, ciśnienia lub

PZ/0505/RW
EP 1 757 276 B1
13
nie tylko rozpuszczalników, ale również innych środków chemicznych (takich jak czynniki
chemiczne, pH i inne).
[0067] Możliwe jest również włączenie substancji zakapsułkowanej do membrany. Takie
podejście może dać zmienione lub polepszone właściwości uwalniania, niż stosowanie
substancji zawartej w środku kapsułki.
[0068] Rodzaj środka dodatkowo włączonego do nano- i mikrokapsułek według wynalazku
nie jest w żaden sposób ograniczony.
[0069] Na przykład, czynnik farmaceutyczny może być wybrany z grupy zawierającej środki
przeciwbólowe; nasenne i uspokajające; leki do leczenia zaburzeń psychiatrycznych, takich
jak depresja i schizofrenia; przeciwpadaczkowe i przeciwdrgawkowe; leki do leczenia
choroby Parkinsona i Huntingtona, chorób związanych z procesem starzenia się i choroby
Alzheimera; leki ukierunkowane na leczenie urazu CNS lub udaru; leki do leczenia
uzależnienia i nadużywania leków; środki chemoterapeutyczne na infekcje pasożytnicze i
choroby wywołane przez mikroorganizmy; środki immunosupresyjne i leki przeciwrakowe;
substancje diagnostyczne o zastosowaniu w medycynie; środki immunoaktywne i
immunoreakcyjne; antybiotyki; środki przeciwspazmatyczne; leki przeciwhistaminowe;
zapobiegające mdłościom; relaksujące; pobudzające; mózgowo rozszerzające;
psychotropowe; rozszerzające i zwierające naczynia; leki przeciwko nadciśnieniu; leki
przeciwmigrenowe; nasenne, leki przeciw hiperglikemii i środki hiperglicemiczne;
przeciwastmowe; środki przeciwwirusowe; oraz ich mieszaniny.
[0070] Produkty spożywcze i substancje dodawane do żywności mogą być wybrane z grupy
obejmującej witaminy (kwas askorbinowy, octan tokoferolu i tym podobne), minerały (na
przykład wapń, magnez, sód), pierwiastki śladowe (selen), ekstrakty pochodzenia
naturalnego, oleje naturalne (olej z ryby) itp.
[0071] Środki kosmetyczne mogą być wybrane na przykład z octanu tokoferolu, olei
pochodzenia naturalnego lub syntetycznego, pantenolu, ekstraktów roślinnych, związków
absorbujących UV, środków dezynfekujących, środków łagodzących podrażnienia, środków
odstraszających owady.
[0072] Należy zauważyć, że środki mogą być obecne w rozpuszczalniku w postaci
rozpuszczonej, zawiesinie lub formie stałej. W ostatnim przypadku, dostarczony jest stały
rdzeń, opłaszczony przez białka jedwabiu pajęczego według niniejszego wynalazku.
[0073] W korzystnej realizacji, rozdzielenie sieci polimerowej na etapie e) dokonane jest za
pomocą wirowania lub poprzez zniszczenie emulsji utworzonej na etapie c) i utworzenie

PZ/0505/RW
EP 1 757 276 B1
14
roztworu jednofazowego. Jednakże, w celu rozdzielenia nano- i mikrokapsułek według
niniejszego wynalazku z układu emulsji mogą być zastosowane również inne sposoby.
[0074] Temperatura zastosowana w etapie b)-e) wynosi 5-40
°C, korzystnie 10-30 i
korzystniej temperatura pokojowa. Ph zastosowane w etapie b)-e) wynosi 3-9. korzystnie 5-8,
korzystniej 7.
[0075] Wielkość kropelek emulsji i pochodzących z niej nano- i mikrocząsteczek wynosi
korzystnie od 10 nm do 20
µm, korzystnie mieści się w przedziale między 500 nm a 10 µm,
najkorzystniej wynosi około 5
µm. Grubość ścianki otrzymanych nano- i mikrokapsułek
mieści się korzystnie w przedziale 5 do 100 nm, korzystniej między 10 a 70 nm (patrz
przykład Fig.5).
[0076] W drugim aspekcie, niniejszy wynalazek zapewnia nano- i mikrokapsułki uzyskiwane
za pomocą sposobu ujawnionego powyżej.
[0077] Trzeci aspekt niniejszego wynalazku ukierunkowany jest na kompozycję
farmaceutyczną zawierającą nano- i mikrokapsułki, jak zdefiniowano wyżej, oraz jeden lub
więcej z dopuszczalnych farmaceutycznie nośników. Zatem, aktywne składniki według
niniejszego wynalazku są korzystnie stosowane w takich kompozycjach farmaceutycznych w
dawkach wymieszanych z dopuszczalnym nośnikiem lub materiałem nośnikowym, które
pozwalają na leczenie lub przynajmniej złagodzenie schorzenia. Taka kompozycja może
(oprócz składnika aktywnego i nośnika) zawierać materiał wypełniający, sole, bufor,
substancje stabilizujące, środki zwiększające rozpuszczalność i inne materiały znane w stanie
techniki.
[0078] Termin „dopuszczalne farmaceutycznie” zdefiniowano jako materiał nietoksyczny,
który nie koliduje i nie wpływa negatywnie na skuteczność aktywności biologicznej składnika
aktywnego. Wybór nośnika zależy od zastosowania.
[0079] Kompozycja farmaceutyczna może zawierać dodatkowe składniki zwiększające
aktywność aktywnego składnika lub uzupełniające leczenie. Takie dodatkowe składniki i/lub
czynniki mogą stanowić część kompozycji farmaceutycznej, pozwalając na osiągniecie efektu
synergistycznego lub zminimalizowanie efektów ubocznych i niepożądanych skutków
podania kompozycji.
[0080] Techniki formulacji lub przygotowywania i zastosowania/podawania składników
według niniejszego wynalazku opublikowano w „Remington’s Pharmaceutical Science”,
Mack Publishing Co., Easton, PA, najnowsze wydanie (patrz również jak powyżej).
Odpowiednie zastosowanie może obejmować na przykład podanie doustne, doskórne lub

PZ/0505/RW
EP 1 757 276 B1
15
błony śluzowe i podanie pozajelitowe, włączając zastrzyki domięśniowe, podskórne,
doszpikowe, jak również wstrzyknięcie dooponowe, bezpośrednio dokomorowe, dożylne,
wewnątrzotrzewnowe lub wewnątrznosowe.
[0081] W czwartym aspekcie, niniejszy wynalazek zapewnia produkt kosmetyczny lub
żywnościowy zawierający nano- i mikrokapsułki, zgodnie tym, jak opisano powyżej.
[0082] Wynalazek został zilustrowany następnie towarzyszącymi mu figurami, na których:
Na Figurze 1 przedstawiono (a) dynamiczne rozproszenie światła hydrodynamicznego
promienia peptosomu R
H
w funkcji stężenia NaCl i pH. (b) Schematyczne przedstawienie
peptosomu i zmian jego wielkości w funkcji pH w wyniku spowodowane zwinięciem i
przejściem do drugorzędowej struktury
α-helisy w części peptydu.
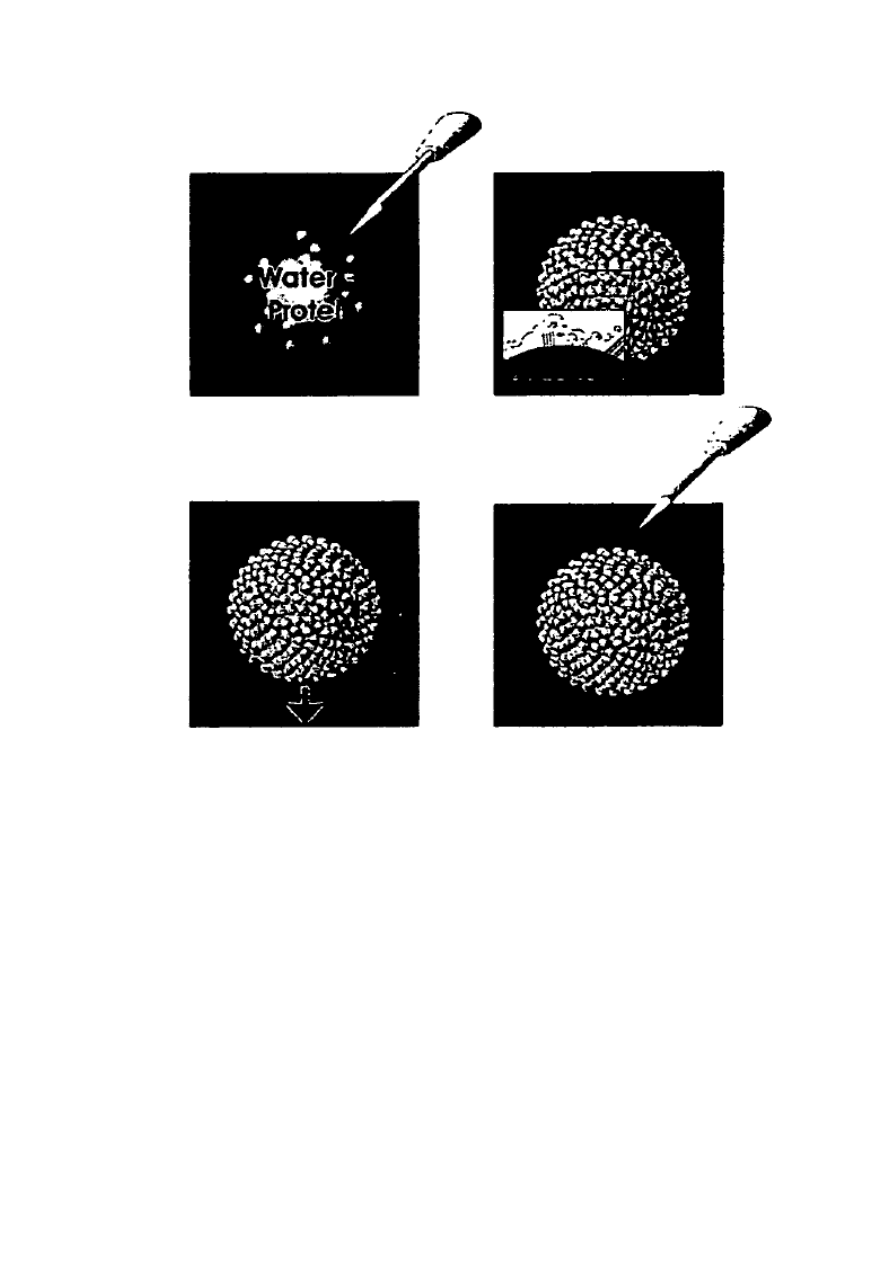
Na Figurze 2 przedstawiono schematycznie proces tworzenia torebek/balonów pajęczych. (A)
Wodna zawiesina białka jest emulsyfikowana w toluenie. (B) Białko ulega adsorbcji na
powierzchni styku faz woda-toluen i ulega denaturacji tworząc sieć polimerową (Inset). (C)
Po adsorpcji, sieć białkowa może zostać przeniesiona do wody poprzez odwirowanie.
Ostateczne struktury typu torebki/balony posiadają wodę wewnątrz i wodę po zewnętrznej
stronie. (D) Alternatywnie, po adsorpcji, białkowa sieć może być przeniesiona do
jednofazowego roztworu poprzez dodanie etanolu.
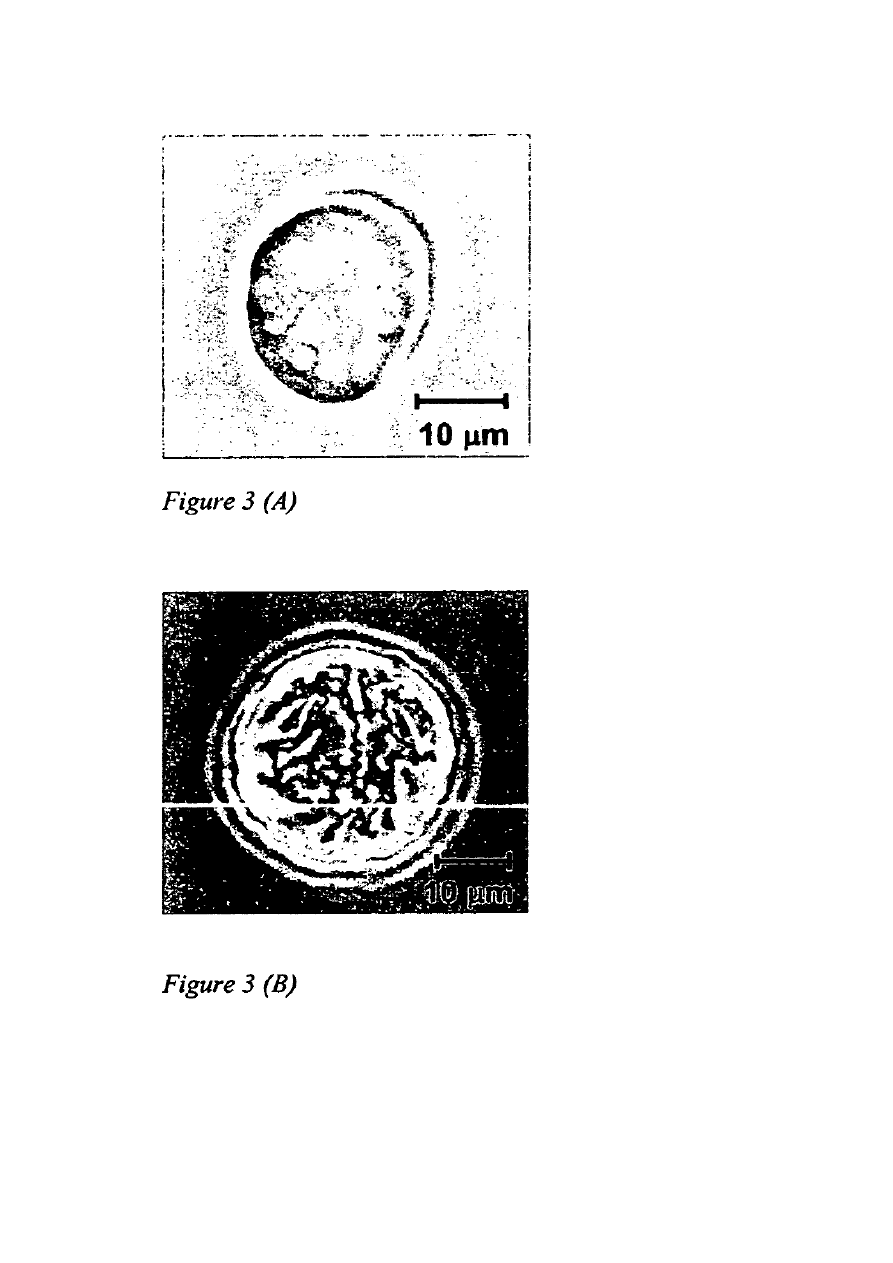
Na Figurze 3 przedstawiono obraz torebek/balonów pajęczych w (A) toluenie/etanolu (50:50)
oraz (B) po przeniesieniu do wody.
Na Figurze 4 przedstawiono obraz torebek/balonów pajęczych wypełnionych znakowanym
FITC dekstranem (MW 500 kDa) po przeniesieniu do ciągłej fazy wodnej: (A) obraz na
jasnym polu. (B) obraz fluorescencyjny.
Na Figurze 5 przedstawiono wysuszone torebki/balony pajęcze na obrazie SEM. Grubość
membrany określono jako mniejszą niż 70 nm.
Przykłady:
Preparacja białka
[0083] Roztwór białka, z którego utworzone były pajęcze balony został otrzymany w wyniku
początkowego rozpuszczenia rekombinowanego białka pajęczych jedwabnych nici (C
16
, patrz
Huemmerich et al., 2004) w stężeniu 10 mg/ml w 6M tiocyjanianie guanidyny. Roztwór

PZ/0505/RW
EP 1 757 276 B1
16
białka schłodzono do 4
°C i obniżono stężenie tiocyjanianu guanidyny do poniżej 1 mM
poprzez dializę roztworu białka wobec 10 mM buforu Tris, pH 8.0 przez noc z użyciem
worków dializacyjnych z Carl Roth GmbH o rozmiarze cząsteczkowym 14 kDa. Usunięto
poprzez odwirowanie dializowanego roztworu niezdyspergowane białko, przez 30 minut, przy
sile 100.000x g i utrzymywaniu roztworu w temperaturze 4
°C. Końcowe stężenie roztworu
białka określano stosując adsorpcję UV, z wykorzystaniem współczynnika absorpcji
właściwego dla białka 0.859, przy długości fali 276 nm.
Formowanie torebek/balonów
[0084] Torebki/balony pajęczego jedwabiu otrzymywano poprzez emulgowanie 5
µl
dializowanej zawiesiny białka w 300
µl toluenu przez 90 sekund (Figura 2A). Podczas
emulgowania, białko jedwabiu ulega adsorbcji i zmienia konformację swojej struktury na
powierzchni kropel emulsji, co daje w wyniku sieć polimerową, w której zakapsułkowane są
krople emulsji (Figura 2B). Torebki/balony z pajęczego jedwabiu zostały utworzone przy
użyciu zawiesin białka w zakresie stężenia od 1 do 6 mg/ml i tak krótkiego czasu
powstawania emulsji, jak 20 sekund. Wielkość powstałych torebek/balonów zależy od
wielkości kropelek emulsji.
[0085] Po utworzeniu, powłoki białkowe otaczające kropelki emulsji zostały przeniesione z
emulsji dwufazowej do roztworu jednofazowego. W efektywnym przeniesieniu otoczek
białkowych skuteczne są dwa sposoby. W pierwszym sposobie, 300
µl wody dodano do
toluenu w celu utworzenia podwarstwy wodnej. Otoczki białkowe otaczające kropelki wody
odwirowano z warstwy toluenowej do podwarstwy wodnej przy sile 100xg przez 4 minuty
(Figura 2C). W drugim sposobie, w celu rozpuszczenia toluenu i wody, utworzono
jednofazowy roztwór poprzez dodanie 300
µl etanolu do dwuwarstwowej emulsji (Figura
2D). Uzyskane struktury badano pod mikroskopem po zastosowaniu którejkolwiek metody
przeniesienia torebek/balonów do roztworu jednofazowego (Figura 3).
[0086] Integralność poddanej wirowaniu powłoki białkowej o kształcie balonu sprawdzano
poprzez dodanie 0.5 % wag., znakowanych FITC, 500 kDa dekstranu (Sigma-Aldrich) do
roztworu białka przed procesem wytwarzania emulsji. Po uzyskaniu emulsji i odwirowaniu,
powstałe, podobne do balonu struktury, wykazywały cały czas fluorescencję, co wskazywało
na to, że powłoka białkowa tych struktur nie została rozerwana podczas wirowania (Figura 4).
[0087] Chécot F, Lecommandoux S, Gnanou Y, Klok HA (2002) Angew. Chem. Int. Ed. 41,
1339

PZ/0505/RW
EP 1 757 276 B1
17
Chécot F, Lecommandoux S, Klok HA, Gnanou Y (2003) Euro. Phys. J. E 10, 25
Dinsmore AD, Hsu MF, Nikolaides MG, Marquez M, Bausch AR, Weitz DA. (2002)
Colloidosomes: Selectively permeable capsules composed of colloidal particles. Science
298(5595):1006-1009.
Y.-Y. Won, H. Davis, F. Bates, Science 283, 960 (1999)
Huemmerich D, Helsen CW, Quedzuweit S, Oschmann J, Rudolph R, Scheibel T (2004)
Primary structure elements of spider dragline silks and their contribution to protein solubility.
Biochemistry 43: 13604-12
Scheibel T (2004) Spider silks: recombinant synthesis, assembly, spinning, and engineering of
synthetic proteins, Microbial Cell Factories 3, 14
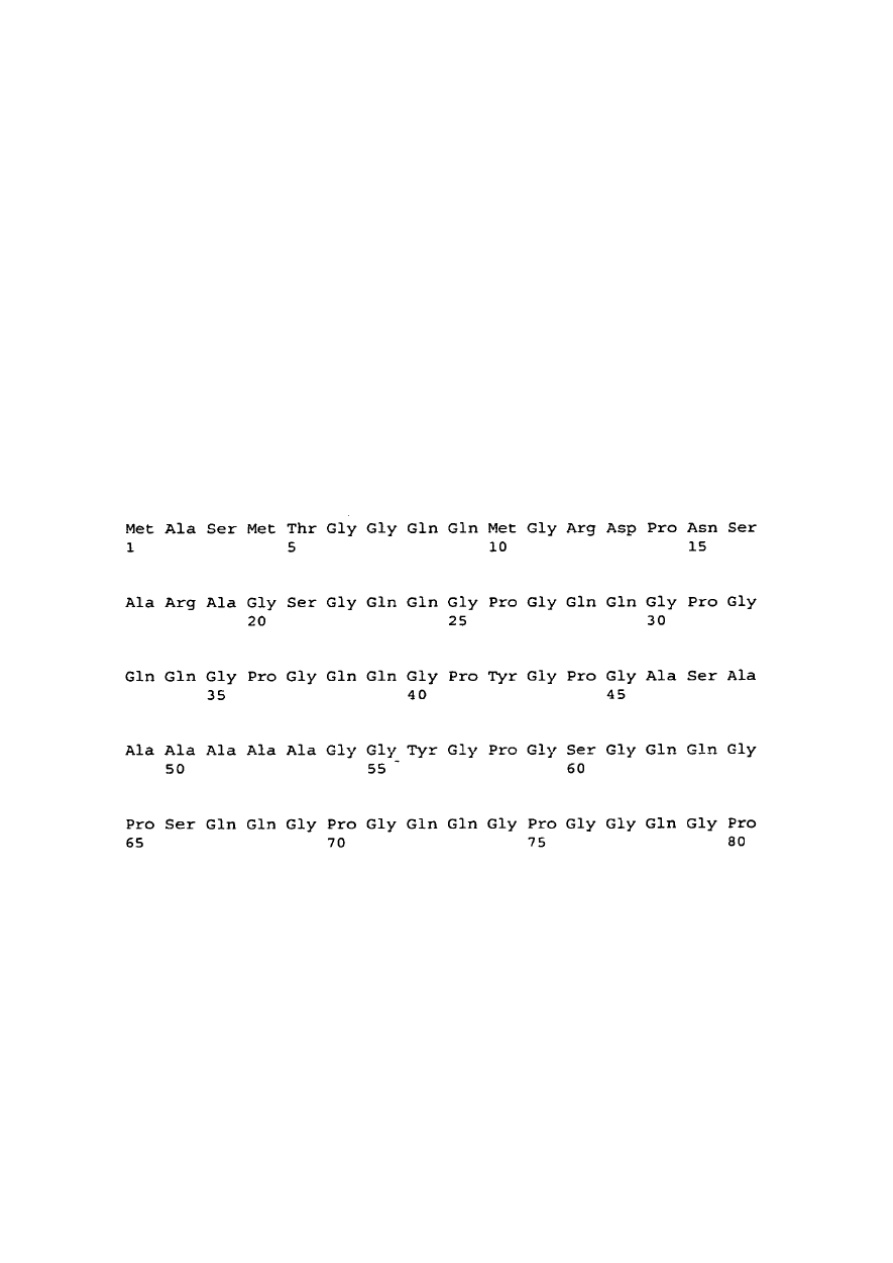
PZ/0505/RW
EP 1 757 276 B1
18
WYKAZ SEKWENCJI
[0088]
< 110> Uniwersytet Techniczny, Monachium
<120> Sposób otrzymywania nano- i mikrokapsułek
<130> P19184
<160> 55
<170> PatentIn Wersja 3.1.
<210> 1
<211> 653
<212> PRT
<213> Araneus diadematus
<400> 1

PZ/0505/RW
EP 1 757 276 B1
19

PZ/0505/RW
EP 1 757 276 B1
20

PZ/0505/RW
EP 1 757 276 B1
21

PZ/0505/RW
EP 1 757 276 B1
22

PZ/0505/RW
EP 1 757 276 B1
23

PZ/0505/RW
EP 1 757 276 B1
24

PZ/0505/RW
EP 1 757 276 B1
25

PZ/0505/RW
EP 1 757 276 B1
26

PZ/0505/RW
EP 1 757 276 B1
27

PZ/0505/RW
EP 1 757 276 B1
28

PZ/0505/RW
EP 1 757 276 B1
29

PZ/0505/RW
EP 1 757 276 B1
30
PZ/0505/RW
EP 1 757 276 B1
31

PZ/0505/RW
EP 1 757 276 B1
32

PZ/0505/RW
EP 1 757 276 B1
33

PZ/0505/RW
EP 1 757 276 B1
34

PZ/0505/RW
EP 1 757 276 B1
35

PZ/0505/RW
EP 1 757 276 B1
36

PZ/0505/RW
EP 1 757 276 B1
37

PZ/0505/RW
EP 1 757 276 B1
38

PZ/0505/RW
EP 1 757 276 B1
39

PZ/0505/RW
EP 1 757 276 B1
40

PZ/0505/RW
EP 1 757 276 B1
41

PZ/0505/RW
EP 1 757 276 B1
42

PZ/0505/RW
EP 1 757 276 B1
43

PZ/0505/RW
EP 1 757 276 B1
44

PZ/0505/RW
EP 1 757 276 B1
45

PZ/0505/RW
EP 1 757 276 B1
46

PZ/0505/RW
EP 1 757 276 B1
47

PZ/0505/RW
EP 1 757 276 B1
48

PZ/0505/RW
EP 1 757 276 B1
49

PZ/0505/RW
EP 1 757 276 B1
50

PZ/0505/RW
EP 1 757 276 B1
51

PZ/0505/RW
EP 1 757 276 B1
52

PZ/0505/RW
EP 1 757 276 B1
53

PZ/0505/RW
EP 1 757 276 B1
54

PZ/0505/RW
EP 1 757 276 B1
55

PZ/0505/RW
EP 1 757 276 B1
56

PZ/0505/RW
EP 1 757 276 B1
57

PZ/0505/RW
EP 1 757 276 B1
58

PZ/0505/RW
EP 1 757 276 B1
59

PZ/0505/RW
EP 1 757 276 B1
60

PZ/0505/RW
EP 1 757 276 B1
61

PZ/0505/RW
EP 1 757 276 B1
62
Zastrzeżenia patentowe
1. Sposób otrzymywania nano- i mikrokapsułek obejmujący etapy:
a) dostarczenia białek pajęczego jedwabiu;
b) utworzenie roztworu lub zawiesiny wspomnianych białek w odpowiednim
rozpuszczalniku;
c) otrzymanie emulsji o przynajmniej dwóch fazach; przy czym wspomniana emulsja
zawiera roztwór lub zawiesinę uzyskane w b) jako pierwszą fazę i przynajmniej jedną,
kolejną fazę, która jest istotnie niemieszalna ze wspomniana fazą pierwszą;
d) utworzenie sieci polimerowej białek jedwabiu pajęczego na styku powierzchni
przynajmniej dwóch faz;
e) rozdzielenie białkowej sieci polimerowej otrzymanej w (d) od emulsji.
2. Sposób według zastrz. 1, znamienny tym, że białka jedwabiu pajęczego dostarczone w
a) wybrane są z grupy ADF-4 i ich pochodnych, włączając C16, C16NR4, C32,
C32NR4.
3. Sposób według zastrz. 1 albo 2, znamienny tym, że rozpuszczalnik w b) oraz/albo
rozpuszczalniki przynajmniej jednej dodatkowej fazy wybrane są z grupy obejmującej
rozpuszczalniki hydrofilowe, korzystnie wodę i alkohol albo rozpuszczalniki
lipofilowe, korzystnie oleje naturalne lub oleje syntetyczne.
4. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że emulsja
utworzona w c) jest typu W/O, O/W, O/W/O albo W/O/W.
5. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że
rozpuszczalnik zastosowany w 1b) zawiera ponadto jeden lub więcej czynników
farmaceutycznych, środków kosmetycznych, produktów spożywczych lub dodatków
żywnościowych.
6. Sposób według zastrz. 5, znamienny tym, że czynnik farmaceutyczny występuje w
rozpuszczalniku w postaci rozpuszczonej, zawieszonej lub stałej.
7. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że
rozdzielenia sieci polimerowej w etapie e) dokonuje się poprzez zastosowanie
środków wirowania lub poprzez zniszczenie emulsji utworzonej w etapie c) i
uzyskanie roztworu jednofazowego.
8. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że
temperatura zastosowana w etapach b) – e) wynosi 5-40
°C, korzystnie 10-30 i
najkorzystniej jest temperatura pokojową, przy czym pH zastosowane w etapach b) –
e) wynosi 3-9, korzystnie 5-8, korzystniej 7.

PZ/0505/RW
EP 1 757 276 B1
63
9. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że wielkość
kropelek emulsji i pochodząca z nich nano- i mikrocząsteczek wynosi od 100 nm do
20
µm, korzystnie między 500 nm a 10 µm, najkorzystniej około 5 µm.
10. Sposób według jednego lub więcej z poprzednich zastrz., znamienny tym, że grubość
ścianki uzyskanych nano- i mikrokapsułek wynosi między 5 a 100 nm, korzystnie
miedzy 10 a 70 nm.
11. Nano- i mikrokapsułka uzyskana za pomocą sposobu według jednego lub wiecej
zastrz. od 1 do 10.
12. Kompozycja farmaceutyczna zawierająca nano- i mikrokapsułki według zastrz. 11
oraz dopuszczalny farmaceutycznie nośnik.
13. Produkt kosmetyczny lub żywnościowy zawierający nano- i mikrokapsułki według
zastrz. 11.
PZ/0505/RW
EP 1 757 276 B1
64
Figura 1: (a) dynamiczne rozpraszanie światła peptosomu o hydrodynamicznym
promieniu R
H
jako funkcja stężenia NaCl i pH. (b) schematyczne przedstawienie
peptosomu i jego zmian wielkości jako funkcja pH wywoływanych przez skręcanie do
drugorzędowej struktury α-helisy w części peptydu.
PZ/0505/RW
EP 1 757 276 B1
65
Figura 2: Schematyczne przedstawienie procesu tworzenie torebki / balonu pająka. (A)
wodna zawiesina białek jest emulgowana w toluenie. (B) białko adsorbuje na powierzchni
faz woda-toluen i ulega denaturacji tworząc sieć polimerową (Inset). (C) po adsorpcji sieć
białkowa może być przeniesiona poprzez odwirowanie do wody. Ostateczne struktury
torebki / balonu posiadają wodę w środku i wodę na zewnątrz. (D) alternatywnie, po
adsorpcji, sieć białkowa może być przeniesiona do jednofazowego roztworu poprzez
dodanie etanolu.
PZ/0505/RW
EP 1 757 276 B1
66
Figura 3: Obraz pajęczych torebek / balonów w (A) toluenie / etanolu (50:50) i (B) po
przeniesieniu do wody

PZ/0505/RW
EP 1 757 276 B1
67
Figura 4. Obraz pajęczych torebek / balonów wypełnionych dekstranem znakowanym
FITC (MW 500kDa) po przeniesieniu do wodnej fazy ciągłej: (A) obraz na jasnym tle. (B)
obraz fluorescencyjny

PZ/0505/RW
EP 1 757 276 B1
68
Figura 5: Suszone pajęcze torebki / balony zobrazowane w SEM. Grubość błony
określono na mniejszą niż 70nm.
Document Outline
Wyszukiwarka
Podobne podstrony:
Bootloader dla mikrokontrolerów AVR
02 Mikroklimat
Mikrokontrolery Grodzki Sprawoz Nieznany
evboard, Płytka testowa dla mikrokontrolerów AT89S oraz AVR
Konfiguracja pamięci mikrokontrolera 8051 dla programów napisanych w języku C
Mikroklimat TEST nr 2, inż. BHP, V semestr
mim, studia Polibuda Informatyka, III semestr, mikroprocesory i mikrokontrolery (mim)
sprawozdanie mikroklimat i pomiary jego parametrów w środowisku górniczym
Mikroklimat kalkulatory
Mikrokontrolery F Marecki id 30 Nieznany
mikrokomputer 5
Mikrokomputer edukacyjny z 8051 cz 2
ZL5PRG Programator mikrokontrol Nieznany
06 ERGONOMIA MIKROKLIMAT
Mikrokontrolery ARM cz18
Jedwab
więcej podobnych podstron